氯化锂-匹罗卡品癫痫模型中海马神经元钾通道Kv1.1的表达变化
2021-05-10祝萍萍范红星梁瑞华陈江瑛谭燕萍
祝萍萍 范红星 梁瑞华 陈江瑛 谭燕萍

【摘要】 目的:研究A型鉀通道亚型Kv1.1在癫痫大鼠海马神经元中的蛋白表达和电生理功能变化,初步探讨Kv1.1在癫痫发生中的作用和意义。方法:2019年1-12月选取24只成年雄性SD大鼠,根据随机数字表法分为对照组和模型组,每组12只。模型组通过向腹腔注射氯化锂-匹罗卡品制备癫痫模型,对照组采用0.9%氯化钠溶液代替处理。每组6只进行免疫印记和电生理检测。利用Western blot方法检测并比较两组海马区Kv1.1的蛋白表达。利用全细胞膜片钳技术记录并观察两组海马区锥体神经元细胞膜上总的外向钾离子电流和Kv1.1介导的钾电流变化。结果:模型组海马区Kv1.1的蛋白表达量低于对照组(P<0.05)。全细胞膜片钳结果显示:与对照组相比,癫痫模型组海马区锥体神经元总的外向钾电流峰值曲线右移,钾电流峰值从膜电压-40 mV开始明显下降(P<0.05)。与对照组相比,模型组海马区锥体神经元Kv1.1介导的钾电流峰值曲线右移,峰值从膜电压-30 mV开始明显下降(P<0.05)。结论:癫痫模型中海马区Kv1.1的蛋白表达降低和其介导的钾电流的下降,提示其表达变化可能与癫痫的发生相关。
【关键词】 Kv1.1 氯化锂-匹罗卡品 癫痫
[Abstract] Objective: To study the protein expression and electrophysiological function changes of type A potassium channel subtype Kv1.1 in hippocampal neurons of epileptic rats, and to preliminarily explore the role and significance of Kv1.1 in the occurrence of epilepsy. Method: From January to December 2019, a total of 24 adult male SD rats were selected and divided into control group and model group according to the random number table method, with 12 rats in each group. The model group was prepared epilepsy model by peritoneal injection of Lithium Chloride-Pilocarpine, and the control group was treated with 0.9% Sodium Chloride Solution instead. Immunoimprinting and electrophysiological tests were performed on 6 rats in each group. The protein expression of Kv1.1 in the hippocampus was detected and compared between the two groups by Western blot. The changes of total outward potassium current and Kv1.1-mediated potassium current on the cell membrane of pyramidal neurons in the two groups were recorded and observed by whole cell patch clamp technique. Result: The protein expression of Kv1.1 in the hippocampus of the model group was lower than that of the control group (P<0.05). Whole-cell patch clamp results showed that, compared with the control group, the peak curve of total outward potassium current of pyramidal neurons in the hippocampus of the model group shifted to the right, and the peak value of potassium current decreased significantly from the membrane voltage -40 mV (P<0.05). Compared with the control group, the peak curve of Kv1.1-mediated potassium current in the hippocampal pyramidal neurons shifted to the right in the model group, and the peak value decreased significantly from the membrane voltage -30 mV (P<0.05). Conclusion: The decreased Kv1.1 protein expression in hippocampus and the decreased potassium current mediated by Kv1.1 in the epileptic model suggest that the changes in its expression may be related to the occurrence of epilepsy.
[Key words] Kv1.1 Lithium Chloride-Pilocarpine Epilepsy
癫痫是临床上常见的神经内科疾病,其发病机制为脑内神经元的异常放电所致的神经细胞兴奋性增高[1]。中枢系统神经细胞的电压门控型钾离子通道(voltage-gated potassium channel,Kv)是动作电位复极化过程的主要成分,在调节神经元的兴奋性方面起着重要作用[2-3]。A型钾离子电流属于电压门控型钾离子通道家族重要成员之一,广泛分布于中枢神经系统,精细调控着神经细胞的各种功能,包括细胞分化与凋亡、神经元的兴奋性、神经递质的释放以及神经网络信号传递等[4-5]。Kv1.1是A型钾离子通道基因家族的亚族,其开放形成的电流是A型钾离子电流动作电位复极化早期外向电流的重要组成部分,可调节静息膜电位的稳定性,减慢去极化速度,起到延缓动作电位产生等作用[6]。本研究利用氯化锂-匹罗卡品建立神经兴奋性增高的SD大鼠癫痫模型,通过免疫印迹和膜片钳技术分析A型钾通道亚型Kv1.1在海马区锥体神经元中的表达和电生理功能,为癫痫的发病机制提供新的实验依据,现报道如下。
1 材料与方法
1.1 材料 (1)实验动物。选取24只周龄为5~8周,
体重200~250 g的SPF级雄性SD大鼠,购于广东省医学实验动物中心,许可证号:SCXK(粤)2018-0002。大鼠饲养环境通风良好,光照周期为12 h,环境温度为25 ℃,湿度为50%~60%,饲养期间自由摄食和饮水。(2)主要试剂和仪器。主要试剂:氯化锂(生产厂家:美国Sigma公司,货号:L9650,规格:100 g),匹罗卡品(生产厂家:上海阿拉丁公司,货号:P129614,规格:250 mg),东莨菪碱(生产厂家:上海阿拉丁公司,货号:S129958,规格:1 g),辣根过氧化物酶标记的山羊抗兔Kv1.1抗体和兔抗大鼠GAPDH抗体购置于英国Abcam公司;DTX-κ购于美国Sigma公司,全蛋白提取试剂盒;BCA蛋白含量试剂盒购自碧云天生物技术研究所;SDS-PAGE凝胶试剂盒购于广州展晨生物技术有限公司;PVDF膜购置于美国Millipore公司。主要仪器:Axonpatch 200B膜片钳放大器和Digidata 1440A膜片钳转换器均购于Axon Instrument公司;MP-285微电极操控器、P-97玻璃电极拉制仪和全细胞膜片钳玻璃电极均购于Sutter Instrumen公司;防震台购于Technical Manufacturing Corp;BX51WI正置显微镜购于日本Olympus公司;VT1200S脑片震动切片机购于德国Leica公司;垂直电泳仪购自美国 Bio Rad公司。
1.2 方法
1.2.1 实验分组和制备癫痫鼠模型 实验时间:2019年1-12月。24只大鼠根据随机数字表法分为对照组和模型组,每组12只。模型组采用经典的氯化锂-匹罗卡品癫痫鼠模型制作方法。首先经鼠腹腔注射新鲜配制的氯化锂溶液(180 mg/kg),24 h后腹腔注射东莨菪碱(1 mg/kg),30 min 后再腹腔注射匹罗卡品(30 mg/kg)。如30 min后未出现癫痫发作的小鼠,可经腹腔重复注射鹽酸匹罗卡品(10 mg/kg)直至诱导癫痫发作。对照组采用0.9%氯化钠溶液代替处理。根据Racine分级进行癫痫发作评定,判定模型是否成功,模型组均达Ⅳ~Ⅴ级发作。每组6只进行免疫印记和电生理检测。
1.2.2 Western blot 每组6只大鼠经麻醉后立即分离海马,每100 g组织加入1 mL蛋白裂解液,进行匀浆、离心,提取上清液即为细胞总蛋白,BCA法进行蛋白浓度定量。采用每孔上样量为100 μg计算上样体积,并加入等体积上样缓冲液,放入100 ℃沸水中煮沸5 min变性,待样品冷却至室温后上样。进行SDS-PAGE凝胶电泳反应,切胶,转至PDVF膜,5%脱脂奶粉封闭2 h,再加入Kv1.1的一抗,抗体稀释比例为1︰1 000,4 ℃冰箱孵育过夜,次日洗膜后,加入二抗孵育1 h。洗膜后,加入化学发光液ECL试剂反应3 min后,保鲜膜包裹,暗室进行X光胶片曝光,目标条带密度即为相应的蛋白含量。采用Quantity One图像分析系统观察各蛋白条带,测量目的条带光密度值,并与GADPH光密度值比较进行半定量分析。
1.2.3 全细胞膜片钳 (1)鼠海马脑片制备。每组6只大鼠经麻醉后,迅速断头取脑,置于用氧混合气(95%O2+5%CO2)饱和0.5 h以上的0 ℃人工脑脊液(arifieial cerebrospinal fluid,ACSF)中冷却2~5 min,然后取将脑片以冠状面垂直固定在振动切片机的标本托上。在0 ℃和氧混合气条件下,用振动切片机(参数:振幅0.9 mm,速度1.7 mm/s,层厚300 μm)将海马沿长轴平行其横向的纤维走向切成6~8片。将脑片置于氧混合气饱和的ACSF中,室温下孵育60 min待用。分离好的脑片可在4~6 h内,保持良好的生理活性状态。(2)脑片膜片钳全细胞记录。将孵育好后的脑片放入脑片记录浴槽中,持续灌流已经氧混合的ACSF,流速为1~2 mL/min,在室温下进行实验。在正置显微镜和CCD Camera的视野下,用低倍镜找到脑片海马,再调节高倍镜选取海马锥体细胞层神经元。再调节微电极操纵器,将冲入正压的玻璃电极置于脑片皮层上,调整钳制模式为电压钳模式(V-clamp),在membrane test界面下,选择边界清楚、形态饱满具有锥体形态和顶树突的神经元。继续将微电极操纵器移至该细胞,观察放大器输出到探头的去极化测试脉冲(5 mV)形成的测试方波形态和数值。当数值增加至少0.1 MΩ时,表示电极尖端与细胞表面接触,适度负压吸引;当封接电阻>1 GΩ时,通过嘴吸或者放大器电击(ZAP)破膜形成全细胞记录。全细胞记录形成后,在电压钳模式下,钳制膜电位在-80 mV,给予细胞跃阶电压刺激,方案如下:给予-100~40 mV跃阶电压刺激,时长为500 ms,step=10 mV。向灌流液中加入1 μM TTX,100 μM CdCl2分别阻断钠电流、钙电流,就可以分离出总的外向钾离子电流。然后,再向灌流液中加入Kv1.1的特异性阻断剂DTX-κ(100 nM)阻断全细胞外向钾电流,并给予细胞上述跃阶电压刺激,将以上得到的两个电压钳图形使用CLAMPfit软件相减,就分离出Kv1.1介导的钾离子电流。
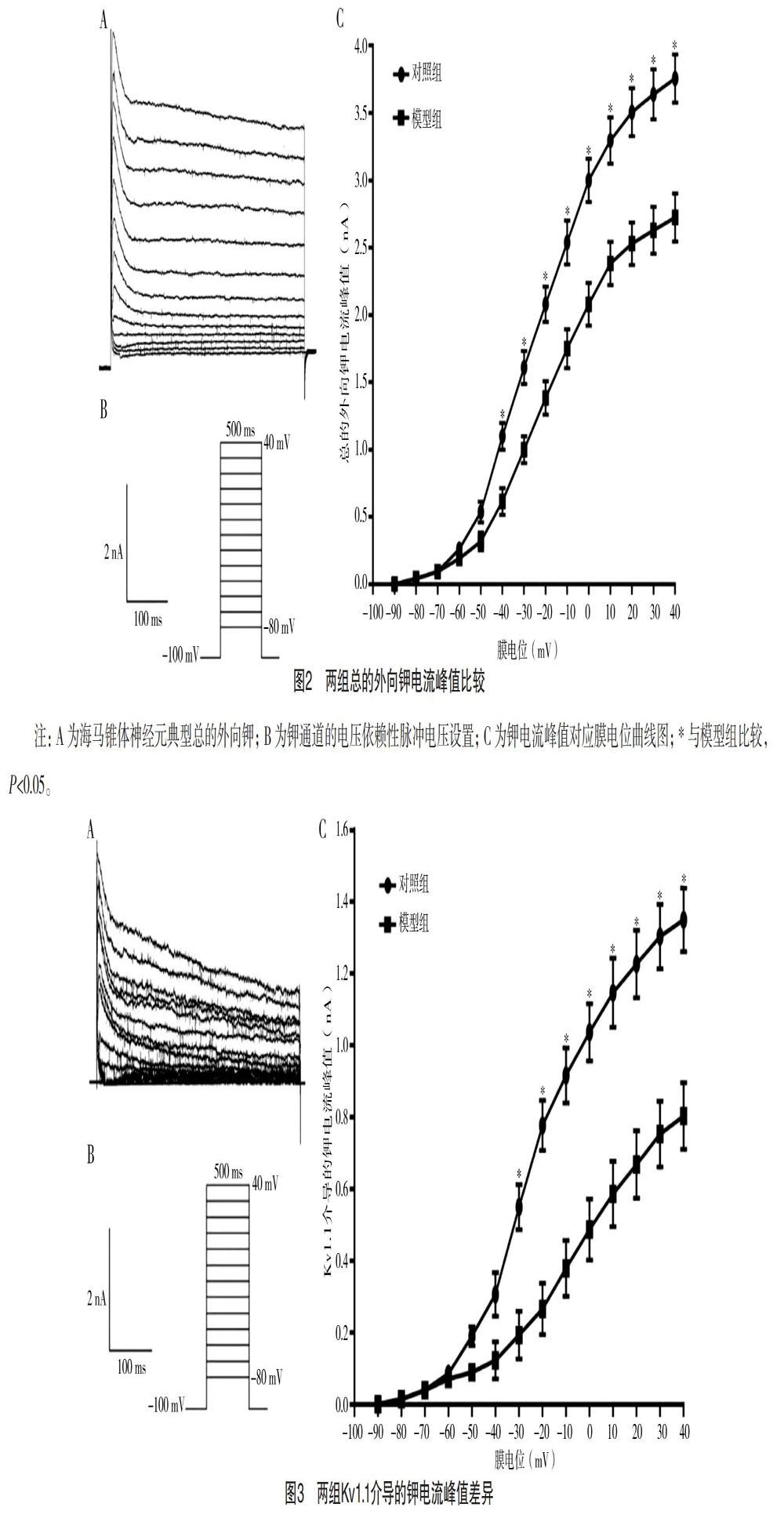
1.3 观察指标 (1)比较两组Kv1.1蛋白相对表达量。(2)海马区总的外向钾离子电流变化。通过向ACSF中灌流相关药物和给予一定的跃阶电压后,分离出了总的外向钾离子电流。以钾电流峰值对应膜电位绘制曲线,比较对照组和模型组锥体神经元钾通道功能差异。(3)Kv1.1介导的钾离子电流变化。在分离出总的外向钾离子电流的基础上,继续加用Kv1.1的选择型抑制剂DTX-κ,最终得到A型钾离子电流亚型Kv1.1介导的钾电流。以Kv1.1介导的钾电流峰值对应膜电位绘制曲线,比较对照组和模型组锥体神经元的通道功能差异。
1.4 统计学处理 采用SPSS 23.0软件对所得数据进行统计分析,计量资料用(x±s)表示,比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组海马区Kv1.1蛋白表达量比较 模型组海马区Kv1.1蛋白相对表达量(0.64±0.16)低于对照组(1.61±0.21),差异有统计学意义(P<0.05),见图1。
2.2 海马区总的外向钾离子电流变化 与对照组相比,模型组钾电流峰值对应膜电位曲线右移,钾电流峰值从跃阶电压-40 mV开始明显下降,差异均有统计学意义(P<0.05),见图2。
2.3 Kv1.1介导的钾离子电流变化 与对照组相比,模型组Kv1.1介导的钾电流峰值对应膜电位曲线右移,海马区锥体神经元Kv1.1介导的钾离子电流峰值明显降低,从跃阶电压-30 mV开始明显下降,差异均有统计学意义(P<0.05),见图3。
3 讨论
癫痫是神经系统最常见疾病之一,给社会和家庭带来巨大负担[7-8]。随着二代测序技术的普及,发现越来越多的基因与癫痫的发生相关[9]。其中有约1/4的单基因遗传性癫痫是由于钾离子或钠离子通道基因异常导致的[10]。Kv1.1是由Kcna1基因编码,属于A型电压门控型钾离子通道家族,在中枢神经系统尤其是海马组织中高表达[11]。Kv1.1通过参与调节静息膜电位的稳定性,减慢去极化速度,延缓动作电位,来起到调控神经细胞和肌肉细胞兴奋性,以及突触信号传递等重要作用[12]。
Kcna1基因突变致使Kv1.1表达减少或该通道的电生理特性发生变化,在该基因敲除的小鼠海马区钾电流明显降低时,神经细胞兴奋性增加,继而出现癫痫发作,在人类可引起发作性共济失调Ⅰ型[13-14]。除了Kv1.1的突变可以导致癫痫外,由此发生的神经细胞超兴奋性可以损害心脏节律,甚至发生癫痫性猝死[15]。本研究在经典的氯化锂-匹罗卡品癫痫大鼠模型中,与正常大鼠相比,氯化锂-匹罗卡品癫痫模型大鼠Kv1.1的蛋白表达量明显降低,全细胞膜片钳分离出Kv1.1介导的钾离子电流峰值幅度显著下降。推测可能是Kv1.1的蛋白表达量的减少,进一步破坏了Kv1.1通道电生理功能,改变了神经元细胞膜上的离子通道开放和关闭,使细胞内外钠-钾等离子流动性紊乱,导致了该部位的神經细胞兴奋性增高,最终出现了临床上的痫性发作[16]。这可能是癫痫患者神经元兴奋性增高的又一重要电生理机制。
但是,既往也有学者针对Kv1.1的研究得出相反的结论,实验中利用小干扰RNA沉默Kv1.1基因,导致凋亡神经元IA的动作电位幅度降低,反而促使神经元活性增强。研究者进一步加入Kv1.1电流的特异性抑制剂DTX,使Kv1.1电流幅度降低,起到了较好的神经保护作用[17]。为什么Kv1.1在神经元兴奋性和细胞损伤调控中发挥的作用相异,笔者认为,造成上述相反的研究结果,可能是因为Kv1.1在不同的动物模型和大脑不同组织结构中存在表达差异,不同层面和水平的研究结果可能混淆了其中复杂的精细调控。近年来,研究发现Kv1.1具有一种转录后调控机制,即RNA编辑[18]。目前,在众多的电压门控钾离子通道家族中,仅发现Kv1.1的A-I RNA编辑在哺乳动物和人类中存在[18]。既往有学者报道Kv1.1的RNA编辑效率在海人酸诱导的癫痫动物模型的鼻侧皮质比正常升高4倍[19]。推测Kv1.1在转录后过程中可能受到某些因子的影响,才导致蛋白和通道功能产生差异。因此,明确A型钾离子电流亚型Kv1.1在神经元兴奋性调节和细胞损伤中的作用和机制至关重要,本研究的结果为后续针对Kv1.1在癫痫发生机制的深入研究奠定了实验基础。
参考文献
[1]姜永生,宋婷婷,张小鸽,等.345例儿童癫痫和癫痫综合征发作类型临床分析[J].临床儿科杂志,2019,37(11):812-815.
[2]袁树华,李艾帆.电压门控钾离子通道复合物相关抗体脑炎7例分析[J].神经损伤与功能重建,2019,14(4):166-168,193.
[3] Ranjan R,Logette E,Marani M,et al.A Kinetic Map of the Homomeric Voltage-Gated Potassium Channel(Kv)Family[J].Front Cell Neurosci,2019,13:358.
[4] Kim J H,Ki Y,Lee H,et al.The voltage-gated potassium channel Shaker promotes sleep via thermosensitive GABA transmission[J].Commun Biol,2020,3(1):174.
[5] Zemel B M,Ritter D M,Covarrubias M,et al.A Type KV Channels in Dorsal Root Ganglion Neurons:Diversity,Function,and Dysfunction[J].Front Mol Neurosci,2018,11:253-257.
[6] Lahoria R,Pittock S J,Gadoth A,et al.Clinical-pathologic correlations in voltage-gated Kv1 potassium channel complex-subtyped autoimmune painful polyneuropathy[J].Muscle Nerve,2017,55(4):520-525.
[7]梁树立.重视老年癫痫的外科治疗[J].中华老年心脑血管病杂志,2018,20(8):785-787.
[8]王冰玉,李世绰,郭岩.不同地区门诊癫痫患者的诊疗及经济负担现状分析[J].中国社会医学杂志,2017,34(4):391-394.
[9] Oyrer J,Maljevic S,Scheffer I E,et al.Ion channels in Genetic Epilepsy:From Genes and Mechanisms to Disease Targeted Thempies[J].Pharmacol Rev,2018,70(1):142-173.
[10] Trimmer J S.Subcellular localization of K+channels in mammalian brain neurons:remarkable precision in the mjdst of extraordinary complexity[J].Neuron,2015,85(2):238-256.
[11] Lahoria R,Pittock S J,Gadoth A,et al.Clinical-pathologic correlations in voltage-gated Kv1 potassium channel complex-subtyped autoimmune painful polyneuropathy[J].Muscle Nerve,2017,55(4):520-525.
[12] Bean B P.The action potential in mammalian central neurons[J].Nat Rev Neurosci,2007,8(6):451-465.
[13] Wenzel H J,Vacher H,Clark E,et al.Structural consequences of Kcna1 gene deletion and transfer in the mouse hippocampus.[J].Epilepsia,2007,48(11):2023-2046.
[14] Ferrick-Kiddie E A,Rosenthal J J,Ayers G D,et al.Mutations underlying Episodic Ataxia type-1 antagonize Kv1.1 RNA editing[J].Sci Rep,2017,7:41095
[15] Trosclair K,Dhaibar H A,Gautier N M,et al.Neuron-specific Kv1.1 deficiency is sufficient to cause epilepsy,premature death,and cardiorespiratory dysregulation[J].Neurobiol Dis,2020,137:1014759.
[16] Fan J,Shan W,Yang H,et al.Neural Activities in Multiple Rat Brain in Lithium-Pilocarpine-Induced Status Epilepticus Model[J].Front Mol Neurosci,2019,12:323.
[17] Hu C L,Zeng X M,Zhou M H,et al.Kv1.1 is associated with neuronal apoptosis and modulated by protein kinase C in the rat cerebellar granule cell[J].J Neurochem,2008,106(3):1125-1137.
[18] Streit A K,Matschke L A,Dolga A M,et al.RNA editing in the central cavity as a mechanism to regulate surface expression of the voltage-gated potassium channel Kv1.1[J].J Biol Chem,2014,289(39):26762-26771.
[19] Streit A K,Derst C,Wegner S,et al.RNA editing of Kv1.1 channels may account for reduced ictogenic potential of 4-aminopyridine in chronic epileptic rats[J].Epilepsia,2011,52(3):645-648.
(收稿日期:2020-05-20) (本文編辑:田婧)
