雌性母鼠高脂肪暴露对子代糖脂代谢、卵巢功能的影响及与多囊卵巢综合征发病的关系研究*
2021-05-10古兰托合提木拉提叶尔努尔吐苏甫汗马玉兰玛依努尔尼亚孜
古兰·托合提木拉提,叶尔努尔·吐苏甫汗,马玉兰,玛依努尔·尼亚孜
(1.新疆自治区人民医院医院 生殖医学科,新疆 乌鲁木齐830001;2.新疆医科大学第二附属医院 影像中心,新疆 乌鲁木齐830063)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)在育龄妇女中发病率为5%~10%,是引起不孕、月经异常等的主要原因[1]。由于PCOS 内分泌异常涉及卵巢、下丘脑、肾上腺、垂体等多个器官,其生化改变、发病机制、临床表现异质性较高,确切病因尚未阐明[2]。最近一项研究发现,维吾尔族女性患者BMI 较高、体内具有高雄激素的表现者,后代更易患PCOS,提示肥胖与PCOS 发病率有关,但其发病机制尚不明确[3-4]。目前关于PCOS的研究较多,但主要基于在不孕门诊就诊的育龄期女性,对青春期患者关注不足,且受伦理的限制,对宫内环境因素致病作用的报道较少。本研究探讨异常糖、脂代谢对子代小鼠卵巢功能与PCOS 发病率的机制与相关性,现报道如下。
1 材料与方法
1.1 主要试剂、仪器
Trizol (北京艾德莱生物科技有限公司),M-MLV Reverse Transcriptase (RNase H)、5×RT Reaction Buffer、ddH2O (DNase/RNase Free)(美国Genecopoeia 公司),RNase Inhibitor、dNTP Mixture(北京全氏金生物技术有限公司),50×ROX Reference Dye、2×All-in-one tm qPCR Mix (美国VAZYME 公司),Ex Taq TM、DL2000 DNA Marker(日本TaKaRa 株式会社),引物由北京擎科新业生物技术有限公司合成;760型全自动生化检测仪(日本日立株式会社),快速血糖仪(瑞士罗氏公司),离心机(美国Eppendorf 公司),电子秤(上海呈丰衡器有限公司),RM 2016 轮转式病理切片机(德国Leica 公司),切片刀(日本羽毛公司,R35一次性刀片),JK-6 生物组织摊烤片机(武汉俊杰电子有限公司),载玻片及盖玻片(江苏世泰实验器材有限公司),BX53 型生物显微镜(日本奥林巴斯株式会社),QuantStudio 6 型实时荧光定量PCR 仪(美国ABI 公司),分光光度计(上海舜宇恒科学仪器有限公司),电热恒温水浴锅(北京市长风仪器仪表有限公司),微波炉(韩国LG 公司),AJY-0501 型超级纯水仪(美国艾科浦公司),pH 计(德国Metter-Toledo GmbH 公司),电子天平称(北京赛多利斯仪器系统有限公司),紫外分析仪(北京君意东方电泳设备有限公司)。
1.2 实验动物
4 周龄SD 鼠(新疆医科大学动物实验中心)[实验动物许可证号:SCXK(新)20130001]。SD鼠适应性喂养1 周后,按雌雄3∶1 合笼,环境温度20~23℃,湿度40%~60%,自由进水,每日光照12 h,噪音<60 dB。次日清晨观察各笼雌鼠有无阴道栓脱落,如同一载玻片有3 处不同视野发现精子计为阳性,当日记为妊娠第1 天,未妊娠者继续合笼饲养,合笼2 周未妊娠者放弃。期间给予的普通饲料购自新疆医科大学动物实验中心,热量分配:糖类62%、脂肪13%、蛋白质25%。
1.3 分组
雌鼠受孕后随机分为宫内高脂肪膳食组(HFI组)、宫内及哺乳期高脂肪膳食组(HFII 组)和正常膳食组(NC 组),每组15 只。NC 组全程给予普通饲料,HFI 组妊娠期给予高脂肪饲料,HFII 组妊娠期、哺乳期均给予高脂肪饲料。饲料均购自新疆医科大学动物实验中心,普通饲料的热量分配:糖类62%、脂肪13%、蛋白质25%,常温保存。高脂肪饲料的热量分配:糖类20%、脂肪60%、蛋白质20%,置入-20℃冰箱保存。
1.4 方法
每天观察雌鼠妊娠及产子情况。出生后每周测仔的体重,第3 周时离乳并雌雄分笼,弃雄仔。每笼养5~6 只,第4 周起检查雌仔阴道细胞涂片,1 次/d,直至实验结束。操作方法:用沾有生理盐水的棉签,于每日早晨轻轻插入大鼠阴道后缓慢转动,获取黏液标本,细胞涂片,自然干燥。使用瑞士姬姆萨染色,镜下观察。动情前期:可见大量圆形有核上皮细胞,少量角化上皮细胞;动情期:可见大量角化上皮细胞,少量圆形有核上皮细胞;动情后期:可见角化上皮细胞及大量白细胞。动情间期:可见少量白细胞,有核扁平上皮细胞及少量黏液。
1.4.1 空腹血糖、血清胰岛素测定各组雌仔6 周时夜间禁食12 h,次日行尾部取血1 ml,即刻采用血糖仪及配套试纸测定静脉全血葡萄糖水平为空腹血糖(fasting blood glucose concentration, FBG)。取血后4℃下静置1 h,以5 000 r/min 离心5 min,取上清,-80℃冷藏,采用双抗体夹心ELISA 法测血清空腹胰岛素水平(fasting serum insulin concentration, FINS)。计算胰岛素敏感指数(insulin sensitivity index, ISI):ISI=1/(FBG×FINS),胰岛素抵抗指数(homeostasis model assessment -insulin resistance index, HOMA-IR)=(FBG×FINS)/22.5。采用全自动生化分析仪测定甘油三酯(Triglyceride,TG)水平。
进行静脉糖耐量试验(IPGTT)和胰岛素释放试验(IRT),用20%葡萄糖按2 g/kg 腹腔注射,葡萄糖负荷15 min、30 min、60 min 及120 min 后,取尾静脉血0.5 ml,即刻测血糖、胰岛素水平。
1.4.2 动物处理、生殖内分泌水平检测10%水合氯醛(4 ml/kg)腹腔注射麻醉后,开腹,迅速取卵巢组织,用电子天平秤测量卵巢湿重,并计算脏器系数,脏器系数= 脏器的重量(g)/体 重(100 g),再置于4%多聚甲醛中固定。常规脱水,石蜡包埋,5μm 厚度切片,常规脱蜡,水化,苏木精5 min,伊红衬染2 min,脱水,透明,封片,显微镜下观察各组大鼠的卵巢形态学变化。
暴露胸部,注射器在心脏取血,分离血清,置于-20℃保存待测。采用放射免疫法测定血清雌激素(E2)、孕激素(P)、促黄体生成素(LH)、睾酮(T)水平。
1.4.3 实时荧光定量聚合酶链反应检测脂肪组织雄激素转化酶的表达取皮下脂肪和内脏脂肪组织,通过实时荧光聚合酶链反应(qRT-PCR)检测雄激素转化酶3β 羟类固醇脱氢酶1(3β-HSD1)、3β 羟类固醇脱氢酶2(3β-HSD2)、3β 羟类固醇脱氢酶5(3β-HSD5)、17β 羟类固醇脱氢酶1(17β-HSD1)、5ɑ 还原酶1(5ɑ-R1)mRNA 相对表达量。
取-80℃冰箱保存的新鲜冷冻组织,重量约为100 mg,加入1 ml Trizol 试剂,用匀浆器研磨成浆,移至无RNase 的1.5 ml EP 管中,裂解10 min。加入200 μl 氯仿,剧烈颠倒混匀数次,室温放置5 min。4℃、 12 000 r/min 离心15 min, 可见分成上(RNA)、中(蛋白)、下(DNA)三相。转移上层水相(约400 μl)于另一新1.5 ml EP 管中,加入400 μl 异丙醇,混匀后室温静置10 min。4℃、12 000 r/min 离心10 min,管底可见白色的RNA 沉淀。弃上清,加入无RNase 的75%乙醇1 ml,涡旋混匀后,4℃、10 000 r/min 离心5 min,并重复1次。弃上清,空气中干燥RNA 沉淀5~10 min,将沉淀溶于20 μl 的DEPC 水中。取溶解后的RNA 2 μl 用微量分光光度计测定OD260、OD280,计算OD260/OD280 值和RNA的纯度、浓度。根据OD260/OD280 估测RNA 质量,比值在1.8~2.0 满足实验要求。将总RNA 放于-80℃冰箱内保存以备用。 qRT-PCR 引物序列见表1, 取上述RNA 3.199 μg,加入寡聚核苷酸引物2 μl、浓度均为2.5 mmol/L 的脱氧核糖核苷三磷酸混合物4 μl、PCR 缓冲液4 μl、逆转录酶1 μl、RNA 抑 制 剂0.5 μl,加入无RNA 酶水至20 μl 进行逆转录反应,逆转录成cDNA,反应条件:25℃温育5 min,50℃温育15 min,85℃加热5 min,4℃冷却10 min。取上述cDNA 4 μl,加入上下游引物各0.4 μl、SYBR Green(荧光插入染料)/荧光素qPCR 预混液10 μl、水5.2 μl,进行qRT-PCR,检测各目的基因相对表达量。反应条件:50℃预变性2 min,95℃变性10 min,95℃退火30 s,60℃延伸30 s,共40 个循环。绘制熔解曲线,最终数据以2-△△Ct法分析。

表1 引物序列
1.5 观察指标
统计雌鼠一般情况,比较各组子代小鼠各阶段阴道涂片在性周期中占比,比较FBG、FINS、ISI、HOMA-IR、TG 水平,比较IPGTT、IRT 试验结果,比较卵巢形态与脏器指数,比较动情间期生殖内分泌,分析发生PCOS 的影响因素。
1.6 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,进一步的两两比较用LSD-t检验;计数资料以率(%)表示,比较用χ2检验;影响因素的分析采用多因素Logistic回归模型。P<0.05 为差异有统计学意义。
2 结果
2.1 雌鼠一般情况
4 周龄SD 雌鼠54 只及雄鼠18 只,适应性喂养1 周后,45 只雌鼠成功妊娠。HFI 组共产雌仔42 只,HFII 组共产雌仔48 只,NC 组共产雌仔50 只,最终各组均随机纳入15 只雌仔作为实验对象。各组小鼠实验过程中均发育良好,体毛润泽,行为无明显差异,反应灵活。
2.2 各组雌仔阴道涂片在性周期中占比比较
各组雌仔动情前期、动情期、动情间期占比比较,差异均有统计学意义(P<0.05),HFI 组、HFII 组动情期较NC 组长(P<0.05),HFII 组较HFI组长(P<0.05)。见表2。
表2 各组子代小鼠阴道涂片在性周期中占比比较 (n=15,±s)
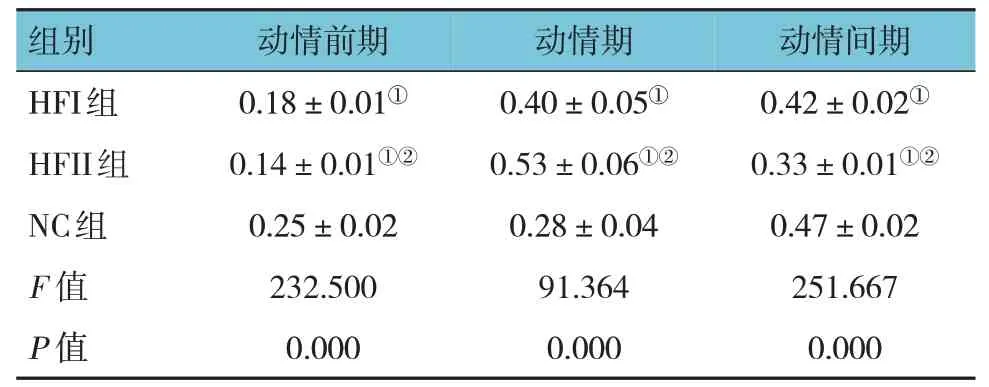
表2 各组子代小鼠阴道涂片在性周期中占比比较 (n=15,±s)
注:①与NC组比较,P <0.05;②与HFI组比较,P <0.05。
组别动情间期动情前期动情期HFI组HFII组NC组F 值0.42±0.02 0.33±0.01①0.47±0.0 251.667 0.18±0.01①0.14±0.01①②0.25±0.02 232.500 0.40±0.05①0.53±0.06①②0.28±0.04 91.364 P 值①②2 0.000 0.000 0.000
2.3 各组雌仔FBG、FINS、ISI、HOMA-IR及TG比较
各组雌仔FBG、FINS、ISI、HOMA-IR 及TG 比较,差异有统计学意义(P<0.05),HFI 组、HFII 组FBG、FINS、HOMA-IR、TG 水平较NC 组高,ISI 较NC 组低(P<0.05);HFII 组FBG、FINS、HOMAIR、TG 水平较HFI 组高,ISI 较HFI 组低(P<0.05)。见表3。
表3 各组雌仔FBG、FINS、ISI、HOMA-IR及TG比较 (n=15,±s)
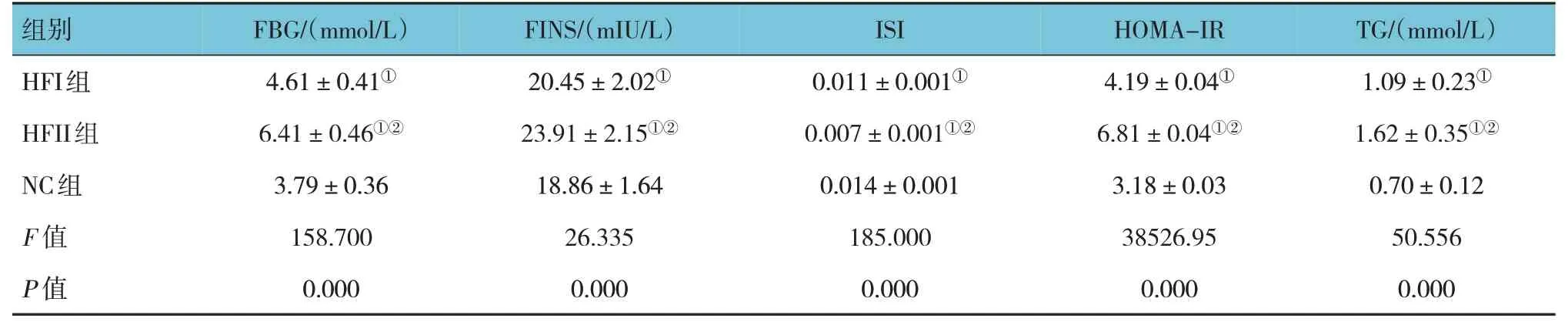
表3 各组雌仔FBG、FINS、ISI、HOMA-IR及TG比较 (n=15,±s)
注:①与NC组比较,P <0.05;②与HFI组比较,P <0.05。
TG/(mmol/L)组别FBG/(mmol/L)FINS/(mIU/L)ISI HOMA-IR 1.09±0.23①1.62±0.35①②0.70±0.12 50.556 0.000 HFI组HFII组NC组F 值P 值4.61±0.41①6.41±0.46①②3.79±0.36 158.700 0.000 20.45±2.02①23.91±2.15①②18.86±1.64 26.335 0.000 0.011±0.001①0.007±0.001①②0.014±0.001 185.000 0.000 4.19±0.04①6.81±0.04①②3.18±0.03 38526.95 0.000
2.4 各组雌仔IPGTT 不同时间点血糖、胰岛素比较
各组雌仔IPGTT 15 min、 30 min、 60 min 和120 min 的血糖、胰岛素比较,经重复测量设计的方差分析,结果:①不同时间点间血糖、胰岛素有差异(F=67.661 和10.505,均P=0.000);②各组血糖、胰岛素有差异(F=84.139 和16.942,均P=0.000)。③各组血糖、胰岛素变化趋势有差异(F=51.333 和15.264,均P=0.000)。见表4、5 和图1、2。
表4 各组雌仔不同时间点血糖比较 (n=15,mmol/L,±s)

表4 各组雌仔不同时间点血糖比较 (n=15,mmol/L,±s)
组别15 min 30 min 60 min 120 min HFI组HFII组NC组11.96±1.23 14.94±1.42 9.89±0.87 9.46±0.86 12.01±1.28 7.41±0.68 7.85±0.74 10.01±1.30 4.88±0.90 5.31±0.70 7.51±1.05 4.38±0.82
表5 各组雌仔不同时间点胰岛素比较 (n=15,mIU/L,±s)
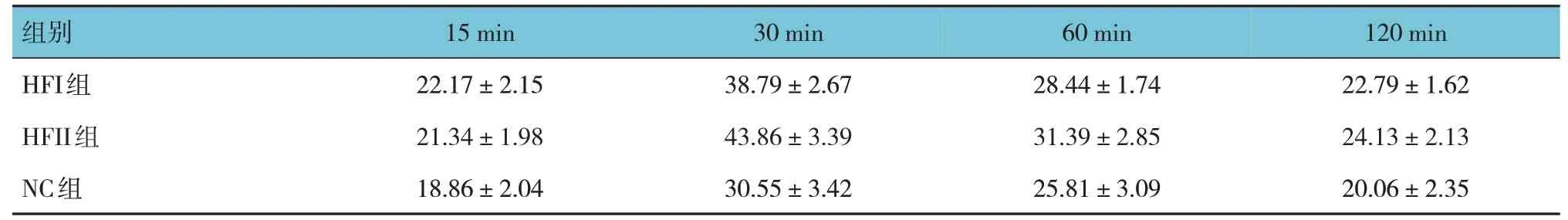
表5 各组雌仔不同时间点胰岛素比较 (n=15,mIU/L,±s)
组别15 min 30 min 60 min 120 min HFI组HFII组NC组22.17±2.15 21.34±1.98 18.86±2.04 38.79±2.67 43.86±3.39 30.55±3.42 28.44±1.74 31.39±2.85 25.81±3.09 22.79±1.62 24.13±2.13 20.06±2.35
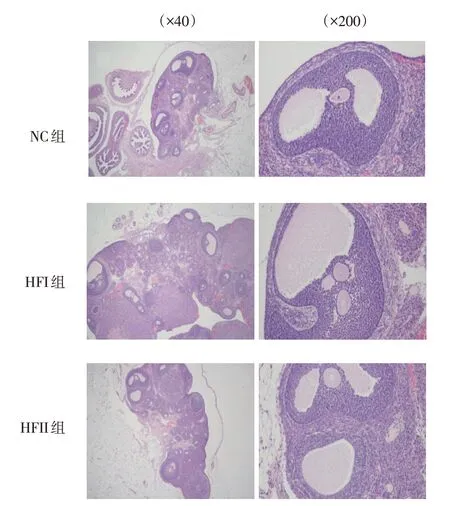
2.5 各组雌仔卵巢形态
NC 组卵巢组织形态、卵泡正常;HFI 组、HFII 组均可见卵巢组织形态学出现异常变化,白膜增厚,黄体减少,多个不同发育阶段的卵泡及囊性卵泡。NC 组雌仔卵巢脏器系数为(1.58±0.13)×10-3,HFI 组为(2.40±0.14)×10-3,HFII组为(3.34±0.16)×10-3,经方差分析,差异有统计学意义(F=562.029,P=0.000),HFI 组、HFII 组较NC 组大, 且HFII 较HFI组大(P<0.05)。见图3。
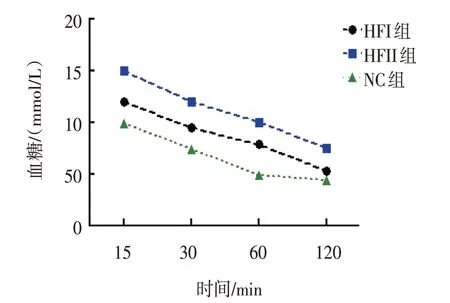
图1 各组雌仔不同时间点血糖变化趋势
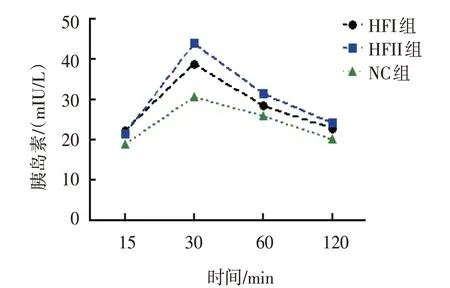
图2 各组雌仔不同时间点胰岛素变化趋势
2.6 各组雌仔动情间期生殖内分泌水平比较
各组雌仔血清E2、LH 及T 比较,差异有统计学意义(P<0.05),HFI 组、HFII 组血清E2、LH 较NC 组低,血清T 较NC 组高(P<0.05),HFII 组血清E2、LH 较HFI 组低,血清T 较HFI 组高(P<0.05)。各组雌仔血清P 比较,差异无统计学意义(P>0.05)。见表6。
2.7 各组雌仔脂肪组织雄激素转化酶水平比较
各组雌仔3β-HSD1、3β-HSD2、3β-HSD5、17β-HSD1 及5ɑ-R1 mRNA 相对表达量比较,经方差分析,差异有统计学意义(P<0.05),HFI 组、HFII 组较NC 组高(P<0.05),HFII 组较HFI 组高(P<0.05)。见表7。
2.8 PCOS影响因素的多因素Logistic分析结果
以是否发生PCOS 作为因变量,以FBG、FINS、ISI、HOMA-IR、TG、E2、LH、T 作为自变量,进行多因素一般Logistic 回归分析。结果显示:E2 水平是PCOS 的保护因素(P<0.05),FBG、TG 及T 水平是PCOS的危险因素(P<0.05)。见表8。
表6 各组雌仔动情间期生殖内分泌水平比较 (n=15,±s)
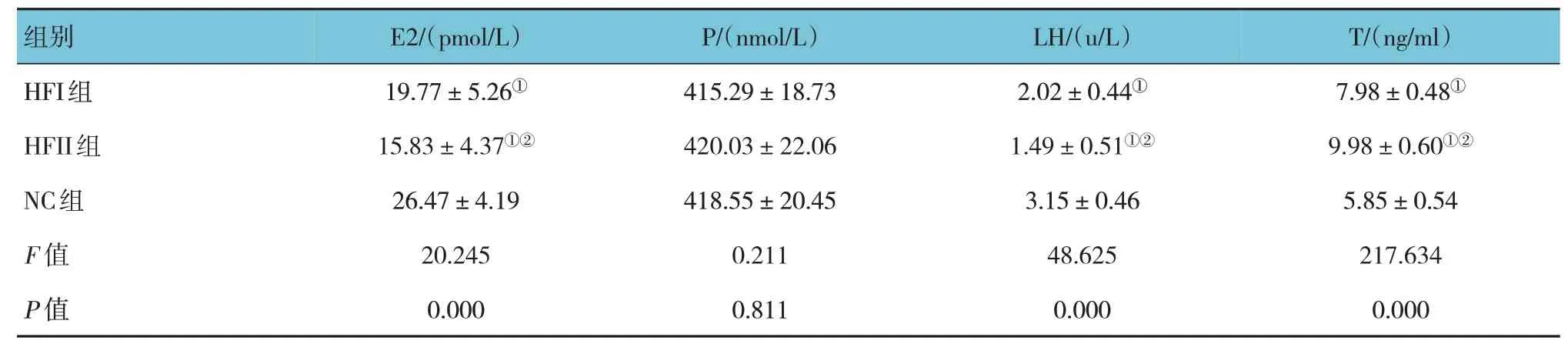
表6 各组雌仔动情间期生殖内分泌水平比较 (n=15,±s)
注:①与NC组比较,P <0.05;②与HFI组比较,P <0.05。
组别T/(ng/ml)E2/(pmol/L)P/(nmol/L)LH/(u/L)HFI组HFII组NC组F 值P 值7.98±0.48①9.98±0.60①②5.85±0.54 217.634 0.000 19.77±5.26①15.83±4.37①②26.47±4.19 20.245 0.000 415.29±18.73 420.03±22.06 418.55±20.45 0.211 0.811 2.02±0.44①1.49±0.51①②3.15±0.46 48.625 0.000
表7 各组雌仔脂肪组织雄激素转化酶水平比较 (n=15,±s)
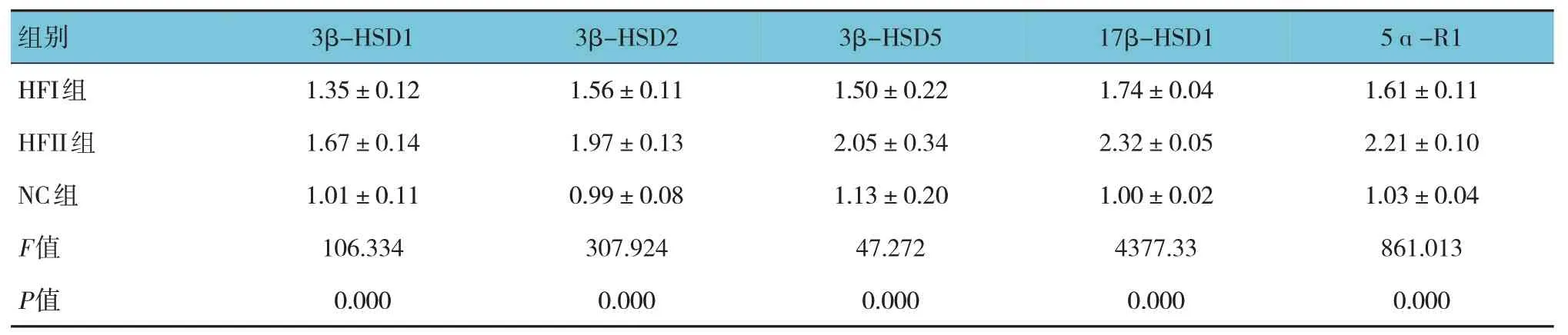
表7 各组雌仔脂肪组织雄激素转化酶水平比较 (n=15,±s)
组别3β-HSD1 3β-HSD2 3β-HSD5 17β-HSD1 5ɑ-R1 HFI组HFII组NC组F值P值1.35±0.12 1.67±0.14 1.01±0.11 106.334 0.000 1.56±0.11 1.97±0.13 0.99±0.08 307.924 0.000 1.50±0.22 2.05±0.34 1.13±0.20 47.272 0.000 1.74±0.04 2.32±0.05 1.00±0.02 4377.33 0.000 1.61±0.11 2.21±0.10 1.03±0.04 861.013 0.000
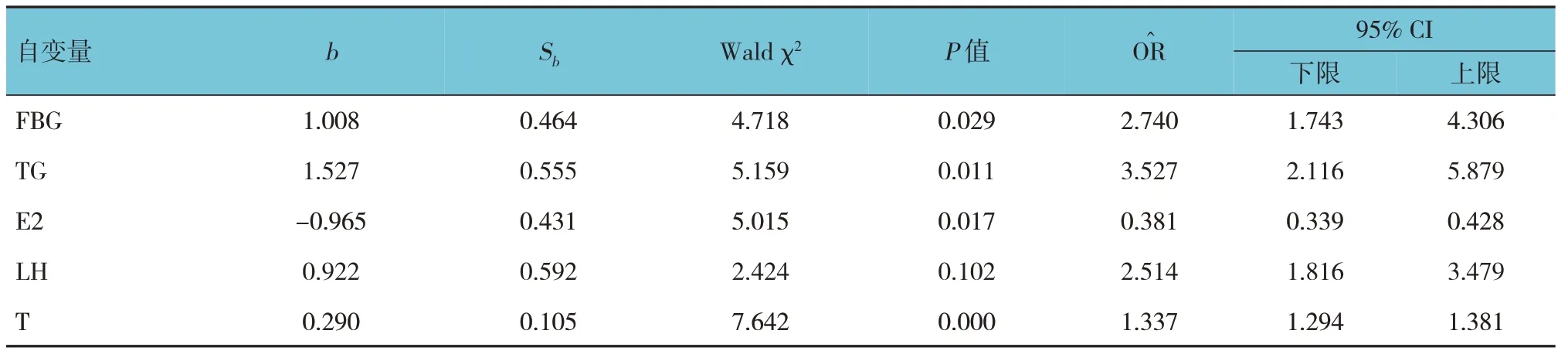
表8 PCOS影响因素的多因素Logistic分析参数
3 讨论
PCOS 不仅可造成不孕,亦会增加糖尿病、妊娠期糖尿病、心血管疾病、子宫内膜癌等发病风险,因此研究其发病机制,对尽早发现、干预,并改善子代的代谢状态,保障子代的生殖健康意义重大[5-6]。而复制符合本研究需要的动物模型是决定本研究能否成功的关键问题之一。前期的实验发现,高脂肪饮食中的脂肪含量高,小鼠的摄食量不高,且胎仔的死产率高,不能有效地复制模型,因而在本次实验中,改进了饮食结构,提供脂肪配方比例为60%的高脂饲料,既能保证高脂肪成分含量,又改善摄入饲料的口感,并联合具有国际AAALAC 认证动物实验中心的新疆医科大学,解决了模型复制的困难,为实验顺利实施提供了坚实的基础。
以往有研究指出,高脂饮食引起的PCOS 大鼠,血清FBG、FINS、HOMA-IR 高于正常大鼠[7]。XUE 等[8]对PCOS 大鼠应用降糖药物二甲双胍,发现大鼠多囊、高胰岛素血症的症状得到改善,从侧面反映FBG 与PCOS 发病有关。VONICA 等[9]纳入了15 例患有PCOS 的白人妇女和15 例年龄匹配的白人健康妇女,使用超高效液相色谱-四极杆飞行时间电喷雾质谱法进行脂质组学分析,发现高TG 是区分PCOS、健康女性的有效指标,提示TG 亦与PCOS 有关。但母亲摄食高脂饮食对子代糖、脂代谢及PCOS 发生的影响尚不明确。本研究发现NC组、HFI 组、HFII 组FBG、FINS、HOMA-IR、TG依次增高,ISI 依次降低,且与NC 组相比,IPGTT及IRT 试验后,HFI 组、HFII 组15 min、30 min 后血糖、胰岛素较高,且血糖、胰岛素高峰值增大,下降缓慢,曲线下面积较大,表明母亲高脂饮食可影响雌性子代糖和脂代谢、胰岛β 细胞的功能。ZHANG 等[10]研究发现,妊娠期糖尿病大鼠的子代ISI 降低,HOMA-IR 增加。有观点认为,造成这一结果的原因是高脂饮食导致宫内高糖环境损伤子代胰岛细胞,加之子代出生后自身的葡萄糖水平对胰岛细胞刺激不够,致胰岛细胞生长发育受限,从而影响糖、脂代谢[11-13]。亦有报道指出,宫内高糖可影响后代基因甲基化、组蛋白翻译和修饰,而基因甲基化、组蛋白翻译和修饰是最基础的基因表观遗传学修饰途径,可保持染色体稳定性,表观遗传修饰引起的“代谢性记忆”即使在后续血糖控制达标后,仍持续启动,并介导核内基因表达谱异常,从而从基因水平影响糖、脂代谢[14-16]。
同时本研究还发现,HFI 组、HFII 组动情期较NC 组长,动情前期、动情间期较NC 组短,卵巢脏器系数、血清T 值较NC 组大,血清E2、LH 水平较NC 组低,提示糖、脂代谢异常可影响卵巢功能,这可能是其介导PCOS 发生的根本所在。ZHANG等[17]采用脱氢表雄酮注射方法复制PCOS 模型,发现加用45%和60%的高脂饮食均可导致雄激素过多、性周期不规则、多囊卵巢,表明高脂饮食可影响卵巢功能。PATEL 等[18]研究采用高脂饲料喂食青春期前雌性大鼠,发现大鼠糖耐量和FINS 升高,HE 染色可见囊性卵泡增多、颗粒细胞层减少、卵泡膜细胞层增厚等组织病理学改变,说明青春期前开始的高脂肪饮食会引起代谢紊乱和卵巢改变,与临床观察到的PCOS 患者相似,从侧面支持本研究结论。卵巢功能异常可通过LH 等生殖内分泌激素影响下丘脑-垂体-卵巢轴的正常功能,加重糖、脂代谢异常,糖、脂代谢异常又可影响卵巢功能,从而形成恶性循环,增加PCOS 发病风险[19]。
PCOS 患者典型症状之一是高雄激素血症,而机体雄激素表达受雄激素转化酶的影响,但现阶段关于PCOS 中雄激素转化酶表达的研究较少。3β-HSD1、3β-HSD2、3β-HSD5、17β-HSD1 及5ɑ-R1 均为雄激素转化酶,其中3β-HSD1、3β-HSD2、3β-HSD5 主要作用是催化脱氢表雄酮向雄烯二酮转化,17β-HSD1 可催化雄烯二酮向睾酮转化,5ɑ-R1 可催化睾酮向双氢睾酮转化[20]。张哲等[21]研究显示,17β-HSD1 与E2、LH 的合成具有相关性。本研究发现,NC 组、HFI 组和HFII 组3β-HSD1、3β-HSD2、3β-HSD5、17β-HSD1 及5ɑ-R1 mRNA 相对表达量依次升高,提示异常糖、脂代谢可影响雄激素转化酶的表达,这可能是其诱导PCOS 发生的一个机制。同时本研究还发现,E2 是PCOS 的相关保护因素,FBG、TG、T 是PCOS的相关危险因素,提示以上因素与PCOS 的发生有关。詹艳萍等[22]报道显示,雌鼠妊娠期肥胖是子代成年期发生PCOS 的一个高风险因素,而肥胖可导致糖、脂代谢异常,论证了本研究结论。以往关于母代高脂肪暴露对子代糖、脂代谢、卵巢功能、PCOS 发病率的研究较少,且目前国内PCOS 的研究主要基于不孕门诊就诊的育龄期女性,对青春期患者关注不足。本研究除观察宫内高脂肪饮食暴露外,还探讨了哺乳期高脂肪饮食暴露对幼鼠的影响,可为幼年期干预、预防PCOS 提供循证支持,以便尽早发现、干预,可能会改善子代的代谢状态,保护卵巢功能,保障子代的生殖健康。同时既往采用高脂肪饮食暴露复制动物模型时,脂肪含量高,小鼠的摄食量不高,模型复制成功率低,增加了实验成本,本研究提供脂肪配方比例为60%的高脂饲料,有效解决了造模困难的问题,可为成功复制动物实验提供参考。此外,本研究证实,糖、脂代谢异常可影响雄激素转化酶的表达,佐证了这一结论的可靠性,为PCOS 靶向干预提供了有力的证据。
综上所述,高脂肪饮食暴露可引起子代糖、脂代谢异常,并导致子代卵巢形态、功能发生改变,是子代发生PCOS 的相关危险因素,其机制可能与调控雄激素转化酶的表达有关。
