糖尿病患者血清microRNA-152表达水平与血脂代谢、胰岛素抵抗的相关性*
2021-05-10朱宗国杨洪余黄澜谭旭斌卞西杰钟铠璟
朱宗国,杨洪余,黄澜,谭旭斌,卞西杰,钟铠璟
(攀枝花市中西医结合医院 检验科,四川 攀枝花617023)
糖尿病是一种以慢性高血糖为主要特征的代谢性疾病,糖尿病患者长期处于高血糖状态,会出现血管受损,进而引发肾脏、心脏、心血管等器官功能退化[1]。随着人们生活水平的提高,饮食搭配不合理,全球糖尿病发病率不断上升,预计2030年患病人数达到5.78 亿[2]。临床上以2 型糖尿病(type-2 diabetic mellitus,T2DM)最常见,占糖尿病患者的85%以上[3]。有研究发现,T2DM 发病因素与机体胰岛素分泌障碍有关,因为肝脏脂质储存异常会导致血糖水平持续升高,引起胰岛细胞功能衰退,最终导致T2DM[4]。也有研究发现,合并高血糖和高血脂的T2DM 患者容易发生动脉粥样硬化或动脉血管破裂[5]。LI 等[6]发现妊娠糖尿病小鼠microRNA-152(miR-152)表达水平较高,猜想miR-152 在T2DM 的发生中可能发挥着潜在作用。重症T2DM 患者容易发生并发症,心脑血管疾病是T2DM 患者最早期的主要并发症,其临床特征是血脂异常[7]。本研究拟探讨miR-152 表达水平及T2DM 患者血脂、血糖代谢情况,并分析miR-152 与T2DM 患者血脂水平的关系,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年1月—2018年11月在攀枝花市中西医结合医院就诊的血糖异常患者109例,根据2019年美国糖尿病学会(ADA)发布的《糖尿病诊疗指南》[8-9]分为T2DM 前期组(Pre-T2DM 组)45 例和T2DM 组64 例。Pre-T2DM组男性24例,女性21例;年龄42~60 岁,平均(54.80±9.45)岁。T2DM 组男性35 例,女性29例;年龄45岁~64岁,平均(54.10±9.80)岁。另取同期本院门诊部健康体检者70 例为对照组。对照组男性37 例,女性33 例;年龄45~66 岁,平均(54.80±9.30)岁。两组性别构成、年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究获得医院伦理委员会批准,符合《世界医学协会赫尔辛基宣言》。
1.2 纳入与排除标准
1.2.1 纳入标准①符合2019年ADA 发布的《糖尿病诊疗指南》[8-9],签署临床研究协议书。②糖尿病前期患者符合空腹血糖(fasting blood glucose,FBG)6.1~7.0 mmol/L;饭后2 h 血糖≥7.8 mmol/L[10]。
1.2.2 排除标准①服用糖皮质激素类药物者;②心脑血管疾病患者;③严重肝、肾功能障碍患者;④自身免疫疾病患者。
1.3 主要试剂与仪器
胰岛素定量测定试剂盒购自北京源德生物医学工程有限公司,高密度脂蛋白胆固醇(highdensity lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDLC)、总胆固醇(total cholesterol, TC)、甘油三酯(Triglyceride, TG)酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)试剂盒购自北京九强生物科技有限公司,RNA 提取试剂盒、cDNA 逆转录试剂盒、SYBR Premix Ex TapTM购自日本TaKaRa 公司,e401 电化学发光仪、ACCU-CHEK 血糖仪购自德国罗氏公司,S1000 梯度PCR 仪、CFX96 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)仪购自德国Bio-Rad 公司。
1.4 标本采集和处理
清晨取所有受试者空腹时静脉血5 ml于试管中,静置10 min,4℃、12 000 r/min 离心8 min。收集上清液,保存于-80℃超低温冰箱,用于后续实验。
1.5 指标检测
所有受试者禁食12 h 后检测生物指标。采用e401 电化学发光仪检测血清空腹胰岛素(fasting insulin, FINS)水平,酶联免疫吸附试验检测TC、TG、HDL-C 和LDL-C 水平,血糖仪检测FBG 水平。采用稳态模型评估稳态胰岛素评价指数(homeostasis modeall assessment of insulin resistance, HOMA-IR)与胰岛β细胞功能指数(homeostasis modeall assessment-β, HOMA-β)。计算公式HOMA-β =20×FINS/(FBG-3.5),HOMA-IR=(FBG×FINS)/22.5。
1.6 qRT-PCR检测血清miR-152
在无菌超净工作台上按照RNA 提取试剂盒操作步骤提取血清总RNA,并参照逆转录试剂盒说明书在梯度PCR 仪器上逆转录RNA,合成cDNA。采用qRT-PCR 检测受试者血清miR-152 相对表达量。qRT-PCR 反应体系25.0 μl:2×SYBR®Premix Ex TapTM12.5 μl,cDNA 底物(50 ng/μl)2.0 μl,正反向引物(10 μmol/L)各1.0 μl,ddH2O 8.5 μl。反应条件:95℃预变性95 s,95℃变性30 s,64℃退火25 s,72℃延伸20 s,共循环39 次。miR-152 及内参U6 的引物序列见表1。

表1 miR-152及内参U6的引物序列
1.7 统计学方法
数据分析采用SPSS 19.0 统计软件。计数资料以构成比表示,比较用χ2检验;计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用SNK- q法;相关性分析用Pearson 法,影响因素的分析采用多因素一般Logistic 回归模型。P<0.05为差异有统计学意义。
2 结果
2.1 3组临床资料比较
对照组、Pre-T2DM 组、T2DM 组的性别构成、年龄比较,经χ2检验或单因素方差分析,差异无统计学意义(P<0.05)。对照组、Pre-T2DM 组、T2DM 组FBG、FINS、TG、TC、HDL-C、LDL-C、HOMA- β、HOMA-IR 比较,经单因素方差分析,差异有统计学意义(P<0.05)。与对照组比较,Pre-T2DM组和T2DM组患者血清FBG、FINS、TG、TC、LDL-C、HOMA-IR 较高(P<0.05),HDL-C、HOMA-β 较低(P<0.05);与Pre-T2DM 组 比较,T2DM 组患者 血清FBG、FINS、TG、TC、LDL-C、HOMA-IR 较高(P<0.05),HDL-C、HOMA-β 较低(P<0.05)。见表2。
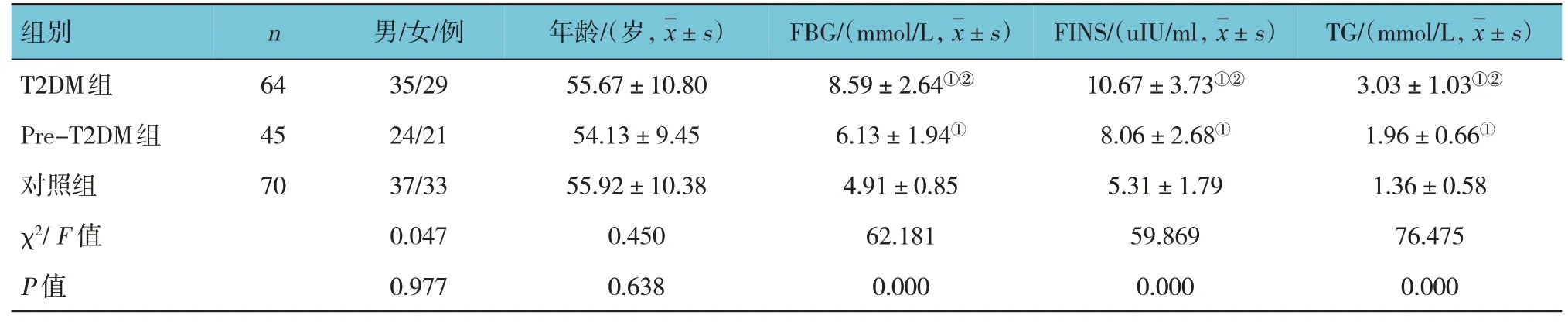
表2 3组临床资料比较
2.2 3组血清miR-152相对表达量比较
对照组、Pre-T2DM 组、T2DM 组血清miR-152 相对表达量分别为(0.92±0.16)、(1.18±0.34)和(1.57±0.43),经方差分析,差异有统计学意义(F=67.593,P=0.000)。与对照组相比,Pre-T2DM 组和T2DM 组患者血清miR-152 相对表达量较高(P<0.05);与Pre-T2DM 组比较,T2DM 组患者血清miR-152 相对表达量较高(P<0.05)。
2.3 T2DM患者血清miR-152与血脂水平相关
T2DM 患者血清miR-152 与TG、TC 和LDL-C 水平呈正相关(r=0.844、0.755 和0.833,均P=0.000),与HDL-C 呈负相关(r=-0.655,P=0.000)。见图1。
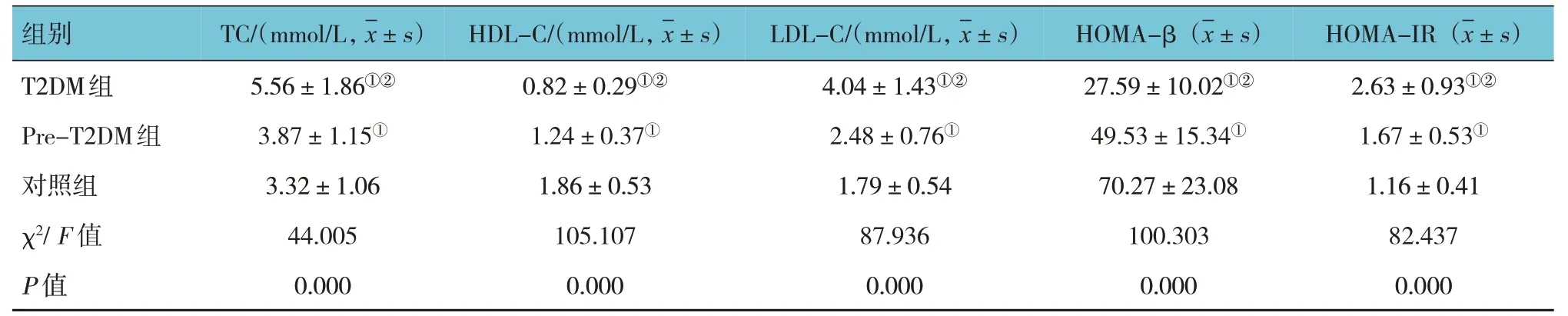
续表2
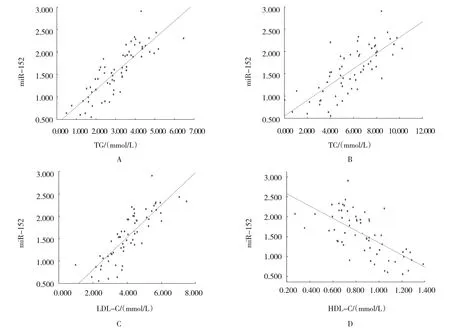
图1 T2DM患者血清miR-152与血脂水平的相关性
2.4 T2DM患者血清miR-152与FINS、HOMA-β、HOMA-IR、FBG的相关性
T2DM 患者血清miR-152 与FBG、FINS、HOMAIR 呈正相关(P<0.05),与HOMA-β 呈负相关(P<0.05)。见表3。
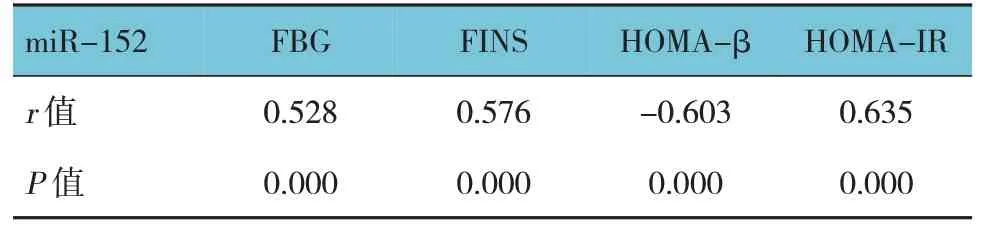
表3 T2DM患者血清miR-152与FINS、HOMA-β、HOMA-IR、FBG的相关性
2.5 影响糖尿病患者胰岛素抵抗的多因素一般Logistic回归分析结果
将是否发生胰岛素抵抗为因变量,以表1中差异有统计学意义的指标(FBG、FINS、TG、TC、LDL-C、HDL-C、HOMA-β、HOMA-IR、miR-152)为自变量,进行多因素一般Logistic 回归分析,结果显示FBG[=2.305(95% CI:1.369,3.882)]和miR-152 [=2.831(95% CI:1.736,4.618)]升高是影响胰岛素抵抗的危险因素。见表4。
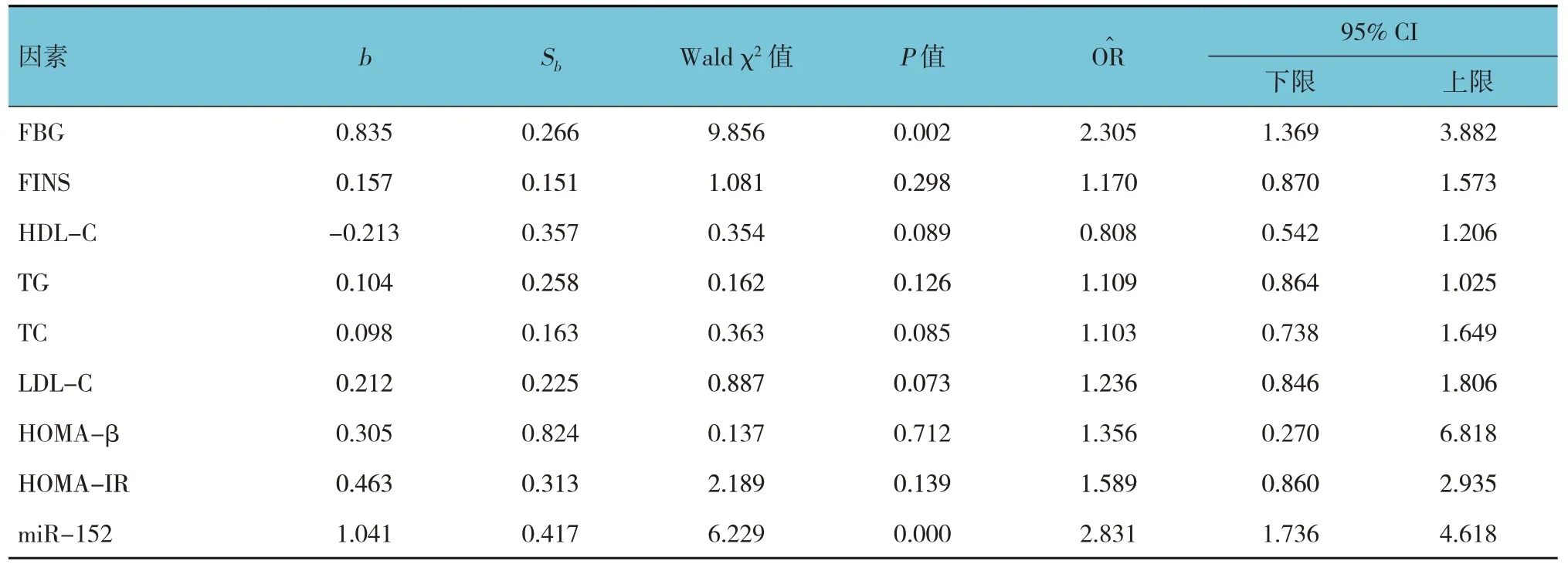
表4 影响糖尿病患者胰岛素抵抗的多因素一般Logistic回归分析参数
3 讨论
目前糖尿病发病机制尚不清楚,也是造成糖尿病难以治愈的原因之一。胰岛素抵抗是糖尿病患者发病的基础。T2DM 与血脂异常、胰岛功能关系密切。丁玉兰等[11]发现与健康人群比较,T2DM患者血清FBG、FINS、TG、TC、LDL-C、HOMA-IR 较高,血清HDL-C 较低,表明血脂代谢异常可能与T2DM 病情相关,且HOMA-IR 较高可能说明机体细胞葡萄糖利用率较低。孙宇焱等[12]发现T2DM 患者血清TG、TC、LDL-C 水平显著高于健康对照组,HDL-C 水平显著低于健康对照组。也有数据证实,HOMA-IR 较高患者,糖尿病发病风险增加[13]。本研究结果表明,与对照组比较,Pre-T2DM 组和T2DM组患者血清FINS、TG、TC、LDL-C、HOMA-IR 较高,血清HDL-C、HOMA-β 较低,提示血脂水平和HOMA-IR、HOMA-β 异常,可能与T2DM 发生有关。与Pre-T2DM 组比较,T2DM 组患者血清FINS、TG、TC、LDL-C、HOMA-IR 较高,HDL-C、HOMA-β 较低,提示T2DM 病情严重程度可能与血脂水平、HOMAIR、HOMA-β 密切相关。
有研究表明,miRNAs 参与糖尿病、高血压和心血管疾病的发生和发展[14]。胰岛激素分泌是维持血糖稳态的核心。有研究发现,处于压力下的胰岛β 细胞将释放更多的胰岛素,以补偿胰岛素抵抗的增加;胰岛β 细胞无法分泌足够的胰岛素会导致T2DM,miRNAs 参与调控胰岛β 细胞,与胰岛β 细胞功能障碍关系密切[15]。ESGUERRA 等[15]发现,高血糖Goto-Kakizaki 大鼠胰岛细胞中miR-152 表达水平较高,miR-152 通过靶向调节编码线粒体多酶复合丙酮酸脱氢酶的Gck基因和Pdha1基因,调节葡萄糖,从而降低葡萄糖对胰岛素分泌的刺激。FU等[16]发现,miR-152 过表达可通过靶向LIN-28 同系物B,调节人视网膜内皮细胞中的血管生成,有助于糖尿病性视网膜病的治疗。ROUX 等[17]发现,T2DM 患者血浆miR-152 表达水平显著低于T2DM 合并糖尿病肾病患者。本研究结果表明,与对照组比较,Pre-T2DM 组和T2DM 组患者血清miR-152 相对表达量较高,提示miR-152 表达异常可能与T2DM 发生相关。T2DM 组患者血清miR-152 相对表达量高于Pre-T2DM 组,提示miR-152 可能与T2DM病情进展有关。进一步研究发现,miR-152 与TG、TC 和LDL-C 呈正相关,与HDL-C 呈负相关,提示miR-152 可能通过调节血脂代谢,影响T2DM 病情发展。血脂存在于血浆中,如果血管血脂含量过高,脂质代谢紊乱,血液黏稠度升高,影响T2DM病情,miR-152 可通过调节WNT 信号通路影响脂质合成代谢[18]。miR-152 与FINS、FBG、HOMA-IR 呈正相关,与HOMA-β 呈负相关,提示miR-152 可能通过影响胰岛素分泌影响T2DM 病情发展。多因素一般Logistic 回归分析结果显示,血清FBG、miR-152 升高是影响胰岛素抵抗的危险因素,提示miR-152 升高可能与糖尿病胰岛素抵抗病程进展有关。
综上所述,T2DM 患者血清miR-152 水平上调,可能通过调节血脂代谢影响T2DM病情发展。本研究将进一步扩大样本量和区域,继续探索miR-152 对T2DM患者血脂代谢的影响。
