羊乳巴氏杀菌条件的筛选
2021-05-10叶彤聂聪怡李林强
叶彤,聂聪怡,李林强
(陕西师范大学 食品工程与营养科学学院,陕西 西安,710119)
羊乳被称为“乳中之王”[1],优质蛋白含量丰富,含有颗粒较小的球蛋白,易被人体消化吸收,且羊乳酪蛋白和乳清蛋白的比例接近母乳,较其他乳源对人体健康更有利[2-4]。乳的热处理主要包括预热、杀菌甚至灭菌等过程。巴氏杀菌是最常见的热处理方式,其主要目的是杀灭乳品中大多数微生物,保证乳品的品质和延长乳品的货架期[5-6],改善乳品加工性能[7]。低温巴氏杀菌对乳中热不稳定性蛋白的影响较小[8],而高温巴氏杀菌则会导致乳品蛋白的乳化能力和稳定性发生较大的变化[9-10]。因此,低温的巴氏杀菌是更受人们青睐的热加工方式。
蛋白质的水解是羊乳杀菌过程中发生的主要化学变化之一。在加工生产方面,水解后的乳蛋白往往更有利于发酵乳制品的生产[11];在健康方面,蛋白质水解后产生的小分子肽及氨基酸更容易被人体吸收,且部分小肽还具有调节血糖[12]、抗氧化[13]、抗高血压[14]、抑菌[15]等功能;在安全方面,巴氏杀菌后的乳蛋白相比未处理而言更加安全,如经过65~100 ℃加热处理后,α-乳白蛋白的抗原性和潜在致敏性显著降低[16]。目前,对于乳蛋白的水解有相当多的研究,但多集中于酶对蛋白质的水解。马莹等[17]报道胃蛋白酶水解乳清蛋白最佳酶解工艺温度为37 ℃,胰蛋白酶水解乳清蛋白最佳酶解温度为55 ℃,韩仁娇等[18]报道在55.2 ℃条件下,β-乳球蛋白酶解产生乳清水解蛋白,其水解率可达60%。但是酶处理易导致蛋白质过度水解,产生大量苦肽和游离氨基酸,影响羊乳的风味。巴氏杀菌是一种常见的杀菌方式,并且广泛应用于工业生产实践,但是当下不同企业采用不同的巴氏杀菌条件,主要体现在巴氏杀菌时间和杀菌温度的不同,虽然这些条件满足了商业杀菌的要求,但是哪一种巴氏杀菌的条件更有利于保护乳蛋白的特性,尚缺乏系统的研究。
本文较系统地研究巴氏杀菌对羊乳水解程度、色值变化、表面形貌、蛋白种类的影响,以加深人们关于巴氏杀菌对羊乳蛋白质性状影响的认识,有利于深入研究羊乳品质的稳定性。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
鲜羊乳采自陕西省西安市长安区关中奶山羊养殖场,冰盒2~4 ℃运回实验室。
1.1.2 主要试剂
牛血清白蛋白,上海蓝季科技发展有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、丙烯酰胺、考马斯亮蓝R-250、考马斯亮蓝G-250,N,N-亚甲基双丙烯酰胺、三羟甲基氨基甲烷(Tris)、N,N,N,N-四甲基乙二胺,Sigma公司;盐酸、过硫酸铵、溴酚蓝、甘氨酸,上海源叶生物试剂有限公司;甘油、冰醋酸、95%(体积分数)乙醇、氯化钠、磷酸、乙醚(均为国产分析纯),天剑天利化学试剂有限公司。
1.1.3 仪器与设备
800B台式离心机,上海安亭科学仪器厂;722型可见分光光度计,上海光谱仪器有限公司;J探头原子力显微镜,Veeco Bruker公司;SC-80C全自动色差仪,北京康光光学仪器有限公司;PowerPac TM Universal电泳系统、Universal Hood II,XRS凝胶成像系统,美国Bio-rad公司。
理论、计算与实际应用在现行数学标准与教材中的割裂状态应当改变,两者必须结合起来.小学数学中的理论和计算技能,如果学生不懂得如何应用于实际问题,则无价值可言.
1.2 实验方法
1.2.1 羊乳中蛋白质含量的测定
乳中蛋白质含量的测定参考文献[19]的方法。称量0.1 g牛血清白蛋白至100 mL容量瓶中,倒入0.15 mol/L的NaCl溶液至刻度线,混匀配制成1.0 mg/mL 的标准蛋白溶液。依次吸取标准蛋白溶液(0.01、0.02、0.03、0.04、0.05、0.06 mL)和0.15 mol/L的NaCl溶液(0.09、0.08、0.07、0.05、0.04 mL)于相应试管中,再分别加入考马斯亮蓝G-250试剂各5.00 mL。采用722型可见分光光度计在595 nm处测定其吸光度。以牛血清白蛋白标准溶液质量浓度(0,0.1,0.2,0.3,0.4,0.5,0.6 mg/mL)为横坐标,以吸光度值为纵坐标,绘制蛋白质含量测定的标准曲线。准确移取1 μL羊乳于试管中,再加入99 μL NaCl溶液,其余操作同上。
1.2.2 不同巴氏杀菌羊乳色值的测定
采用全自动色差仪测定不同巴氏杀菌条件下羊乳的红值(a*)、黄值(b*)和亮度(L*),以常温鲜羊乳为对照。
1.2.3 羊乳蛋白粒子形貌原子力显微镜观察
取等量常温和95 ℃,15 s处理的羊乳,经400×g离心15 min后,弃去脂肪层,再使用乙醚萃取,脱去剩余残脂。对少量脱脂后的羊乳稀释25倍后,进行超声处理。取样液铺展在云母片上,静置风干。制备好的蛋白云母片样本在Bruker原子力显微镜J探头下进行扫描观察。
1.2.4 巴氏杀菌羊乳蛋白质十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析
参考文献[20]稍作修改。取2 mg不同温度处理的羊乳和对照乳,分别溶解在1 mL样品缓冲液中。配制浓缩胶的体积分数为5%,配制分离胶的体积分数为13%。将分离胶注入凝胶板至距上部1/4处,再灌入蒸馏水压平,待凝固后倒掉蒸馏水。然后注入浓缩胶,插入梳子后等待凝固。倒入电泳缓冲液至没过凝胶板,拔梳子。样品上样量为10 μL。将浓缩胶中的电压控制为80 V恒定,待溴酚蓝条带跑入分离胶后,电压改为121 V,恒压直到蛋白质染液跑至距分离胶底部1 cm左右处,关闭电源停止电泳。将凝胶片放入考马氏亮蓝染液染色,置于摇床振荡2 h。再放入脱色液脱色,每2 h换1次,至背景通透、蛋白条带可清楚辨别。

2 结果与分析
2.1 考马斯亮蓝法蛋白质含量测定标准曲线方程的建立
以牛血清白蛋白标准溶液质量浓度(0、0.1、0.2、0.3、0.4、0.5、0.6 mg/mL)为横坐标,以吸光度值为纵坐标,绘制标准曲线。依据各个浓度对应的吸光值点进行线性回归,建立标准方程。结果显示回归方程为y=0.908 4x-0.017,其线性范围为0~0.6 mg/mL,该方程的R2=0.991 9,表明蛋白质标准曲线浓度与吸光度关系良好,该方程可信度高(P<0.01)。
2.2 不同巴氏杀菌羊乳中蛋白质含量
采用考马斯亮蓝法对65、75、85、95 ℃巴氏杀菌乳中的蛋白质含量进行测定。由图1可知,各巴氏杀菌处理组的羊乳总蛋白质含量均显著高于对照组(25 ℃未经处理的羊乳,下同)(P<0.05),考马斯亮蓝法的测定原理是蛋白质和色素的结合,但肽类物质也可以与色素结合,这可能是处理组蛋白质的含量高于对照组的原因,也进一步表明蛋白质在75 ℃以上温度时发生了水解;75 ℃巴氏杀菌乳中的蛋白质含量显著高于其他巴氏杀菌组(P<0.05);85和95 ℃巴氏杀菌乳中的蛋白质含量显著高于65 ℃巴氏杀菌组(P<0.05);85和95 ℃巴氏杀菌羊乳中的蛋白质含量无显著差异(P>0.05)。

图1 羊乳蛋白质含量在不同温度处理30 min后的变化Fig.1 The contents of protein from goat milk treated at different temperatures for 30 min
对95 ℃加热15 s、30 min和4 h的巴氏杀菌乳中的蛋白质含量测定结果如图2所示,各巴氏杀菌组的羊乳蛋白质含量均显著高于对照组(P<0.05)。15 s巴氏杀菌乳中的蛋白质含量显著高于其他巴氏杀菌组(P<0.05)。4 h巴氏杀菌乳中的蛋白质含量显著高于30 min巴氏杀菌组(P<0.05)。

图2 羊乳蛋白质含量在95 ℃不同时间处理后的变化Fig.2 The contents of protein from goat milk treated at 95 ℃ for different times
结果表明,随着在相同时间的处理条件下温度的升高,蛋白质含量先增大,后降低。这可能是因为随着温度升高,羊乳蛋白空间构象改变,二三级结构和疏水区域发生变化,蛋白质的酶切位点数量增加,因此巴氏杀菌后的乳蛋白对蛋白酶更加敏感,而羊乳中蛋白酶、纤溶酶等内源水解酶会降解乳中蛋白质,将其分解为小分子短肽和游离氨基酸[21-22]。相对于75 ℃条件的巴氏杀菌,85、95 ℃的巴氏杀菌温度较高,可能致使某些特殊蛋白质发生一定凝结,从而表现为蛋白质含量下降。而在65 ℃处理后的羊乳蛋白含量较其他处理组最低,可能是由于耐热蛋白酶的最佳酶解温度主要集中于60~80 ℃,少数例外也在80 ℃以上[23],因此水解酶的活性未完全激活。在95 ℃不同时间的处理下,处理15 s后羊乳蛋白质含量相对其他处理组最高,这可能是由于在此条件下蛋白水解程度较大,产生了较多游离氨基酸和小肽导致的。
2.3 不同巴氏杀菌对羊乳色泽的影响
采用全自动色差仪对65、75、85和95 ℃巴氏杀菌乳中的蛋白质色值进行测定。由表1可知,65、75、85、95 ℃处理的羊乳b*显著高于对照组(P<0.05),4组处理组之间也均具有显著性差异(P<0.05)。随着温度的增加,羊乳的b*值呈逐渐增大的趋势,在75 ℃时,羊乳的b*值相对于其他处理组最低。这说明褐变现象最明显的为95 ℃处理组,接下来依次为85、65、75 ℃处理组。而各巴氏杀菌的L*,a*,c*,H则无显著规律变化(P>0.05)。综上结果表明,在不同温度处理30 min,羊乳b*值的大小与处理温度的高低呈一定程度的正相关。

表1 不同巴氏杀菌对羊乳色泽的影响Table 1 Effects of different heat treatments on goat milk color values
色值变化体现了美拉德反应的程度。本文研究结果表明75 ℃以上,随着温度的增加,羊乳的b*值呈逐渐增大的趋势。这可能是由于在高温条件下,乳糖降解产生还原性单糖,其羰基与乳蛋白的氨基相互作用发生美拉德反应,生成中间产物羟甲基糠醛,进一步积累形成类黑色素,且随着加热时间和加热温度的增加,褐变程度增大[24]。这与孙静丽[25]、李思宁等[26]研究结果相一致。因此,黄值也可作为巴氏杀菌对羊乳品质影响的重要指标之一。
2.4 羊乳蛋白粒子形貌原子力显微镜观察
采用原子力显微镜对巴氏杀菌(95 ℃,15 s)处理乳进行蛋白质粒子形貌观察。如图3、表2、表3所示,95 ℃,15 s 巴氏杀菌处理组蛋白的颗粒数目(77)显著低于对照组(437)(P<0.05),蛋白的颗粒密度(3.08个/μm2)显著低于对照组(17.48个/μm2)(P<0.05),蛋白的颗粒直径(93.91 nm)大于对照组(80.41 nm),蛋白的片状凝聚程度(8 221.42 nm2)显著高于对照组(5 636.28 nm2)(P<0.05),而且蛋白质颗粒表面的起伏程度(5.92~23.79 nm)大于对照组(2.54~16.92 nm)。
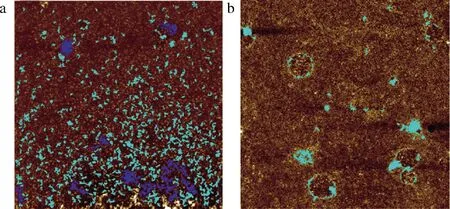
a-常温(25 ℃);b-巴氏杀菌(95 ℃,15 s)图3 常温(25 ℃)和巴氏杀菌(95 ℃,15 s)处理后羊乳 蛋白质粒子的表面形貌Fig.3 Surface morphology of protein particles from goat milk treated at room temperatire(25 ℃) and 95 ℃ for 15 s
结果表明,巴氏杀菌后羊乳蛋白质粒度大于常温(25 ℃)对照组羊乳。这可能是由于加热导致羊乳蛋白的结构改变。巴氏杀菌后的羊乳表面有较大的凝聚颗粒,可能是因为高温导致蛋白质分子内部肽链运动加剧,β-乳球蛋白与K-酪蛋白、α-乳白蛋白等的空间结构改变,导致蛋白质分子间形成二硫键[27],结合成直径更大的蛋白颗粒,由于这种结合方式下蛋白质空间排布不紧密,可能形成了疏松多孔结构,所以更多的小颗粒蛋白附着在羊乳酪蛋白表面,蛋白质粒子也会逐渐增大。另一方面,大分子蛋白质粒子数目在巴氏杀菌后大幅下降,这可能是由于在巴氏杀菌处理中,除部分含巯基蛋白质聚集外,还有部分其他的蛋白质在该温度下发生大量水解,形成小分子氨基酸,使得大分子蛋白质粒子数目明显降低。与李子超等[28]、杨楠[29]、CORREDIG等[30]和KAZMIERSKI等[31]研究结果类似,并且这种结果与上文热处理对羊乳蛋白水解程度的影响分析结果一致。

表2 常温(25 ℃)对照组羊乳蛋白质粒度

表3 巴氏杀菌(95 ℃,15 s)羊乳蛋白质粒度Table 3 Particle sizes of goat milk protein pasteurized at 95 ℃ for 15 s
2.5 巴氏杀菌羊乳蛋白质SDS-PAGE分析
采用SDS-PAGE对65、75、85和95 ℃巴氏杀菌乳中的蛋白质条带进行分析。如图4所示,各巴氏杀菌样品均含有2条类似的蛋白条带,但65、75 ℃巴氏杀菌组的A蛋白条带灰度与对照组相近;85、95 ℃巴氏杀菌组的A蛋白条带灰度明显低于其他处理组,并且蛋白质条带数目较75 ℃的巴氏杀菌处理组明显减少。另外,65和75 ℃巴氏杀菌组的A蛋白条带灰度无明显差异;85和95 ℃巴氏杀菌组的A蛋白条带灰度无明显差异。

图4 巴氏杀菌羊乳蛋白质SDS-PAGE分析Fig.4 SDS-PAGE analysis of goat milk protein after pasteurization注:图中条带1, 2, 3, 4, 5分别代表对照、65、75、85、 95 ℃羊乳热处理30 min
85、95 ℃巴氏杀菌的羊乳SDS-PAGE电泳灰度明显变浅,表明随着温度的增高,羊乳蛋白水解程度增加。电泳条带的灰度值与蛋白质分子的凝聚和交联作用有关,形成这种现象的原因可能是高温促进了蛋白质的水解,使蛋白质分解成更小分子肽和游离氨基酸,从而使条带变浅。65和75 ℃处理的羊乳与对照组灰度无明显差异,表明该温度处理基本不会导致蛋白质的明显水解,并且较85、95 ℃处理而言,65和75 ℃处理的羊乳蛋白质电泳条带数目与对照组相比无明显变化,也进一步证明上述结果。在75 ℃蛋白质条带灰度的变化较小,因此在一定程度上这种温度的处理可能更有利于保存蛋白质活性。
3 结论
巴氏杀菌是影响乳品加工品质的关键因素之一。本文研究表明巴氏杀菌会导致蛋白质含量、色值、表观形貌的变化。巴氏杀菌的温度和时间均对羊乳蛋白质的水解存在着显著影响(P<0.05)。温度增加容易导致蛋白质变性程度增加,表现为水解程度增大、羊乳褐变程度加深,进一步表现为75 ℃蛋白条带无明显变化,85、95 ℃蛋白质条带减少、灰度变浅,并且95 ℃,15 s巴氏杀菌后的羊乳蛋白质数目减少、粒度增大。综上所述,75 ℃,30 min的巴氏杀菌方法最适于羊乳的加工与生产,为羊乳的热加工提供了参考。
