单增李斯特菌生物膜形成及其调控机制研究进展
2021-05-10胡丽丽董庆利夏阳张帅帅杨静远王真刘阳泰
胡丽丽,董庆利,夏阳,张帅帅,杨静远,王真,刘阳泰
(上海理工大学 医疗器械与食品学院,上海,200093)
单核细胞增生李斯特氏菌(Listeriamonocytogenes),简称单增李斯特菌,是一种兼性厌氧的革兰氏阳性杆菌,广泛存在于自然界中,可污染奶制品、肉制品、水产品以及即食食品等,是重要的食源性致病菌之一[1]。当摄入被单增李斯特菌污染的食品后,孕妇、婴幼儿及老人等免疫低下人群极易罹患李斯特菌病,其致死率高达23.6%[2]。2016年,欧盟报告了李斯特菌病的确诊病例约为2 500例[3]。自2013—2017年以来,我国食源性疾病监测网络报告的相关感染病例为211例,呈散发状态[4]。
生物膜(biofilm)是由细菌和自身分泌的胞外聚合物质(extracellular polymeric substances,EPS)组成,可黏附在生物及非生物材质表面,是具有三维立体空间结构的细胞群体[5]。单增李斯特菌可在食品接触表面如不锈钢、聚丙烯形成生物膜,同时生物膜对消毒剂、低温等不利环境耐受性强,可以长时间存活,容易形成持久性的污染源头,给食品安全造成潜在的隐患[5]。因此,近年来对其生物膜的组成、形成差异、耐药性、调控机制等研究广泛开展。本文将介绍单增李斯特菌生物膜的形成过程及其影响因素,同时对生物膜的多种调控机制进行总结分析,为其相关研究提供一定参考。
1 细菌的生物膜及其形成过程
自然界的多数细菌可形成生物膜,是一种抗逆保护机制。细菌形成生物膜且可以长期存活的原因可总结为4点:一是自然环境中往往营养匮乏,不利于细菌的大量生长繁殖。细菌为了能够存活会放弃最佳生长状态,以营养缺陷型即生物膜形式存在;二是生物膜是一个具有稳定的含水量、氧气含量的微环境,适宜细菌的生长;三是生物膜的细胞以协同合作的方式互相接触、催化、基因交换,最终使得群体适应环境而生存;四是生物膜分泌的EPS能有效地阻止抗生素、消毒剂渗透以及延缓其扩散,使内部细菌得以存活[6]。
研究发现细菌的生物膜形成是循环往复的动态演变过程,通常可分为5个阶段:可逆黏附、不可逆黏附、微菌落的形成、生物膜的成熟、生物膜的分散[7],如图1所示。少数的菌体首先通过范德华力、静电相互作用、疏水相互作用黏附在介质表面,逐渐形成微小的菌落。随着菌体大量生长繁殖并分泌EPS,生物膜形成多层的结构,其生理代谢过程发生改变。在生物膜的成熟阶段,菌体之间相互作用增强,细胞被完全包裹在EPS内形成结构复杂的聚集体。聚集体之间的空隙作为营养物质、代谢废物及信号分子的通路。当营养成分缺乏、氧气不足会导致内部菌体开始逐渐死亡,生物膜结构开始解离分散。随后,游离态菌体又开始新一轮的黏附生长过程[5,7]。
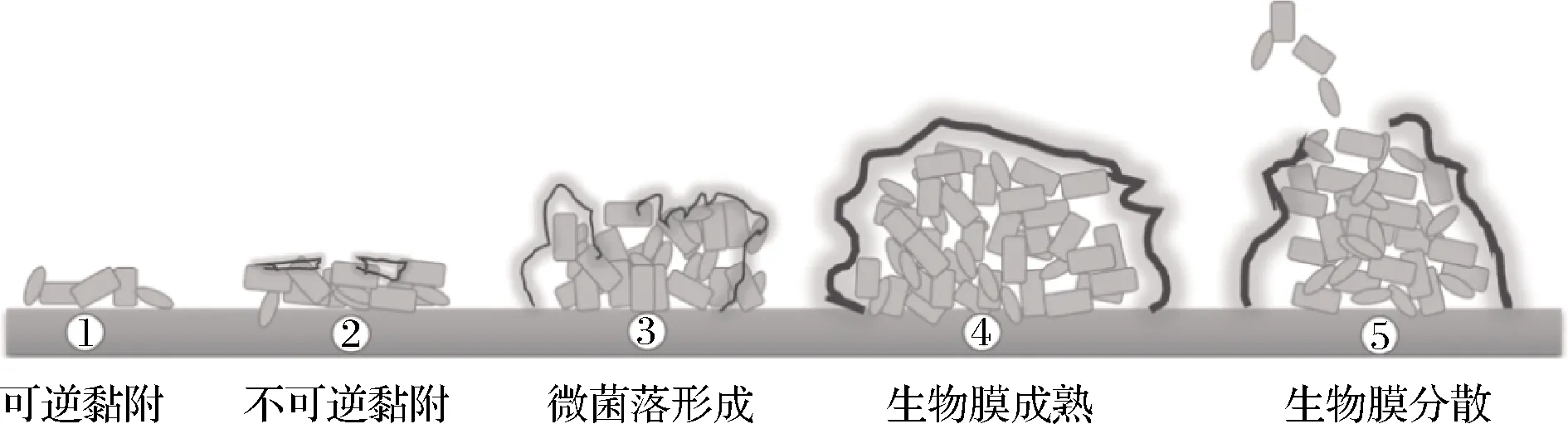
图1 细菌的生物膜形成过程Fig.1 The biofilm forming process of bacteria
细菌生长的环境复杂多变,同时各种细胞代谢途径有明显差异。单增李斯特菌作为重要的食源性致病菌,在不同环境下,其独有的反馈机制会做出正向或反向调控,从而影响生物膜的整个形成过程。
2 单增李斯特菌生物膜形成的影响因素
诸多因素会影响单增李斯特菌生物膜形成的整个过程,通常可分为环境因素和菌株特性,如温度、营养成分、细胞表面疏水性、血清型等。单增李斯特菌所处的环境复杂多变,往往是多种因素的叠加组合,因此理解培养条件对其生物膜的形成量、微观结构、细胞形态等的影响有利于生物膜的预防和控制。
2.1 环境因素
温度不仅影响单增李斯特菌种群密度的变化,也是其生物膜形成的重要因素之一。温度升高时,单增李斯特菌的生长代谢速率会加快,导致一定时间内其生物膜形成量随之增加[8]。然而部分研究表明,营养缺乏的培养条件下,温度过高反而不利于生物膜的形成,42 ℃下不锈钢表面附着的活细胞数量低于30 ℃[9]。培养基经过稀释后,单增李斯特菌在12 ℃的生物膜形成量显著高于20、30 ℃,可能是低温促进了单增李斯特菌生物膜形成[10]。此外,通过细胞染色方法发现,营养缺乏的培养基内其生物膜的EPS及非活性细胞数量高于脑心浸液肉汤(brain heart infusion,BHI)培养基[9],由于生物膜结构是细胞及EPS的聚集体,其形成量高并不代表活细胞数量多。
营养成分对单增李斯特菌生物膜形成有着至关重要的作用。人工培养基如BHI、胰蛋白胨大豆肉汤(tryptic soy broth,TSB)、营养肉汤(meat broth,MB)培养基等可为生物膜的形成提供丰富的营养物质。由于培养基的碳源、氮源、无机盐成分有所差异,导致单增李斯特菌生物膜形成量各有不同。研究发现在BHI培养基中单增李斯特菌的生物膜形成量最高[11]。为了更好地模拟真实环境下生物膜的形成,逐渐采用食品基质作为研究对象。常见的碳水化合物对单增李斯特菌的生物膜形成均有一定促进作用,其中木糖醇和魔芋精粉的作用较为显著[12]。然而高浓度的葡萄糖会减少单增李斯特菌生物膜的活细菌数量,增加其EPS的分泌[13]。此外在肉制品中,猪肉汁相较于鸡肉汁与牛肉汁,能显著提高单增李斯特菌生物膜的形成量,这可能与该研究所用菌株多数分离于猪肉有关[14]。
接触表面的材质类型也是影响菌体黏附数量的关键因素之一。不同材料的表面特性(疏水性、表面粗糙度)可显著影响菌体的黏附效果。多数研究表明,单增李斯特菌更倾向于附着在亲水性材质上,如不锈钢、玻璃表面,只有少量的菌株可在疏水性材质如聚苯乙烯上形成生物膜[15]。橡胶材料因其表面疏水性高且粗糙度较低,其生物膜形成量低于不锈钢、聚乙烯表面[16]。通过扫描电镜、激光扫描共聚焦显微镜可以观测到不同材质表面形成的生物膜微观结构有明显差异,其结构有贴壁细胞单层结构、蜂窝状结构、蘑菇状结构、针织链结构、无组织聚集结构等[17]。由此可见,材质的表面特性会影响单增李斯特菌的生物膜形成及其结构。
另外,培养方式、环境渗透压也会影响单增李斯特菌的生物膜形成量。与摇床培养相比,静置条件下单增李斯特菌生物膜在BHI培养基中的形成显著提高[18]。低浓度的NaCl可促进单增李斯特菌生物膜的形成,但NaCl浓度过高时则起到抑制作用[12]。环境的胁迫因素会触发单增李斯特菌的应激反应,促使形成更多的生物膜以抵抗不利环境。
2.2 菌株特性
单增李斯特菌的血清型与生物膜形成能力有一定关联。根据菌体抗原和鞭毛抗原单增李斯特菌可分为16个血清型,不同血清型的致病能力不同,其中与李斯特菌病爆发相关的常见血清型是1/2a、1/2b、4b。MELONI等[19]研究了分离于肉类加工厂的40株单增李斯特菌菌株,发现在BHI培养基中血清型为1/2a、1/2b、4b的菌株比1/2c血清型具有更高的黏附能力。此外,4b血清型的菌株生物膜形成能力高于1/2a血清型[20]。当培养条件的温度、营养成分改变时,血清型对单增李斯特菌生物膜形成影响作用较小。此外,不同分离来源的单增李斯特菌的生物膜形成能力也有所差异。部分单增李斯特菌菌株在经过消毒剂、低酸等环境胁迫因素后,菌株的毒性、抗性增强的同时其生物膜形成量增加[21]。食品工厂环境中长期持留的单增李斯特菌菌株,在较短培养时间内其黏附细胞数量多于散发菌株。然而随着培养时间增加,两者生物膜形成量无显著差异[22]。这表明持留菌株对于生物膜的早期形成有一定促进作用,利于菌体的黏附。
单增李斯特菌的表面疏水性、得失电子能力、菌体的聚集性和泳动能力会对其黏附和生物膜产生一定影响。在生物膜形成的初始黏附阶段,单增李斯特菌通过鞭毛、菌毛和纤毛等丝状结构体增强菌体与接触面的黏附,利于生物膜的形成及发展。在聚苯乙烯表面的生物膜形成能力与细胞表面疏水性呈正相关关系,随菌株的表面疏水性增加而增加[23]。值得注意的是,细菌的细胞壁组成会随温度发生变化,导致其表面疏水性改变。同时,单增李斯特菌在20~25 ℃时会产生鞭毛利于细菌的趋化运动及细胞聚集[24]。因此当探究细胞表面疏水性对生物膜的影响时,需要考虑温度、培养介质等因素的共同作用、相互影响。
3 单增李斯特菌生物膜形成的调控机制
单增李斯特菌的生物膜形成过程包含了多种复杂的调控机制,如基因调控、蛋白表达、EPS分泌、群体感应系统调节等。深入研究生物膜的形成机制,对于生物膜的防控具有重要意义。
3.1 基因调控
当前对单增李斯特菌生物膜调控基因的研究,主要集中在探究已知功能基因以及未知基因在生物膜形成的作用。已有大量研究表明,单增李斯特菌的应激反应调节因子、毒力基因、鞭毛基因等缺失后,细胞的附着数量及生物膜的形成量减少。表1总结了与单增李斯特菌生物膜形成的相关基因及调节因子。
在单增李斯特菌中,由sigB基因编码的SigB是受到环境胁迫时的主要调节因子。在适宜环境时RsbW蛋白能使RsbV蛋白磷酸化,使sigB的活性受到抑制。当RsbV蛋白去磷酸化并与RsbW蛋白结合,促使sigB因子被释放并装载到RNA核心酶上,从而调控生理代谢相关基因的表达,使其在低温、低酸、高渗等环境下生存[25]。生物膜作为细菌的一种抗逆机制,sigB基因的调控与生物膜形成之间有着非常重要的关联。ΔsigB突变株的生物膜形成能力显著低于野生型菌株[26]。通过对野生型菌株与ΔsigB突变株的转录水平进行比较,发现大量的基因存在显著性差异,且差异主要体现在核糖体的生物合成、翻译、细胞组件合成,氨基酸、无机离子和碳水化合物的运输与代谢、部分未知的功能基因等[26]。然而sigB基因对生物膜的调控机制研究目前主要集中在原始菌株与突变菌株表型的差异比较。随着研究技术的不断发展,利用基因组学、转录组学等对具体的调控途径进行探究将能更深刻了解生物膜的形成机制。

表1 单增李斯特菌生物膜形成的功能基因及作用Table 1 Functional genes and their effects on the formation of Listeria monocytogenes biofilm
由prfA基因编码的PrfA蛋白是单增李斯特菌最重要的毒力调控因子,在感染宿主细胞的过程中可调控大多数毒力基因进行转录,如hly、inlA、inlB、plcA、actA等。在ΔprfA突变株中PrfA蛋白不具有活性,进入宿主细胞后不能正向调控ActA蛋白的表达,使单增李斯特菌不能在细胞间进行扩散[34]。此外,ΔprfA突变株会影响生物膜形成的初始表面黏附以及延缓生物膜的形成,但携带PrfA蛋白的重组单增李斯特菌可恢复生物膜形成能力[35]。ActA蛋白作为重要的毒力因子,研究发现ΔactA缺失株会降低单增李斯特菌的细胞聚集,减少生物膜的形成量。此外,SigB调控因子可直接或间接调节如prfA、inlA、inlB等毒力基因,这些功能基因在单增李斯特菌生物膜形成中发挥着重要作用。
鞭毛基因调控单增李斯特菌的鞭毛合成,如flaA基因编码鞭毛蛋白作为鞭毛的结构亚基,motA、motB基因可调控鞭毛的运动能力[36]。研究表明,ΔflgL与ΔmotA的单增李斯特菌突变株会降低细胞的表面附着,影响生物膜形成过程的初始黏附阶段[37]。ΔflaA、ΔmotAB突变株与野生型菌株相较,其生物膜形成量降低,在半固体琼脂上菌落直径明显减小[38]。总的来说,鞭毛的存在利于单增李斯特菌克服表面张力运动到营养物质的表面,互相聚集从而促进生物膜的早期形成。
3.2 EPS的调控作用
单增李斯特菌的EPS主要是由胞外多糖(exopolysaccharides)、蛋白质、核酸组成的复杂混合物,可占生物膜干重的90%以上。作为生物膜的三维基本结构,其对细菌的表面黏附、细胞聚集、保护屏障、吸收营养物质等有着至关重要的作用[39]。
胞外多糖是细菌生物膜EPS的主要成分,作为生物膜的三维结构支架可提高生物膜的机械稳定性和细菌细胞对接触表面的黏附力[39]。BRAUGE等[40]研究发现,单增李斯特菌的胞外多糖成分为磷壁酸。第二信使环二鸟苷酸(cyclic diguanylate,c-di-GMP)能够正向调控胞外多糖的产生,细胞内高水平的c-di-GMP可以促进胞外多糖的合成从而促进生物膜的形成,而低水平的c-di-GMP则通过增强细菌的活力促使生物膜分散,转向游离态[41]。当单增李斯特菌黏附在接触表面时,细胞中的磷壁酸被吸收成为生物膜的EPS组成成分[42]。
蛋白质也是单增李斯特菌生物膜EPS的重要组成部分,与细胞的初始表面附着有重要关联。LONGHI等[43]用蛋白酶处理单增李斯特菌生物膜后,发现生物膜的形成受损,同时会诱导细胞分散。单增李斯特菌可转录翻译多种蛋白质,在生物膜的黏附、形成发挥重要作用,如内化素A(internalin,InlA)是一种细胞壁结合蛋白,与单增李斯特菌对宿主细胞的侵袭和黏附相关。可编码非功能作用的截短InlA的单增李斯特菌菌株,其生物膜形成能力显著高于野生型菌株[44]。Bap蛋白广泛存在于金黄色葡萄球菌、沙门氏菌中参与生物膜的形成,单增李斯特菌中存在与Bap蛋白结构特征相似的蛋白质BapL,可以促进生物膜的形成[45]。
胞外DNA(extracellular DNA,eDNA)是单增李斯特菌生物膜EPS的重要组成结构,其可能的来源是培养环境或溶解破裂的细胞。eDNA通过特定的方式与肽聚糖的N-乙酰葡萄糖胺相互作用,参与生物膜形成的黏附过程,同时作为高分子物质可以使细菌表面的黏附位点饱和,形成致密的生物膜结构。另外,用脱氧核糖核酸酶处理单增李斯特菌后,细菌的初始附着受到抑制,并延缓了生物膜的形成[46-47]。
3.3 群体感应系统的调节
群体感应(quorum sensing,QS)系统广泛存在细菌中,是细胞与细胞之间的信息交流,可调控的生理特性包括细菌的生物膜形成、毒力与侵袭性、细菌素产生、耐药性、形态转换等[48],如图2所示。
根据信号分子的种类,细菌的群体感应可分为3种。一是存在于革兰氏阴性菌中以高丝氨酸内酯(N-acyl homoserine lactones,AHL)信号分子介导的种内群体感应系统。当AHL浓度达到一定阈值时,可与LuxR家族的DNA结合受体蛋白相互作用,从而介导特定的基因表达[49];二是革兰氏阳性菌中,以自诱导寡肽(autoinducing peptide,AIP)介导的群体感应系统。AIP的前体肽在细胞内合成后,需要经过一系列的转运修饰才具备活性。随后通过ATP结合盒转运蛋白(ATP-binding cassette transporter,ABC)运输到胞外,被细胞膜上的双组分组氨酸激酶识别从而引发磷酸化反应[50];三是存在于革兰氏阳性菌与阴性菌的呋喃糖基硼酸二酯(autoinducer-2,AI-2)群体感应系统,在细菌之间发挥重要的信号传递和交流作用[51]。
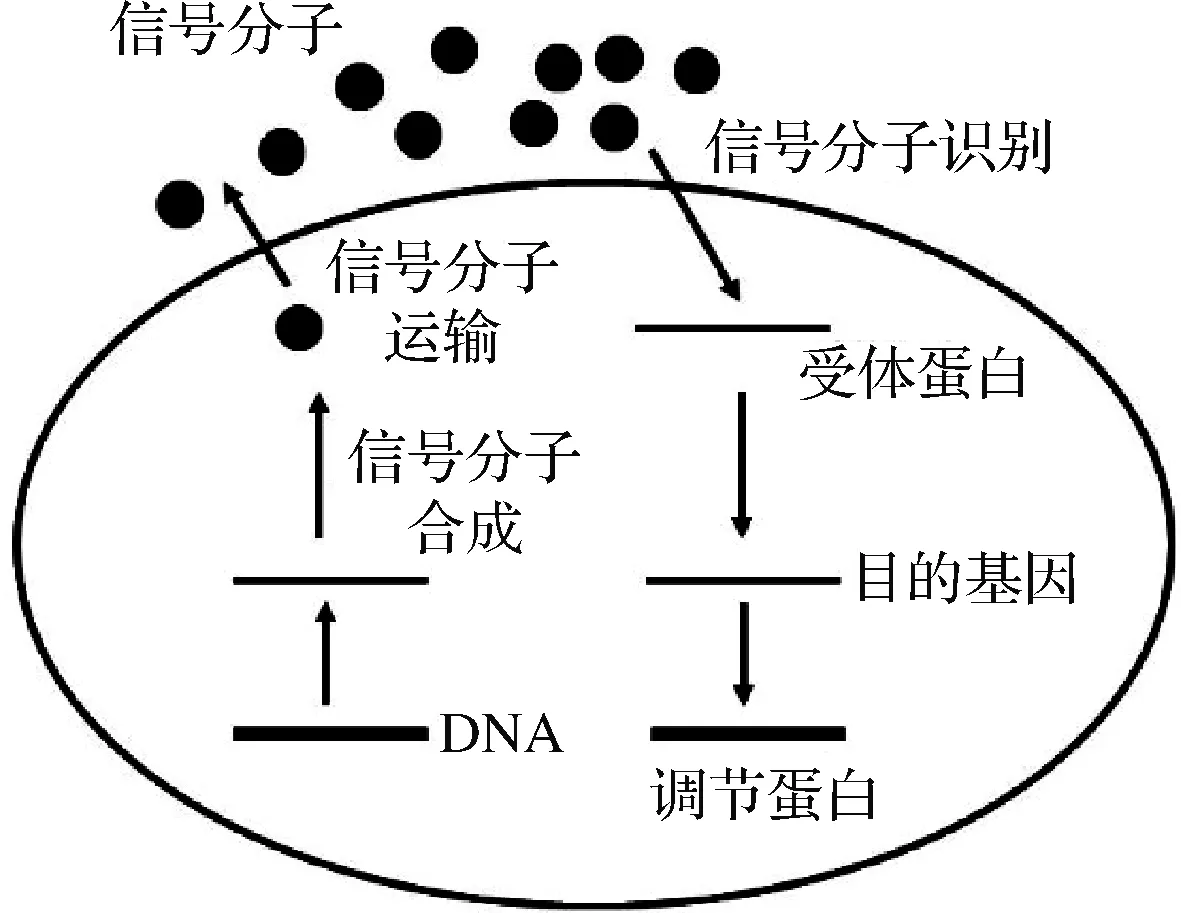
图2 细菌的群体感应过程Fig.2 The quorum sensing process of bacteria
在革兰氏阳性菌中,金黄色葡萄球菌的QS系统研究较为深入,包括AIP及AI-2两种。由信号分子AIP介导的双组分信号转导系统agr系统被证实与毒力基因、生物膜形成有关。首先由agr操纵子编码的agrBDCA 4种蛋白质,其中AgrB是一种膜结合肽酶,参与AgrD加工合成AIP并输出释放。AIP在细胞外积累到一定浓度后激活由组胺酸激酶(AgrC)和反应调节器(AgrA)组成的双组分系统,被磷酸化的AgrA蛋白分别激活P2和P3启动子进而编码RNA Ⅲ,最后由RNA Ⅲ转录激活毒力因子的产生及降低表面黏附相关基因的表达,从而增加毒性与减少生物膜的形成[52]。单增李斯特菌也含有agrB、agrD、agrC、agrA基因,研究发现基因agrD或agrA缺失的单增李斯特菌EGDe菌株的成膜能力和毒力均显著降低[53]。在ΔagrD突变体中,毒力相关基因(hlyA、actA、prfA和inlA)的表达下调,细菌的毒力下降[54]。尽管革兰氏阳性菌的agr系统在多种调控途径上存在相似性,但是不同的阳性菌中也存在一定差异。单增李斯特菌的agr系统调控机制还需更多的基础研究去证实。此外,种间交流的信号分子也会影响单增李斯特菌的生物膜形成,在培养基加入一定浓度的AHLs后,其生物膜形成量显著提高[55]。
4 结论与展望
单增李斯特菌可在常见的食品加工设备表面形成生物膜且难以清除,其有效控制是食品工业的难题。同时环境因素与菌株特性的共同作用影响其生物膜的形成,研究其形成差异、内部的复杂调控机制对食品加工过程中其预防控制具有重要的意义。本文通过归纳得到如下结论和展望:
(1)食品工厂的加工过程中,利用温度、pH、材质特性等重要影响因素去抑制单增李斯特菌的黏附与生物膜形成仍是未来研究的主要方向。此外,EPS的存在显著提高生物膜的存活时间,开发新型的酶制剂、消毒剂破坏生物膜的结构以达到高效安全的清除效果,其应用前景也十分广泛。
(2)基因调控和蛋白质表达参与单增李斯特菌的生物膜形成过程,然而这些功能基因的具体调控途径、调控阶段尚未可知,同时还有许多未知基因的功能作用尚不明确。除了表型差异的相关研究,利用转录组学、蛋白组学、代谢组学等组学技术将有助于破译单增李斯特菌生物膜形成的复杂机制。
(3)QS系统对于单增李斯特菌的生物膜形成有至关重要的调节作用,其信号分子的合成、转运及调控仍有待深入研究。此外,在真实环境中往往是多种细菌形成的复合生物膜,研究不同信号分子的种间交流,这将有助于理解同一生态位的不同细菌之间的相互作用。
