人脐带间充质干细胞源外泌体对高糖环境下RPE细胞自噬和VEGF表达的影响
2021-05-10刘文兰
闫 瑾,王 莉,李 蓉,杨 扬,刘文兰,朱 丹,焦 聪
0引言
外泌体(exosomes)是一种具有磷脂双分子层膜结构的细胞外微囊泡,直径范围40~100nm[1],携带脂质、蛋白质、核酸以及细胞因子等多种内容物[2]。间充质干细胞(mesenchymal stem cells,MSCs)是存在于多种组织中的一类干细胞,具备多向分化潜能[3],具有不易引起免疫反应、易于获得和可体外分离连续传代培养等优势[4]。作为视网膜外屏障的组成部分,视网膜色素上皮(retinal pigment epithelium,RPE)细胞具有多种复杂生理生化功能,其分泌的血管内皮生长因子(vascular endothelial growth factor,VEGF)是促进新生血管形成的关键因子[5-7]。自噬是真核细胞在生理和病理状态下均存在的一种动态的生理过程,通过溶酶体介导了细胞内蛋白质和衰老受损细胞器等大分子物质的代谢和降解,利用自噬这一更新过程维持细胞的正常代谢内环境稳态[8]。既往研究显示,在高糖、缺氧或炎症等环境下,视网膜自噬水平明显异常,进而参与眼部疾病的发生和发展[9-12]。随着MSCs外泌体与眼科疾病相关研究的开展,发现MSCs外泌体在视神经损伤、年龄相关性黄斑变性及角膜疾病的治疗中表现出潜在的价值[13-17]。本研究以人RPE细胞作为研究对象,观察人脐带间充质干细胞(human umbilical mesenchymal stem cells, hUMSC)源外泌体对高糖环境下人RPE细胞的自噬和VEGF表达水平的影响,为糖尿病视网膜病变的治疗提供新的可能性。
1材料和方法
1.1材料经产妇本人及家属签署脐带用于实验研究的知情同意书及学院伦理委员会批准后,取健康足月婴儿脐带。人ARPE-19株(武汉普诺赛生命科技有限公司);DMEM培养基、0.25%胰蛋白酶及胎牛血清(美国Gibco公司);兔多抗自噬标志性蛋白微管相关蛋白1轻链3(microtubule-related protein 1 light chain 3, LC3)B(Ab48394)、兔单抗CD90(ab133350)、兔单抗CD63(ab134045)(英国abcam公司);兔多抗Beclin-1(3495S,美国CST公司);兔多抗p62(AF5384,美国Affinity Biosciences公司);兔多抗GAPDH(AB-P-R 001,杭州贤至生物有限公司);HRP标记羊抗兔二抗(BA1054,武汉博士德生物工程有限公司);外泌体提取试剂盒Total Exosome Isolation (from cell culture media)(4478359,美国Invitrogen公司);噻唑兰MTT(3580MG250,德国BIOFROX公司);人VEGF ELISA试剂盒(Human VEGF-A ELISA Kit E-EL-H0111c武汉伊莱瑞特生物科技股份有限公司);倒置相差显微镜(日本Nikon公司,型号ECLIPSE Ts2);微型高速离心机(美国Labnet公司,型号C2500-R-230V);全自动酶标仪(美国Thermo scientific公司,型号mμlISKANMK3);透射电子显微镜(日本HITACHI公司,型号HT7700-SS)。
1.2方法
1.2.1 hUMSC的分离和培养及鉴定组织块贴壁法分离培养hUMSC[18]。组织块附着后添加含10%胎牛血清的DMEM/F12培养基,每隔3d换液,待细胞融合达80%~90%时,用0.25%胰蛋白酶消化传代,比例为1∶3。hUMSC细胞传代至第3代,胰酶消化离心后加入兔单抗CD90,4℃孵育后Western blot印迹检测。
1.2.2 hUMSC外泌体的提取取第4~5代生长良好的hUMSC细胞,用10%exo-FBS培养液培养48h,收集细胞上清液,2000g离心30min以去除细胞、碎片等。将离心后获得的上清液与外泌体提取试剂按2∶1混匀,4℃孵育过夜后10000g离心1h,保留沉淀,即为外泌体。加入PBS重悬外泌体,将重悬后的外泌体分装保存于-80℃冰箱。
1.2.3外泌体鉴定及结构观察外泌体蛋白鉴定:蛋白样品上样,凝胶电泳至目的蛋白有效分离。转膜,5%脱脂奶粉封闭2h。将膜与一抗CD63(1∶1000)于4℃孵育过夜。将膜浸泡于HRP标记二抗(1∶50000)中,37℃摇床孵育2h。ECL试剂盒显影曝光,分析处理胶片中蛋白条带的灰度值。外泌体结构观察:质量分数2%多聚甲醛固定外泌体悬液,滴样本于载样铜网上,3%磷钨酸染色5min,室温干燥,透射电镜观察外泌体结构并拍照。
1.2.4细胞培养及分组选用DMEM/F12(含10% FBS+1%青霉素和链霉素)培养液,在37℃、5% CO2及饱和湿度条件下培养ARPE-19细胞,实验选用处于对数生长期的第5~10代,按照5.0×105个/孔传代于6孔板内,随机分为对照组、高糖组和外泌体+高糖组,对照组在无糖培养基中培养,高糖组在培养基中加入25mmol/L D-glucose,外泌体+高糖组先用75μg/mL外泌体预处理12h后,置于含25mmol/L D-glucose的培养基中,三组培养时间均为48h。
1.2.5 MTT法检测ARPE-19细胞增殖率使用微量酶比色法测定试剂盒,根据说明书检测ARPE-19细胞增殖率。细胞增殖率(%)=(实验组平均OD值-空白孔平均OD值)/(对照组平均OD值-空白孔平均OD值)×100%。
1.2.6透射电子显微镜下观察自噬体的形成刮取各组细胞,戊二醛固定2h,充分漂洗后,在质量分数为1%锇酸中4℃固定,脱水,包埋。在裸铜网格上制备超薄切片,铀铅双染色,透射电子显微镜下观察自噬体形态、结构及数量,拍照。
1.2.7 Western blot法检测各组ARPE-19细胞中自噬蛋白LC3B、Beclin-1和p62的表达收集各组细胞裂解充分后,离心提取总蛋白,BCA法蛋白定量。蛋白上样,SDS-PAGE凝胶电泳,转膜,封闭,滴加一抗,一抗稀释浓度如下:LC3B(1∶1000)、Beclin-1(1∶1000)、p62(1∶1000)、GAPDH(1∶1000),辣根过氧化物酶标记的羊抗兔二抗(1∶50000)孵育。暗室显影,依据胶片灰度值,与内参GAPDH比较计算出LC3B-Ⅱ/LC3B-Ⅰ比值及Beclin-1和p62蛋白相对表达量,每组3次生物学重复,取平均值。
1.2.8 ELISA法检测ARPE-19细胞VEGF蛋白表达按照使用说明,采用人VEGF酶联免疫吸附试验试剂盒检测ARPE-19细胞上清液中VEGF蛋白浓度。酶标仪测量OD450值。应用直线相关回归分析,在标准曲线上查出待测样本对应的VEGF浓度。
2结果
2.1 hUMSC的形态观察及鉴定使用倒置显微镜观察脐带华通氏胶组织(Wharton jelly)贴壁培养的第3代hUMSC细胞呈长梭形或纺锤形,形态均一,紧密排列,类似纤维细胞,集落生长,细胞分布呈鱼群状或漩涡状(图1A)。Western blot检测hUMSC阳性表达CD90(图1B),符合MSCs鉴定标准。
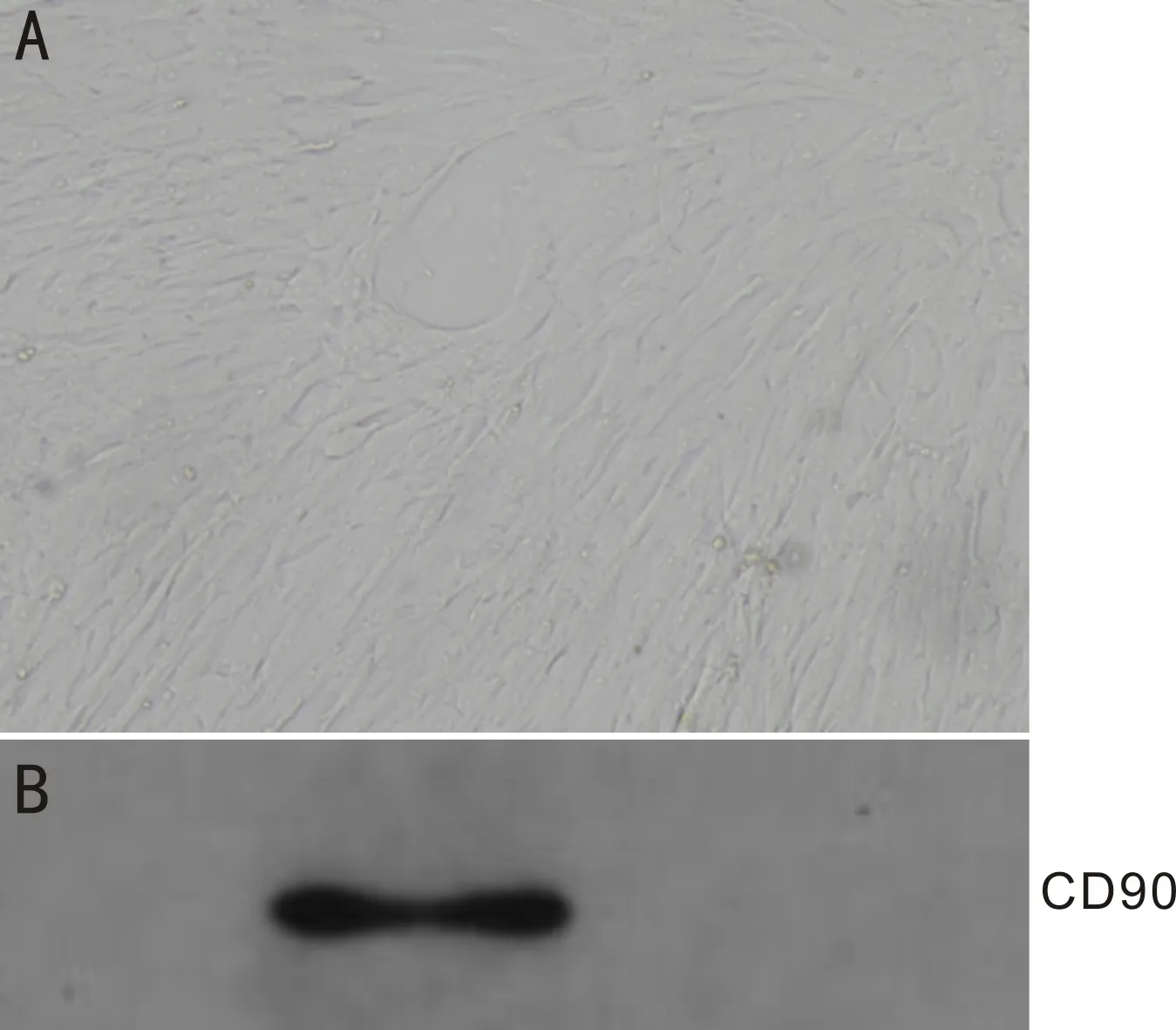
图1 hUMSC的形态观察及鉴定 A:光学显微镜观察第3代hUMSC形态(×100)。hUMSC细胞培养至第3代,呈成纤维细胞样的长梭形,涡旋状排列;B:Western blot检测hUMSC表面标志蛋白CD90。
2.2 hUMSC外泌体超微结构观察及鉴定经透射电镜观察可见分离纯化后的外泌体为内含低电子密度成分的球状或椭球状膜性囊泡,直径范围30~100nm。外泌体囊泡外围可见类质脂膜性结构(图2A)。蛋白免疫印迹法显示,hUMSC外泌体阳性表达特异性标志蛋白CD63(图2B)。
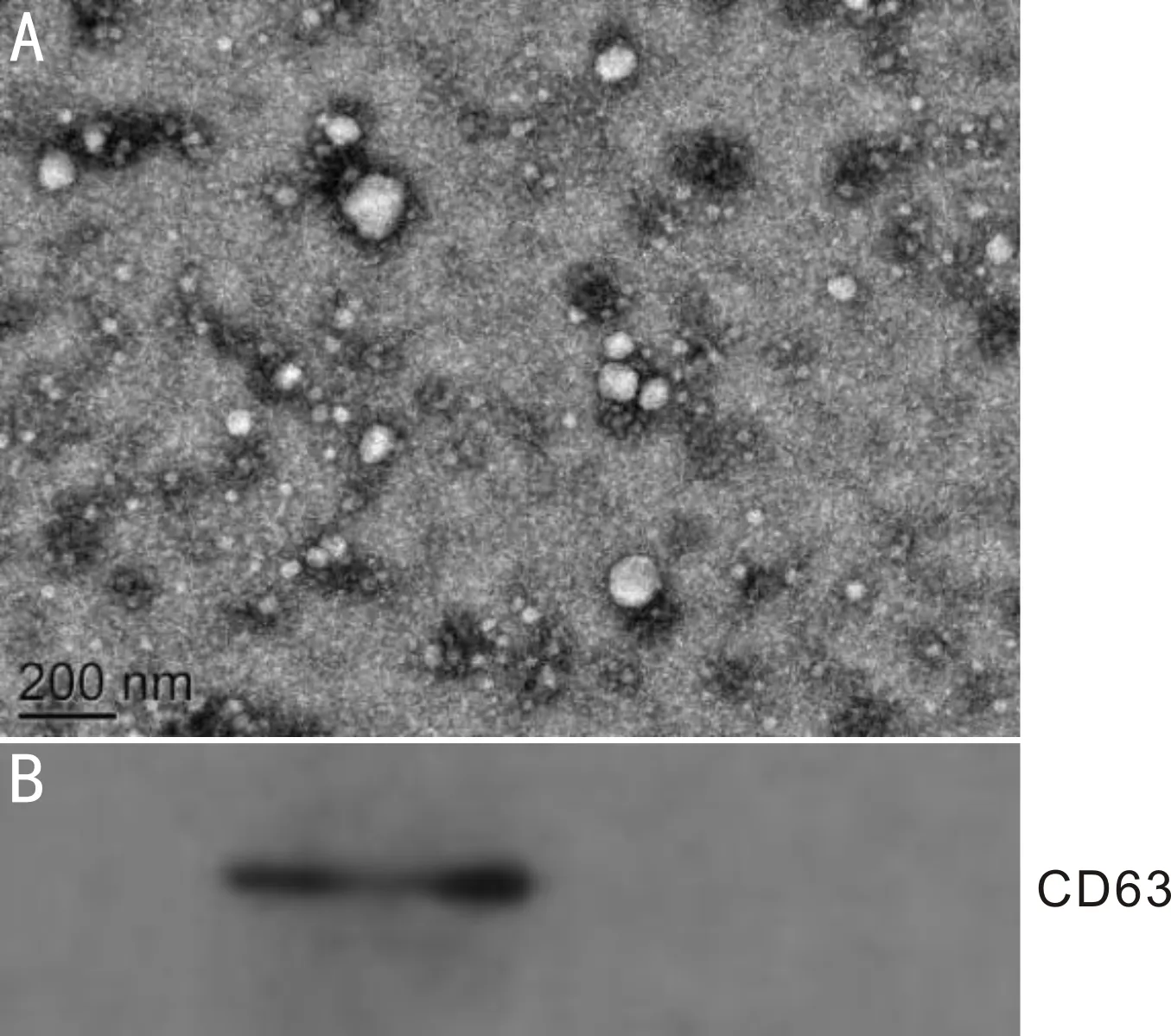
图2 hUMSC外泌体形态及鉴定 A:透射电可见hUMSC外泌体为球状或椭球状膜性囊泡,直径约30~100nm;B:Western blot检测hUMSC外泌体表面标志蛋白CD63。
2.3细胞中自噬体超微结构的观察透射电子显微镜下可见典型的自噬体为包裹了蛋白质及细胞器等吞噬物的小囊泡,具备双层膜结构。电镜检查显著反映了高糖环境及hUMSC外泌体对ARPE-19细胞自噬活性的影响,对照组细胞中仅见少量自噬体,高糖组及外泌体+高糖组细胞中自噬体数量明显增多,而外泌体+高糖组细胞中自噬体数量较高糖组减少(图3)。

图3 透射电子显微镜下观察各组ARPE-19细胞内自噬体形成 A:对照组;B高糖组;C:外泌体+高糖组。
2.4 hUMSC外泌体对高糖条件下ARPE-19细胞增殖的影响MTT法检测结果显示,各组ARPE-19细胞增殖率的总体比较差异有统计学意义(表1)。与对照组相比,高糖组和外泌体+高糖组细胞增殖率降低,差异均有统计学意义(P<0.01),外泌体+高糖组细胞增殖率高于高糖组,差异有统计学意义(P<0.01)。

表1 hUMSC外泌体对高糖条件下ARPE-19细胞增殖、LC3B-Ⅱ/Ⅰ、Beclin-1、p62蛋白相对表达量及VEGF的影响
2.5 hUMSC外泌体对ARPE-19细胞在高糖条件下LC3B-Ⅱ/Ⅰ值和Beclin-1及p62蛋白相对表达量的影响蛋白免疫印迹法检测结果显示,高糖组ARPE-19细胞的LC3B-Ⅱ/Ⅰ比值和Beclin-1蛋白条带明显增强,p62蛋白表达降低,自噬活性较对照组明显升高。加入hUMSC外泌体预处理后,LC3B-Ⅱ/Ⅰ值及Beclin-1的蛋白表达减弱,p62的表达明显增强(图4)。

图4 各组细胞中LC3B、Beclin-1和p62蛋白电泳图 A:对照组;B高糖组;C:外泌体+高糖组。
对照组、高糖组、外泌体+高糖组ARPE-19细胞的LC3B-Ⅱ/Ⅰ值、Beclin-1和p62的相对蛋白表达量的组间总体比较差异均有统计学意义(P<0.01,表1)。组间比较显示,对照组和外泌体+高糖组细胞中LC3B-Ⅱ/Ⅰ值和Beclin-1的相对蛋白表达相较于高糖组显著减少,差异均有统计学意义(均P<0.05),外泌体+高糖组的LC3B-Ⅱ/Ⅰ值与对照组差异无统计学意义(P=0.055),外泌体+高糖组Beclin-1的相对蛋白表达相较于对照组有所升高,差异有统计学意义(P<0.01)。对照组和外泌体+高糖组细胞中p62的相对蛋白表达相较于高糖组显著升高,差异均有统计学意义(均P<0.01),外泌体+高糖组中p62的相对蛋白表达相较于对照组降低,差异有统计学意义(P<0.01)。
2.6 hUMSC外泌体对高糖条件下ARPE-19细胞上清液中VEGF蛋白表达量的影响酶联免疫吸附试验显示,对照组、高糖组、外泌体+高糖组ARPE-19细胞上清液中VEGF的质量浓度的整体比较差异有统计学意义(P<0.01,表1)。相较于对照组和外泌体+高糖组,高糖组VEGF的质量浓度明显升高,差异有统计学意义(均P<0.01),外泌体+高糖组细胞VEGF质量浓度低于高糖组,差异有统计学意义(P<0.01)。
3讨论
绝大部分细胞都会向细胞外环境中释放外泌体,外泌体在远距离细胞间的相互作用中发挥了重要作用,是细胞间相互交流的一种媒介,蛋白质是外泌体携带的常见成分,因此可以作为特异性标记物,在外泌体提取过程中用于鉴定和定量[19-20]。hUMSC有促进组织修复、调节免疫反应、抑制炎症等作用[21]。既往多项研究表明MSCs外泌体的功能和活性与其亲代细胞相似,与间充质干细胞相比,MSCs外泌体体积小、无免疫原性而且更加稳定,具有治疗多种疾病的潜能[1]。本研究利用外泌体分离提取试剂盒成功提取了hUMSC外泌体,并通过透射电镜观察其形态和超微结构,鉴定了外泌体特异性标志物CD63,多种方法验证了外泌体提取结果的可靠性。
RPE层位于视网膜的最外层,为单层色素细胞,主要功能包括:维持光感受器的新陈代谢、吸收光线、抗氧化、为视网膜外层提供营养、参与视觉循环和分泌细胞因子等,对维持视网膜光感受器微环境有重要作用。长期处于高血糖环境会诱发RPE细胞出现缺血、氧化应激、炎症激活等病理改变,影响其结构和功能[5]。He等[1]模拟年龄相关性黄斑变性,将hUMSC外泌体与蓝光损伤RPE细胞共培养,并向激光诱导视网膜损伤小鼠玻璃体腔内注射不同剂量外泌体,发现hUMSC外泌体显著降低VEGF-A表达,修复蓝光损伤视网膜,保护RPE细胞。本研究通过体外模拟高糖状态,发现高糖处理48h可以造成RPE细胞损伤,明显降低其增殖率,导致细胞活力下降。hUMSC外泌体干预可使细胞的增值率升高,对高糖环境下的RPE细胞有显著的保护作用。
自噬存在于生理状态下的细胞中,自噬水平维持在一定范围内对细胞的代谢、增殖、生长、分化、修复以及活性的维持都起到重要作用[8,22]。在自噬这一动态过程的不同阶段中,相关特异性基因编码的LC3,Beclin-1和p62等20多种蛋白相互协同作用。LC3在主导自噬小体的双膜延伸过程时,胞浆中的LC3-Ⅰ与磷脂酰乙醇胺偶联生成位于自噬小体膜上的脂质型LC3-Ⅱ,可以通过检测LC3-Ⅱ与LC3-Ⅰ的转化比例评估自噬的水平[23],LC3存在多种不同类型,目前自噬的蛋白标记物常选用LC3B。绝大多数自噬相关蛋白在参与自噬小体的形成中均需要Beclin-1辅助[24],因此Beclin-1蛋白表达量也是检测自噬水平的常用标记物。p62是自噬溶酶体膜相关标记蛋白,其表达与自噬水平负相关,在自噬过程中主要介导底物识别,因此当自噬反应激活清除细胞内的蛋白质时会被优先降解,从而导致其表达水平降低[25]。本研究采用蛋白免疫印迹法检测LC3B的切割情况、Beclin-1的蛋白相对表达量及p62的降解程度,三项结果共同检测RPE细胞的自噬水平。目前认为检测自噬情况的金标准是电子显微镜观察到自噬小体的特征性双层膜结构[23],但在自噬发生的不同动态阶段中,会产生与自噬小体形态类似的自噬溶酶体和自噬内涵体,在未做特殊标记的情况下,很难准确区分这些结构。此外在不同切面的切片中观察到的自噬小体数量差别较大,会导致电镜检测结果产生误差。因此本文根据自噬标志性蛋白检测和电镜观察两种结果,综合分析细胞内的自噬水平,确保实验结果的准确性和可靠性。已有的研究结果显示,高糖条件会上调视网膜自噬水平,进而诱导DR的发生[12]。Lopes等[11]在体外高糖环境下培养视网膜Müller细胞,并检测p62蛋白的降解情况,发现高糖会增强Müller细胞的自噬反应,诱导其大量释放VEGF。本研究证实,高糖环境下RPE细胞的自噬被激活,表现为自噬体增加,LC3B-Ⅱ/Ⅰ,Beclin-1蛋白表达增加,而p62表达下降。用75μg/mLhUMSC外泌体预处理后,自噬体减少,细胞表达LC3B-Ⅱ/Ⅰ,Beclin-1蛋白下降,p62水平增加。
视网膜新生血管是糖尿病视网膜病变晚期的典型病理性改变,在参与糖尿病新生血管生成的众多细胞因子中,VEGF是其中具有高度特异性的血管内皮细胞促有丝分裂素,可以破坏血-视网膜屏障,引起组织缺氧、毛细血管闭塞及微血栓形成,导致渗出、出血以及水肿。还可以增加血管通透性,促进血管内皮细胞分裂增殖,诱导血管生成[6-7]。同时视网膜血管内皮细胞在高糖环境诱导下VEGF受体增多、与VEGF亲和力增强,进一步提高了VEGF与受体的结合率,促使血管内皮细胞增殖[26]。我们的研究结果显示,高糖会导致REP细胞表达VEGF明显增加,hUMSC外泌体有效降低VEGF水平,与既往研究结果一致[1]。
综上所述,本研究提示高糖环境下RPE细胞自噬被激活,hUMSC外泌体可有效抑制高糖环境下ARPE-19细胞自噬水平,促进细胞增殖,并下调VEGF的表达,对RPE细胞起到保护作用。本研究为外泌体的应用提供了新的思路,外泌体作为能在细胞间起到调控作用的囊泡结构,可能在糖尿病视网膜病变治疗中起到重要作用。但目前所有的外泌体提取方法均有不足之处,获得的外泌体中包含不同的干扰成分,造成提取物不同质问题[27]。hUMSC外泌体在体内对自噬水平的影响及安全性还需通过动物试验来明确。另外,hUMSC外泌体在抑制高糖环境下ARPE-19细胞自噬,下调VEGF表达的过程中,发挥作用的具体成分,通过的机制及激活的信号通路均需要进一步更深入的研究和验证。
