急性原发性闭角型青光眼视网膜血流密度与神经纤维层的相关性
2021-05-10梁换换韩佳欣郭建新
梁换换,王 贺,韩佳欣,郭建新
0引言
青光眼是全球第二类不可逆致盲性眼病,据统计,2013年青光眼人数约为6430万人,到2020年预计增加到7600万人,而在2040年预计达到1.1亿人[1]。急性原发性闭角型青光眼(acute primary angle-closure glaucoma,APACG)是指由于急性前房角关闭导致眼压急剧上升,视网膜神经节细胞(retinal ganglion cells,RGCs)是受损的主要靶细胞,高眼压状态下压迫视神经致其损伤[2]。由于该病发作紧急,患者不适感明显,往往可以得到及时诊断和治疗。然而经过恰当治疗后一段时间内随访眼压控制稳定范围时仍出现神经纤维层的变薄甚至青光眼性视神经损害[3-5]。除眼部机械压力外,有证据表明眼底血管功能不全在青光眼中也起着重要作用[6-7],青光眼性视网膜血管损害已经引起眼科医师越来越多的关注[8]。随着眼科技术的不断进展,光学相干断层扫描血管成像(oraphyptical coherence tomography angiography,OCTA)技术逐渐应用于临床,为视神经损伤机制的研究提供了更多更准确的依据,该检查多用于原发性开角型青光眼(primary open angle glaucoma,POAG)诊断,对APACG研究多集中于视盘周围血流密度(circumpapillary vessel density,cpVD),黄斑血流密度(macular vessel density,MVD)研究较少[9],而50%的RGCs存在于黄斑区。因此,本研究旨在使用OCTA对APACG患者不同时间点视盘及黄斑各象限血流密度、神经纤维层(retinal nerve fibre layer,RNFL)厚度、杯盘比(cup to disk ratio,C/D)、黄斑中心凹无血管区面积(foveal avascular zone,FAZ)等进行分析比较,并对APACG视神经进行性损伤机制中可能存在的血流因素进行探讨。
1对象和方法
1.1对象前瞻性研究。选取2019-03-01/12-31在徐州医科大学附属医院就诊的APACG患者30例,其中男5例,女25例,年龄50~80(平均64.414±8.740)岁,平均病程3.27±2.44d。纳入标准:(1)单眼发作的APACG患者,患眼眼压>20mmHg;(2)房角镜检查患眼周边房角黏连范围>180°;(3)经治疗后6mo内双眼眼压<21mmHg或加用药物后眼压<21mmHg。排除标准:(1)继发性青光眼如晶状体源性青光眼、虹膜睫膜炎继发青光眼、新生血管性青光眼等;(2)既往类似发作史、慢性闭角型青光眼、开角型青光眼、先天性或发育性青光眼、眼内疾病史、眼部外伤史、眼部手术史,全身病史如高血压、糖尿病、心脑血管病等影响视网膜血流检测结果的患者;(3)球镜度数>±6.00D和(或)散光度数>3.00D;(4)单眼低视力或盲、合并白内障等屈光间质混浊致无法获取完整清晰有效图像者;(5)固视不佳、不能配合或拒绝检查、失访等患者。本研究以APACG发作眼为试验组,同一患者对侧眼为对照组。本研究取得所有参与者书面知情同意并严格遵循《赫尔辛基宣言》,研究通过徐州医科大学附属医院伦理委员会批准(批准号:XYFY2020-KL102-01),并于中国临床试验注册中心注册(注册号:ChiCTR2000035298)。
1.2方法
1.2.1手术方法所有患者APACG发作眼均行复合式小梁切除术,对侧眼均行预防性虹膜周边激光切除术。复合式小梁切除术:予表面麻醉联合球结膜下局部浸润麻醉,制作结膜瓣和巩膜瓣(约1/2巩膜厚度,大小约3mm×4mm),热灼止血,球结膜下置入含氟尿嘧啶的棉片约2min后取出并用生理盐水冲洗,切除部分小梁组织及周边虹膜,尼龙缝线缝合并调节巩膜瓣松紧度,巩膜瓣用调节缝线固定。虹膜周边激光切除术:予表面麻醉,结膜囊放置前置镜,以532nm激光(50~100μm、280~300mW、0.1s)及YAG激光(8.1mJ)联合切除鼻上或颞上方虹膜。手术均由同一名经验丰富的眼科医生完成。
1.2.2观察指标记录患者术前和术后6mo最佳矫正视力(BCVA,以LogMAR视力表示)、眼压等资料,双眼术前、术后1wk,1、3、6mo均行OCT及OCTA检查,采集cpVD、MVD、RNFL厚度、FAZ、C/D等数据进行分析。OCTA检查使用RTVue-XR光谱域OCT对视盘和黄斑区域进行扫描成像,检查在正常瞳孔下进行,嘱被检查者取坐位,被检查眼注视仪器内固视光标。排除信号质量差、运动伪影、分割错误、眼部病理伪影或毛细血管周围缺失的图像[10]。视盘扫描区域采用Garway-Heath分区[11](图1),软件自动对以视盘为中心4.5mm×4.5mm范围内从视盘边界向外延伸750μm环形空间的血管密度进行测量,并将该范围内的环形空间以不同角度分为8个部分[12],分别为鼻上(NS)、上鼻(SN)、上颞(ST)、颞上(TS)、颞下(TI)、下颞(IT)、下鼻(IN)、鼻下(NI),分析血流密度和RNFL厚度。黄斑区扫描以黄斑中心凹为中心6mm×6mm区域内连续扫描,黄斑扫描区域采用ETDRS分区(图1),由3个同心圆组成,直径分别为1、3、6mm。目前国内对黄斑范围界定尚无统一标准,本研究采用吕沛霖等[13]黄斑分区方法,黄斑中心区(1mm内)代表中心凹范围,内环区(1~3mm)代表旁中心凹范围,外环区(3~6mm)代表中心凹周围区域,并且分为上、下、鼻、颞4个象限,包含8个象限的平均血流密度。cpVD采集从内界膜(internal limiting membrane,ILM)到RNFL的血流成像。MVD采集浅层毛细血管丛,即从内界膜(ILM)到内丛状层(inner plexiform layer,IPL)之间的血流成像。所有眼部检查均由同一名经验丰富的眼科技师完成。

图1 黄斑和视盘OCTA扫描分区情况 A:黄斑;B:视盘。

2结果
2.1两组手术前后基本情况比较随访期间1例患者术后1mo时滤过泡形成不良,眼压>21mmHg,需行二次手术故排除,最终纳入患者29例。试验组术前视力(LogMAR)为1.448±0.958,明显低于对照组(P<0.001),眼压控制后6mo时视力为0.403±0.161,较术前明显改善(P<0.05);术前眼压(55.272±16.883mmHg)显著高于对照组(P<0.001),术后眼压控制在正常范围内,较术前明显降低(P<0.05);FAZ在术后1wk(0.352±0.110mm2)时较术前(0.381±0.104mm2)明显降低(t=3.758,P=0.001),但手术前后两组C/D未见明显差异(均P>0.05),见表1。

表1 两组手术前后基本情况比较
2.2两组视盘cpVD及RNFL厚度比较手术前后两组各象限视盘cpVD比较均具有时间差异性和组间差异性(P<0.01),见表2、3。术前,试验组上颞、颞上象限视盘cpVD低于对照组(均P<0.01);术后1wk,试验组上鼻、上颞、颞上象限视盘cpVD低于对照组(均P<0.05);术后1mo,试验组鼻上、上鼻、上颞、颞上、下颞、鼻下象限视盘cpVD低于对照组(均P<0.05);术后3mo时,除颞下象限外,试验组其余象限视盘cpVD均低于对照组(P<0.05);术后6mo,试验组各象限视盘cpVD均低于对照组(均P<0.05)。试验组术后6mo时上鼻、上颞、下颞、下鼻象限视盘cpVD较术前下降幅度较大;对照组手术前后各象限视盘cpVD差异均无统计学意义(P>0.05)。两组手术前后不同时间视盘cpVD均值随时间变化趋势见图2A,OCTA检查情况见图3。
表2 两组手术前后视盘cpVD比较

表3 两组手术前后视盘cpVD比较重复测量方差分析结果
手术前后两组各象限RNFL厚度比较时间差异性和组间差异性见表4、5。试验组术后6mo时上鼻、下颞、下鼻象限RNFL厚度较术前下降幅度较大,与cpVD变化趋势基本一致。对照组手术前后各象限RNFL厚度差异均无统计学意义(P>0.05)。两组手术前后不同时间RNFL厚度均值随时间变化趋势见图2B,OCTA检查情况见图3。
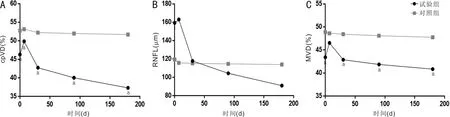
图2 两组手术前后不同时间各观察指标变化趋势 A:cpVD均值;B:RNFL厚度均值;C:MVD均值。aP<0.05 vs同时间点对照组。

表4 两组手术前后RNFL厚度比较

表5 两组手术前后RNFL厚度比较重复测量方差分析结果
2.3两组手术前后MVD比较手术前后两组各象限MVD比较均具有时间差异性(除内环鼻象限)和组间差异性(均P<0.01),见表6、7。术前,试验组各象限MVD均低于对照组(均P<0.05);术后1wk,试验组外环下象限MVD低于对照组(P<0.05);术后1、3、6mo,试验组各象限MVD均低于对照组(均P<0.05)。两组手术前后不同时间MVD均值随时间变化趋势见图2C,OCTA检查情况见图3。

图3 两组术前和术后6mo时cpVD、MVD、RNFL、黄斑区视网膜厚度OCTA检查情况。

表6 两组手术前后MVD比较

表7 MVD重复测量方差分析结果
2.4试验组视盘cpVD与RNFL厚度的相关性分析Pearson相关性分析显示,试验组术后6mo时视盘cpVD和RNFL厚度在上鼻、上颞、颞下、下颞、下鼻、鼻下象限存在正相关关系(均P<0.05),见表8;试验组术后6mo时视盘cpVD与发作时眼压呈负相关性(r=-0.593,P<0.001),与患者年龄、病程未见明显相关性(r年龄=-0.184,P年龄=0.166;r病程=-0.243,P病程=0.066)。

表8 试验组术后6mo视盘cpVD和RNFL厚度的相关性
3讨论
由于青光眼视神经损伤不可逆,目前对该病辅助检查的发展方向着重于早期诊断,早期治疗。视野检查一直作为观测视神经变化的金标准。研究证实,青光眼患者视神经结构性损害早于视野缺损,视野损害多出现RGCs的丢失超过30%~50%以上时,具有滞后性。随着眼科检测技术的发展,光学相干断层扫描技术在眼科的广泛应用,可以直观观察视神经损害程度。特别是近年出现的OCTA技术,可以无创检测视网膜微血管的形态,并可进行定性和定量分析,相对于荧光素血管造影技术具有无创、低风险、易操作、受检者易接受等优势,在青光眼的诊疗过程中逐渐被广泛应用[14]。
本研究中,术后6mo时,不仅cpVD、RNFL厚度均值均显著低于对照组,MVD也明显低于对照组,该结论与Zhang等[15]和Moghimi等[7]研究结果一致,表明APACG大发作可以导致其眼底视网膜血管自身调节障碍,且在眼压控制稳定后也未能完全恢复,且APACG发作眼的cpVD随时间推移持续下降,与对应象限RNFL厚度之间存在一定的相关性。其中,cpVD在上鼻、上颞、下颞、下鼻象限血流下降较快,即视盘的颞上和颞下方向,许多学者发现青光眼性视神经病变好发于颞下方区域,可能与颞下方筛板单孔较大及该区域支持性结缔组织较少有关[16]。APACG正常眼压范围内的血流异常可能是由于机械压力造成视网膜血管自身调节异常,或其他因素如缺血-再灌注损伤等。青光眼大发作时眼内压力升高,筛板处跨壁压升高,形成的剪切力阻碍眼底轴浆运输,影响轴突蛋白生成和转运,干扰RGCs正常代谢,使神经纤维坏死、溶解、消失[17]。本研究中,APACG患者眼底视盘及黄斑血管灌注异常,这可能揭示了青光眼相关的血流机制。
原发性闭角型青光眼(primary angle-closure glaucoma,PACG)发作原理与POAG完全不同[18]。PACG除自身特殊解剖结构易导致房角关闭引起急性眼压升高造成视功能损害外,Zhang等[15]随访发现眼压控制稳定后其cpVD、RNFL厚度仍呈持续性下降趋势,与本研究结果大致相同。POAG则是眼压与年龄、种族、心血管疾病、跨筛板压等单纯或共同作用导致RGCs损伤。因此,不同的损害机制对眼底血流密度产生的结果可能也会不同。Jo等[19]报道,眼压升高与cpVD降低的关系仅见于PACG,而不见于POAG。在PACG眼,cpVD与视野平均灵敏度(mean sensitivity,MS)的相关性优于RNFL厚度,提示cpVD可能是评估PACG功能损害的潜在标志物。
本研究中,APACG发作后,眼底视网膜微循环广泛受到影响,其中以视盘周围微循环为著,血流密度明显降低,与Zhang等[15]和Rao等[12]研究结果相似。研究发现,当眼压升高到40~50mmHg时,视网膜灌注将会受到严重影响[20]。在本研究中,发作眼平均眼压为55.272mmHg,因此,初期视网膜血流密度的降低可能是急性发作期高眼压导致的结果。视野的改变多出现在RGCs丢失50%以上时,而RNFL厚度与cpVD存在较强相关性,因此当眼压控制在正常范围内后,RNFL厚度和cpVD的持续下降提示未来可能会引起视神经损伤。利用OCTA监测眼底血流密度变化,同时加用改善视网膜灌注或视神经保护的药物治疗可能会减缓视神经损伤进展[21-22]。
本研究也存在一定局限性:(1)考虑术前高眼压下的角膜水肿可能会对数据的测量产生干扰,患者术前的OCTA检查在药物控制眼压后、角膜情况允许下进行,可能会影响结果准确性;(2)本研究中未考虑到抗青光眼药物对眼底血流密度可能存在的影响,尽管文献中没有使用OCTA评估该方面的研究,曾有文献报道碳酸酐酶抑制剂可以增加眼内血流量[23];(3)由于仪器限制,本研究未对脉络膜血管进行评估。视乳头由视网膜中央动脉(central retinal artery,CRA)系统和源于脉络膜血管的睫状动脉系统供血,以往研究表明青光眼视乳头病变的原发部位主要由源于脉络膜血管的睫状后动脉(posterior ciliary artery,PCA)微循环提供营养[24]。由于仪器限制,本研究以视网膜浅层循环为主,其血管性指标低于正常人,同样具有评估血流因素的作用。关注这些细节将有助于更好地了解青光眼的血流密度变化。
综上,本研究结果表明,APACG急性发作期后早期患眼cpVD及MVD出现短暂回升,之后呈持续性下降趋势;RNFL早期由于水肿而增厚,之后逐渐变薄;cpVD与RNFL之间存在一定的相关性。视盘周围血流密度、黄斑区浅层血流密度在APACG病情评估中具有一定价值,维持视网膜血供对维护APACG患者视功能具有重要意义。
