不同甜瓜自交系类胡萝卜素代谢相关基因表达和糖分积累与代谢相关酶活性变化分析
2021-05-10刁倩楠曹燕燕蒋雪君陈幼源张永平
刁倩楠,曹燕燕,蒋雪君,陈幼源,张永平∗
(1 上海市农业科学院设施园艺研究所,上海市设施园艺技术重点实验室,上海201403;2上海市金山区农业技术推广中心,上海201599)
甜瓜(Cucumis meloL.)为葫芦科甜瓜属一年生蔓性草本植物,风味独特、营养丰富,具有特殊的保健作用,且类型丰富、品种繁多,其果肉根据颜色不同可分为桔红肉、黄肉、白肉、绿肉和绿白肉等,在品质上具有一定差异[1-2]。 类胡萝卜素是广泛存在于自然界的一类脂溶性色素,迄今,已被鉴定的天然类胡萝卜素超过750 种。 类胡萝卜素是构成植物器官颜色的重要色素,甜瓜果肉颜色不同是因类胡萝卜素组成和含量差异所致,桔红色果肉的甜瓜主要含β-胡萝卜素,其是未经环氧化的中间类型和人体维生素A 的前体物质[3]。 在β-胡萝卜素合成途径中,八氢番茄红素合成酶(PSY)是类胡萝卜素合成途径的关键限速酶,牻牛儿基焦磷酸(GGPP)经八氢番茄红素脱氢酶(PDS)、ζ-胡萝卜素脱氢酶(ZDS)催化形成番茄红素,番茄红素由β-胡萝卜素环化酶(LCY-b)催化形成β-胡萝卜素,也可能由其他酶催化生成另外的产物[4-5]。类胡萝卜素加氧裂解酶(CCDS)是参与类胡萝卜素分解代谢的一大类酶,拟南芥CCD1 基因缺陷型种子的类胡萝卜素含量增加,说明CCD1 蛋白可以催化类胡萝卜素的裂解[6-7]。 目前已经从番茄[8]、脐橙[9]和木薯[7]中分离获得类胡萝卜素合成代谢酶基因,这些酶基因的表达水平对类胡萝卜素的积累有重要作用。糖是类胡萝卜素等成分合成的重要基础原料,果实糖积累是品质形成的关键因子,其中糖的组分及含量对果实的风味和色泽有着重要影响[10]。 甜瓜果实中主要包含果糖、葡萄糖和蔗糖,果糖的甜度高,葡萄糖的风味好,在果实成熟期蔗糖含量占总糖含量的70%以上,蔗糖含量决定着甜瓜品质的优劣[11]。 不同类型和不同发育时期的甜瓜果实中糖分的积累规律存在一定差别,网纹甜瓜果实初期葡萄糖和果糖的含量较高,蔗糖含量极低,高蔗糖积累型果实蔗糖的快速积累是在果实发育的中后期[12]。 蔗糖代谢是果实中糖积累的重要环节,参与蔗糖代谢的酶主要有蔗糖磷酸合成酶(SPS)、蔗糖合成酶(SS)、酸性转化酶(AI)和中性转化酶(NI)[13-14]。 研究表明:‘河套蜜瓜’在果实成熟期蔗糖代谢转为合成方向为主,SS 和SPS 在蔗糖积累中起主导作用[15],而‘楼兰王’果实中蔗糖积累的主要原因是SPS 活性升高[16]。 李响等[17]和乔永旭等[18]研究表明:不同甜瓜品种在果实生长发育期内与其糖分合成相关酶的种类及活性变化趋势均不相同,主要原因可能与甜瓜品种之间果实糖分积累快慢及参与蔗糖代谢酶活性变化存在基因型差异有关。 本研究以6 个不同果肉颜色的甜瓜自交系为试验材料,研究其果实发育过程中和品质相关的类胡萝卜含量与其合成途径密切相关的酶基因表达、糖分积累及相关酶代谢的变化,探讨导致不同甜瓜自交系间糖和类胡萝卜素含量差异的原因,以期为今后甜瓜果实品质改良育种及相关物质合成的机理研究提供参考。
1 材料与方法
1.1 试验材料
供试材料为上海市农业科学院设施园艺研究所培育的自交系156、 B-3-1-1、wm-6、12B-5-2、162 和159,果实熟期均为40 d 左右,果肉颜色如图1。
1.2 试验方法

图1 6 种不同果肉颜色的甜瓜自交系Fig.1 Six melon inbred lines with different flesh color
2019 年2 月20 日,将饱满、整齐一致的种子播于装有西甜瓜专用育苗基质的50 孔穴盘中,3 月15 日,当甜瓜幼苗长到2 叶1 心时定植于上海市农业科学院示范基地大棚中,棚长36 m、宽8 m,采用单蔓立架栽培,在12—14 节位进行人工授粉,每株选留1 瓜,分别于授粉后10 d、25 d 和40 d(成熟期)3 个发育时期取样。 每个时期随机选择3 个果实采收,取果实赤道厚度约为2 cm 的果肉,样品混合后储存于-80 ℃冰箱备用,用于相关指标测定。
1.3 指标测定
1.3.1 类胡萝卜素和β-胡萝卜素的提取及含量测定
类胡萝卜素的提取和测定参照周莉[19]的方法。 称取1 g 左右甜瓜果肉,用液氮研磨后加入10 mL 有机溶剂(正己烷体积∶丙酮体积∶无水乙醇体积=2∶1∶1)进行提取,超声波充分震荡直至提取液为无色,吸取上层溶液于新的离心管中,5 000 r∕min 低温冷冻离心10 min,再次吸取上清液,密封避光4 ℃保存备用。 采用分光光度法,在450 nm 波长下测定吸光度,每个样品重复3 次。
β-胡萝卜素的提取参照吕丽华[20]的方法。β-胡萝卜素含量分析采用高效液相色谱法(HPLC),液相色谱分析条件:色谱柱C18(4.6 nm×250 mm,5 μm);流动相乙酸乙酯,90%乙腈水溶液;在方法组中设置进样量10 μL,流速1 mL∕min,检测波长450 nm,柱温35 ℃,走样时间为30 min,设置完毕保存方法组;用流动相过柱子,待基线稳定后进样10 μL,在相应保留时间处检测峰面积。
1.3.2 目的基因荧光定量分析
甜瓜果肉总RNA 采用TaKaRa 公司的Total RNA 提取试剂盒提取,之后反转录成cDNA 备用。 引物(表1)的设计基于NCBI 数据库获得的mRNA 序列,委托上海捷瑞生物工程有限公司合成。 依据试剂盒(SuperReal PreMix SYBR Green)说明书要求确定实时荧光定量反应体系总体积为10 μL,其中包含2 ×ChamQ SYBR qPCR MasterMix 5 μL、正向引物0.2 μL、反向引物0.2 μL、cDNA 1 μL、无菌水3.6 μL。 反应热启动模式:95 ℃孵育30 s,然后95 ℃10 s,40 个循环,再60 ℃30 s,绘制溶解曲线。 以自交系156的表达量为1,用LightCycle®480 ⅡReal-time PCR 仪(Roche,瑞士)进行分析,分析目的基因在不同处理样品中的相对表达量,以GAPDH作为内参基因。 将结果(2-ΔΔCt)转化成线性关系,进行统计学分析。

表1 试验所用引物Table 1 Primers used in the experiment
1.3.3 糖组分和含量的测定
糖组分的提取参照张宁等[21]的方法,略有改动。 称取0.2 g 果肉,加入1 mL 提取液,研磨后转移到离心管中,在80 ℃水浴锅中10 min,振荡3—5 次,冷却后4 000 r∕min 离心10 min,取上清液80 ℃脱色30 min,再加入1 mL 提取液,4 000 r∕min 离心10 min,取上清液测定糖组分。 葡萄糖、果糖、蔗糖含量采用高效液相色谱法测定,色谱条件:NH4柱,柱温25 ℃,流动相(乙腈体积∕重蒸水体积=70∕30),流速为1 mL∕min,时间为30 min,加入样品10 μL,在相应保留时间处检测峰面积。
1.3.4 糖代谢相关酶的提取和测定
蔗糖磷酸合成酶(SPS)、蔗糖合成酶(SS)、中性转化酶(NI)和酸性转化酶(AI)的提取参照齐红岩等[22]的方法;酶活性测定参照乔永旭等[18]方法,通过生成的糖含量来计算酶活性。
1.4 数据统计分析
采用Excel 2010 进行数据处理;采用SPSS 统计软件对平均数用Duncan 新复极差法进行多重比较;采用Origin 软件绘图。
2 结果与分析
2.1 甜瓜果实发育过程中β-胡萝卜素和类胡萝卜素含量的变化
从图2 可以看出,随着果实发育时期的延长,自交系156 和12B-5-2 果实中β-胡萝卜素和类胡萝卜素含量呈先升高后降低的趋势,自交系B-3-1-1 呈升高的趋势,自交系162 和159 呈降低的趋势,且3 个时期差异显著,wm-6 在授粉后25 d 和40 d 差异不明显;在不同发育期,不同自交系果实中β-胡萝卜素和类胡萝卜素含量有所区别,162 在3 个不同发育时期两种物质含量均最低,在授粉后40 d 时含量分别为0.14 μg∕g和0.30 μg∕g,wm-6 含量最高,分别为21.61 μg∕g 和25.09 μg∕g。
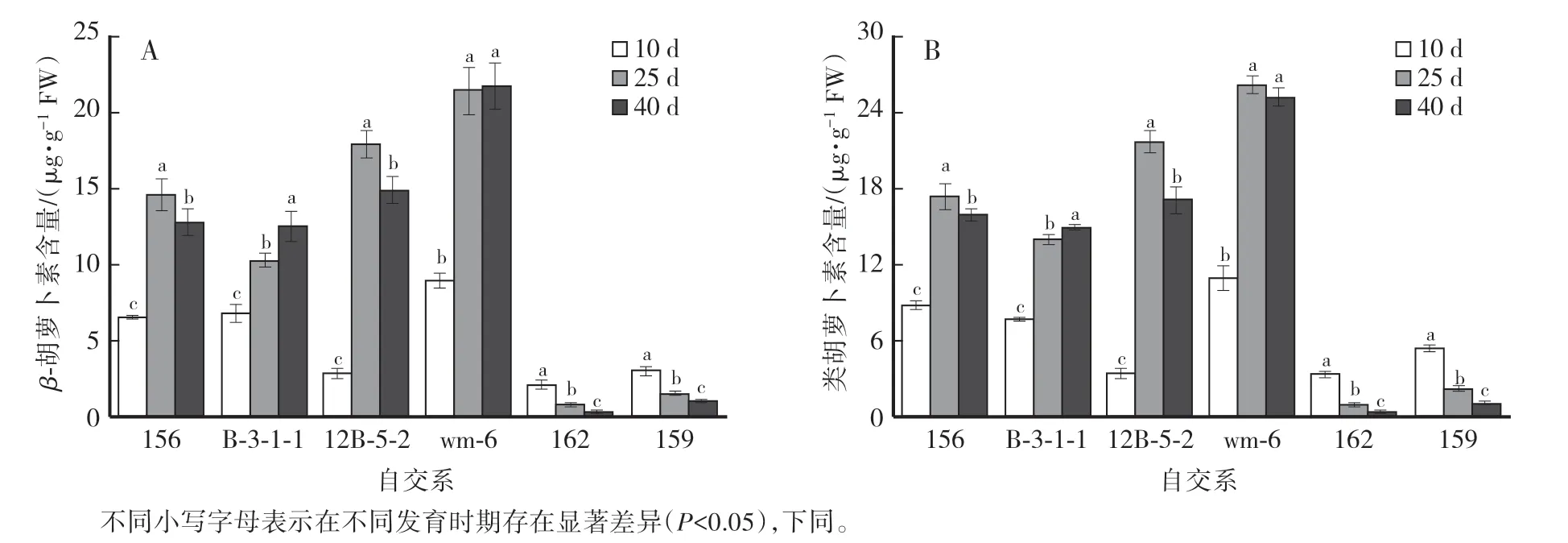
图2 甜瓜果实发育过程中β-胡萝卜素和类胡萝卜素含量的变化Fig.2 Changes of β-carotene content and carotenoid content during melon fruit development
2.2 甜瓜果实发育过程中类胡萝卜相关基因相对表达量的变化
由图3 可以看出,6 个甜瓜自交系中PSY1 和CCD1 基因相对表达量变化趋势基本一致,随着发育时期的延长逐渐降低,各个时期差异显著。 不同自交系有一定区别,PSY1 基因相对表达量在授粉后10 d 时最高的wm-6 是最低的162 的4.8 倍,授粉后40 d 时为5.4 倍;PSY2、ZDS和LCY-b基因相对表达量变化趋势基本一致,B-3-1-1、wm-6 和12B-5-2 3 个自交系随着果实的发育其相对表达量逐渐升高,162 和159则逐渐降低,其中在授粉后40 d 时3 个基因的相对表达量依次为wm-6 >12B-5-2 >159 >162,最高的wm-6分别是最低的162 的12.3 倍、21.7 倍和7.3 倍。
2.3 甜瓜果实发育过程中糖含量的变化
由图4A 可以看出,156、 B-3-1-1、 wm-6 和12B-5-2 4 个自交系果实的葡萄糖含量变化趋势基本一致,随着果实发育均呈现先升高后降低的变化趋势,同一个自交系在不同的果实发育时期差异显著(162 和159 从授粉后25 d 到40 d 变化不显著除外);在不同的果实发育时期,不同自交系葡萄糖含量有所区别,在授粉后10 d 时为wm-6 >12B-5-2 >159 >156 >162 >B-3-1-1,在授粉后25 d 时为12B-5-2 >B-3-1-1 >wm-6 >156 >159 >162,在40 d 时葡萄糖含量最高的wm-6 是最低的B-3-1-1 的1.5 倍。

图3 甜瓜果实发育过程中类胡萝卜素代谢途径相关基因的表达分析Fig.3 Analysis of carotenoid metabolic pathway related genes expression during melon fruit development
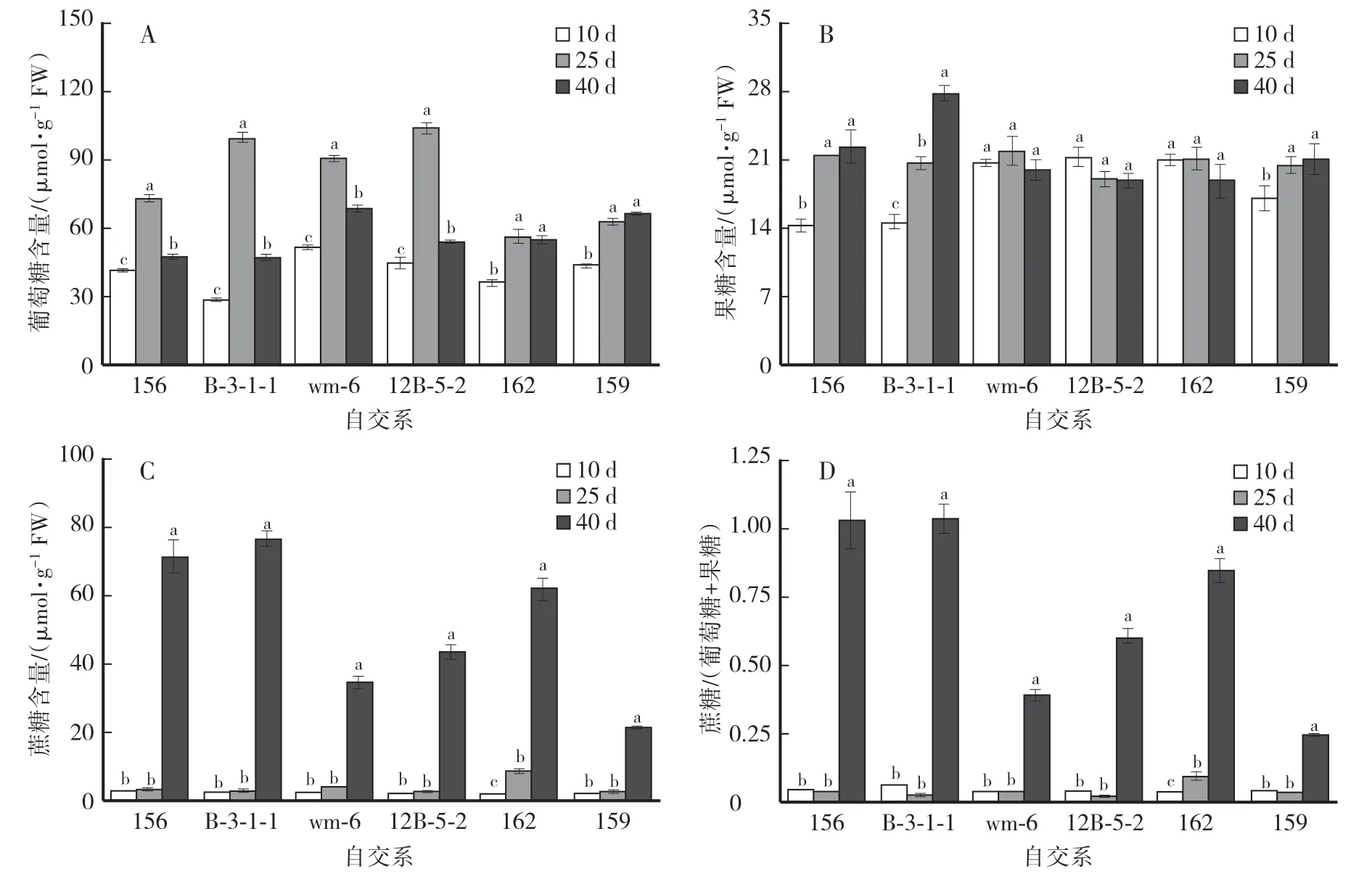
图4 甜瓜果实发育过程中葡萄糖、果糖和蔗糖含量的变化Fig.4 Changes of sucrose content,fructose content and glucose content during melon fruit development
如图4B 所示,wm-6、12B-5-2 和162 甜瓜自交系在果实不同发育时期果糖含量几乎没有变化,156、B-3-1-1和159 随着果实发育时期的延长果糖含量一直上升,其中B-3-1-1 在不同时期差异显著,156 和159 在授粉后25 d 和40 d 变化不明显。 在授粉后10 d 时,果糖含量最高的12B-5-2 比最低的156 高48.8%,其余4 个自交系比较接近;在授粉后25 d 时,6 个甜瓜自交系的果糖含量在18.82—21.76 μmol∕g;在40 d 时除了B-3-1-1 外,其余5 个自交系比较接近。
由图4C 可知,不同果实发育时期的蔗糖含量,除162 外其他5 个自交系变化趋势基本一致,在授粉后10—25 d 时蔗糖含量维持在极低水平,差异不显著;40 d 时蔗糖含量迅速增加,但不同自交系有一定区别,表现为B-3-1-1 >156 >162 >12B-5-2 >wm-6 >159,B-3-1-1 果实蔗糖含量最高(76.31 μmol∕g),是含量最低的159 的3.6 倍。
不同果实发育时期的蔗糖与(葡萄糖+果糖)[S∕(G +F)]的比值变化趋势与蔗糖含量变化一致(图4D),在授粉后10—25 d,S∕(G+F)维持在极低水平,均在0.04 以下(162 果实授粉后25 d 除外),40 d 时因蔗糖含量迅速增加,S∕(G+F)比值也增加,但不同自交系有一定区别,B-3-1-1 和156 的比值超过1,159的比值只有0.27。
2.4 甜瓜果实发育过程中蔗糖相关酶活性的变化
由图5A 可以看出,不同果实发育时期156、12B-5-2 和159 的SPS 活性变化趋势基本一致,授粉后10—25 d,SPS 活性较低且变化不明显,40 d 时显著增加;B-3-1-1 和wm-6 随着果实发育时期的延长呈一直上升的趋势,且不同时期差异显著,162 在授粉后10—25 d 显著升高,40 d 时变化不明显。 在授粉后40 d 时,6 个自交系SPS 活性有一定区别,表现为12B-5-2 >B-3-1-1 >156 >159 >wm-6 >162,SPS 活性最高的12B-5-2 是最低的162 的7.83 倍。
由图5B 可知,不同果实发育时期的SS 变化趋势与蔗糖含量一致,授粉后10—25 d,SS 活性维持在较低水平,差异不显著(162 除外),40 d 时SS 活性迅速增加,但不同自交系SS 活性有一定区别,表现为12B-5-2 >B-3-1-1 >156 >162 >wm-6 >159,12B-5-2 果实中SS 活性最高(725.52 μg∕g),是活性最低的159的4.3 倍。
不同果实发育时期的AI 活性变化趋势与SS 相反(图5C),除12B-5-2 随着果实的发育其先升高后降低外,其余5 个自交系AI 活性均呈降低趋势,且156、 B-3-1-1 和162 在不同发育时期差异显著,162 在3个时期AI 活性一直低于其他自交系。
由图5D 可以看出,不同果实发育时期的NI 活性变化趋势基本一致,除162 在3 个时期几乎没有变化外,其余5 个自交系的NI 活性随着果实的发育均呈先升高后降低的趋势,且156、B-3-1-1 和159 在不同发育时期差异显著。
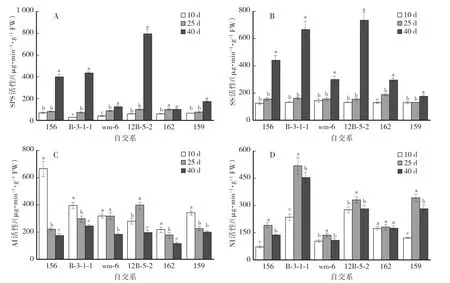
图5 甜瓜果实发育过程中蔗糖代谢相关酶活性的变化Fig.5 Changes of enzyme activities related to sucrose metabolism during melon fruit development
2.5 甜瓜果实发育过程中蔗糖含量变化与蔗糖代谢相关酶活性的关系
由表2 可知,6 个甜瓜自交系果实发育期间蔗糖含量与SPS 和SS 活性均呈正相关,且均达到极显著水平(除了162 的SPS 活性);其蔗糖含量与AI 活性呈负相关,其中wm-6 和162 达到极显著水平,B-3-1-1和12B-5-2 为显著水平,156 和159 相关性不显著;156、B-3-1-1 和159 的蔗糖含量与NI 活性呈正相关,其他3 个自交系呈负相关,相关性均不显著。 进一步分析发现,(SPS+SS)活性与6 个甜瓜自交系的蔗糖含量均呈正相关,且均达到极显著水平;(AI +NI)活性与6 个甜瓜自交系的蔗糖含量均呈负相关,其中与wm-6 和162 相关性达极显著水平,与156 和12B-5-2 相关性达显著水平,与B-3-1-1 和159 相关性不显著。 此外,6 个甜瓜自交系果实的蔗糖含量与蔗糖代谢相关酶的净活性(SPS +SS -AI -NI)均呈极显著正相关。

表2 甜瓜果实发育过程中蔗糖含量与蔗糖代谢相关酶活性的相关性分析Table 2 Correlation analysis of sucrose content and sucrose metabolism related enzyme activities during melon fruit development
3 讨论
甜瓜果实在整个生长发育过程中,类胡萝卜素和β-胡萝卜素含量会发生变化,果肉桔红色的甜瓜果实中类胡萝卜素含量较高,果肉绿色居中,果肉白色极少[23-24]。 本试验通过测定6 个不同甜瓜自交系果实在生长发育过程中β-胡萝卜素和类胡萝卜素含量的变化发现,成熟期时果肉为桔红色的自交系wm-6含量最高,分别为21.61 μg∕g 和25.09 μg∕g,果肉白色的162 含量极低,分别为0.14 μg∕g 和0.30 μg∕g。此外,果肉颜色相似的自交系wm-6、12B-5-2 和156 果实中β-胡萝卜素和类胡萝卜素含量的变化趋势相似,果肉颜色不同的自交系变化趋势存在一定差异,这与吕丽华[20]研究结果一致。
类胡萝卜素生物合成途径中酶基因的表达对植物类胡萝卜素的含量存在一定影响,导致形成不同的果肉颜色。 PSY 是决定类胡萝卜素总量的核心催化酶,甜瓜中存在2 个PSY基因拷贝,即PSY1 和PSY2[25-26];LCY 是一类重要的环化酶,参与类胡萝卜素合成途径中番茄红素的环化反应,其中LCY-b基因是催化番茄红素生成β-胡萝卜素的关键酶[27]。 瓤色为红色的西瓜在果实成熟过程中类胡萝卜素合成酶基因的表达量增幅较大,而代谢酶基因的表达量降低,在这个时期类胡萝卜素含量明显上升[28]。 番木瓜红色果肉品种ZDS基因的表达量高于黄色果肉[29]。 前人研究已表明,PDS与PSY、ZDS等基因协调作用,能在转录水平上调节花或成熟果实中类胡萝卜素的积累[27]。 本试验发现,PSY1 基因在5 个不同肉色的甜瓜果实发育初期表达较高,随着发育时期的延长开始下调,PSY2、LCY-b和ZDS基因在162 和159 果实中的表达趋势和PSY1 基因一致,与赵新伟等[30]研究结果基本一致。 但在wm-6、 12B-5-2 和B3-1-1 果实中其表达趋势相反,可能是因为PSY1 基因在非红色组织中表达,而PSY2、LCY-b和ZDS基因在红色组织中表达,且类胡萝卜素含量最高的wm-6 在果实成熟期PSY2、LCY-b和ZDS基因表达最强,类胡萝卜素含量最低的162 表达最弱,表明随着果实的发育162 的类胡萝卜素合成能力降低[24]。 在类胡萝卜素降解相关基因中,CCD1 基因产物可以催化类胡萝卜素底物的9,10 双键,5 个自交系随着果实发育时期的延长CCD1 基因表达下调,表明类胡萝卜素的积累可能与CCD1 基因的低转录活性有关,造成类胡萝卜素降解受到阻碍[7,31]。
糖的类别和含量是判断甜瓜品质的主要依据,在相同的栽培条件下主要受果实发育期和品种基因型的影响。 在果实中决定甜味的主要是果糖,葡萄糖能改善果实的香味,使果实具有香甜绵软之感[32]。 自交系159 果实中葡萄糖含量随着果实发育时期的延长逐渐升高,且蔗糖含量在成熟期最低,在果实香味酥软特性较为突出,说明这个自交系为还原糖积累类型[11,17];wm-6、12B-5-2 和162 果实发育过程中,果糖含量变化不明显,蔗糖含量在果实成熟期明显提高,但蔗糖∕(葡萄糖+果糖)比值小于1,说明这3 个自交系属于低蔗糖积累类型;6 个自交系蔗糖含量在授粉10—25 d 含量极低,25—40 d 急剧上升,其中156 和B-3-1-1 上升幅度较大,蔗糖∕(葡萄糖+果糖)比值在果实成熟时大于1,说明这2 个自交系属于高蔗糖积累类型甜瓜,这与乔永旭等[18]和叶红霞等[32]的研究结果一致。 在6 个自交系中果肉绿色的159 蔗糖含量一直最低,这与马梦婕[33]和李响等[17]研究结果不同,其原因有待进一步研究。
蔗糖代谢相关酶活性变化与果实中糖含量密切相关,其中酸性转化酶(AI)和中性转化酶(NI)对果实糖分的合成、运输及积累有着重要的影响,是蔗糖在枣[34]果实发育过程中代谢的关键酶。 在甜瓜中,转化酶(特别是NI)活性的下降是甜瓜果实糖积累的前提,但也有研究认为AI 和NI 活性下降不是糖积累的主要因子,是果糖和葡萄糖积累的一个信号[35]。 不同甜瓜自交系在果实生长发育期的糖分合成相关酶种类及活性变化趋势有所区别,156 和B-3-1-1 在授粉10 d 时AI 活性较高,利于催化蔗糖分解,生成的果糖和葡萄糖供呼吸消耗,之后开始下降。 6 个甜瓜自交系在授粉后40 d 时,随着蔗糖磷酸合成酶(SPS)和蔗糖合成酶(SS)活性升高蔗糖含量快速积累,对成熟期果实的风味品质有着重要影响,这与前人报道一致[32]。 wm-6 和162 果实中AI 活性随着蔗糖含量的升高而降低,且与蔗糖含量呈极显著负相关;B-3-1-1在授粉后40 d 果实中果糖含量升高与NI 保持较高的活性有关;6 个甜瓜自交系果实成熟时蔗糖含量与SPS 和SS 活性呈极显著正相关(除了162 的SPS 活性),且自交系间差异较大,推断SPS 和SS 是甜瓜品种间蔗糖含量差异的主要原因,这与马慧等[16]研究结果一致,但与叶红霞等[32]研究结果有一定区别,今后有必要从糖代谢酶的分子调控机理方面进一步深入探讨。
4 结论
本研究表明,类胡萝卜素含量与甜瓜果肉颜色密切相关,其合成及降解关键基因表达的变化是造成不同自交系间类胡萝卜素含量变化的原因之一;果实中糖的组分和含量与果肉颜色相关性不显著,不同的甜瓜自交系及果实不同发育阶段,参与糖代谢的酶有所不同,其果实品质的形成可能是各种酶协同作用的结果。
