脐血与外周血来源CIK 治疗晚期结直肠癌的比较研究
2021-05-10张闯江龙委张燕艾月琴史瑞芳高艳荣赵华姚露贾绍昌胡建华肖梅
张闯 江龙委 张燕 艾月琴 史瑞芳 高艳荣 赵华 姚露 贾绍昌 胡建华 肖梅
1.南京市玄武医院,江苏 南京 210000;2.东部战区总医院,江苏 南京 210002
肿瘤是威胁人类健康的主要疾病,结直肠癌是发病率与死亡率均位居前列的肿瘤。研究显示,2018 年全世界新发肿瘤中,结直肠癌在所有肿瘤中位居第三,而在因肿瘤死亡的病例中,结直肠癌位居第二;男性中结直肠癌的发病率及死亡率分别位居第三和第四,女性中结直肠癌的发病率及死亡率分别位居第二和第三[1],结直肠癌在人类发展指数(human development index,HDI)不同的国家的发病及死亡情况也有所不同。在HDI 高的国家中,其发病率在男性和女性中分别位居第三及第二位,死亡率分别为第四及第三位;而在HDI 低的国家中,其发病率在男性和女性中分别位居第五及第三位,死亡率都为第五位[1]。随着手术、放化疗技术的发展,结直肠癌患者的治愈率及生存时间都有明显上升,但对于晚期结直肠癌患者而言,生存率并不乐观[2]。
细胞免疫治疗是一种有潜力的肿瘤治疗方法,细胞因子诱导的杀伤细胞(cytokine-induced killer,CIK)是其中一种具有广谱杀瘤活性的免疫细胞。CIK 是一群异质性细胞,主要的效应细胞为CD3+CD56+具有自然杀伤细胞(natural killer,NK)样特征的T 细胞。临床研究证实,CIK 对多种肿瘤具有杀伤活性,能使患者临床获益[3-9]。CIK 的主要来源是患者自身外周血单个核细胞(peripheral blood mononuclear cell,PBMC),简称外周血来源 CIK(peripheral derived CIK,PB-CIK)。但是对于部分健康状况较差的晚期肿瘤患者或是老年患者而言,获得足够数量的外周血PBMC 比较困难[10]。针对这种情况,使用脐血来源PBMC 制备CIK(cord blood derived CIK,CB-CIK)用于肿瘤治疗是一种可行的方法[11]。本研究探讨CB-CIK 与PB-CIK 治疗晚期结直肠癌患者的安全性及有效性,报告如下。
1 资料与方法
1.1 一般资料 选取2016 年10 月至2017 年9 月在东部战区总医院秦淮医疗区(原第81 医院)生物治疗科进行治疗的结直肠癌患者52 例。按随机数字表法分为 CB-CIK 组和 PB-CIK 组。CB-CIK 组 26 例,采用脐血来源CIK 治疗;PB-CIK 组26 例,采用外周血来源CIK 治疗。两组患者一般资料比较差异无统计学意义(P>0.05)。见表 1。
1.2 入选标准 纳入标准:符合中国结直肠癌诊断标准,经病理学诊断确诊为结直肠癌的患者[12];karnofsky功能状态评分(karnofsky performance status,KPS)≥60分;年龄18~80 岁;预期生存期≥3 个月;其他治疗结束至首次细胞治疗开始间隔3 个月以上。排除标准:严重糖尿病、心脑血管疾病患者;严重凝血功能异常者;严重自身免疫性疾病患者;近期内有活动性出血史者及RH 阴性患者;对本治疗中所用的生物试剂过敏者;无法抽取血液的肿瘤患者;严重精神疾病者;脏器移植者;不可控制的感染性疾病。本临床试验程序经医院伦理委员会审查批准,全部入组患者均签署知情同意书。

表1 两组患者一般资料比较(例)
1.3 试剂与仪器 淋巴细胞分离液购自加拿大Stemcell 公司。KBM-551 培养液为美国Corning 公司产品,抗人CD3 单克隆抗体(anti-CD3 mAb)购自北京同立海源生物工程有限公司,重组人IL-1β 购自美国peprotech 公司,重组人IFN-γ 购自上海凯茂生物科技有限公司。流式抗体均为beckman 公司产品,流式细胞仪型号为Beckman 公司的Beckman Coulter XL。
1.4 方法
1.4.1 CIK 细胞的制备及表型测定。血液来源:26 例行PB-CIK 治疗的患者使用的血液为自体外周血;26 例行CB-CIK 治疗的患者使用的脐血均来源于东部战区总医院产科足月正常分娩的产妇,按卫生部《献血体检标准》检验合格。CIK 的培养:采集的血液分离出PBMC,洗涤后置添加培养液至浓度为2~3×106个/mL,并加入重组人IFN-γ 至终浓度为1000U/mL,置于细胞培养箱培养过夜。第二天加入终浓度为500U/mL 的rhIL-2 和50ng/mL 的 anti-CD3 mAb 及 4ng/mL 的重组人 IL-1β继续培养,定期观察换液。在第9~21 天检测质量合格后分3 次收集细胞。
1.4.2 CIK 细胞免疫治疗方案。视CIK 细胞成熟情况,共3 次静脉回输,每次回输间隔1 天,细胞数不少于1×109个/mL。以 3 次 CIK 细胞回输为 1 治疗周期。
1.4.3 淋巴细胞亚群检测。在治疗前及治疗后一周内分别抽取外周血进行流式检测,流式抗体组合为CD3-ECD、CD4-PC5、CD8-FITC、CD19-FITC、CD56-PE、CD25-PE。检测结果用CXP(v2.1)软件分析。
1.5 疗效评价 在患者治疗前1 周及接受完最后一次治疗后三个月内进行免疫反应及临床疗效评估,之后每3~6 个月复查评估。评估指标为癌胚抗原(carcinoembryonic antigen,CEA),外周血细胞因子 IL-2、IFN-γ和TNF-α,外周血淋巴细胞亚群及影像学检查。近期疗效评估按实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)[13]进行评价。以 CR+PR+SD 计算疾病控制率(disease control rate,DCR)。细胞治疗过程中的不良反应根据美国国立癌症研究所《常见不良反应标准》(NCI-CTCAE v4.0)[14]进行判定。
1.6 统计学方法 采用SPSS 22.0 统计软件进行分析。计量资料以()表示,同一样本治疗前后比较采用配对t 检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组细胞的形态学分析及增殖能力比较 分别计数起始PBMC 的数量及收获的CIK 细胞总数量,CB-CIK 组和PB-CIK 组患者分离PBMC 均值无显著差异(P>0.05)。经过 15 天培养后,CB-CIK 组收获的CIK 细胞总数明显高于PB-CIK 组,表示CB-CIK 的增殖能力强于PB-CIK。见表2。
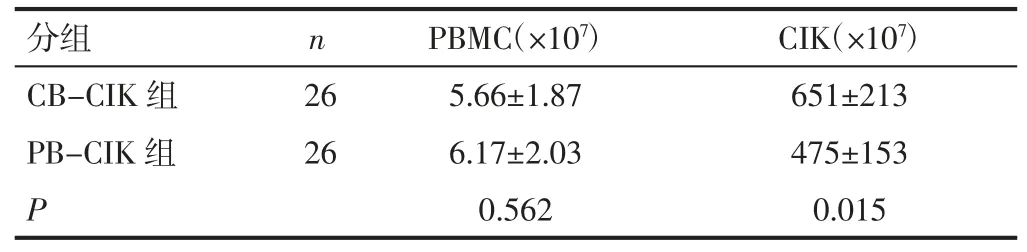
表2 两组患者细胞增殖能力比较
使用流式细胞仪分析起始PBMC 及收获的CIK细胞中CD3+CD56+细胞的比例。结果显示两组患者PBMC 中CD3+CD56+细胞的比例都不到1%,而经过15天的培养,CB-CIK 组CD3+CD56+细胞比例显著高于PB-CIK 组(P<0.05)。见表 3。
2.2 两组患者临床疗效比较 两组DCR 差异无统计学意义(P>0.05)。见表 4。

表3 两组患者CIK 细胞的平均表型(%)
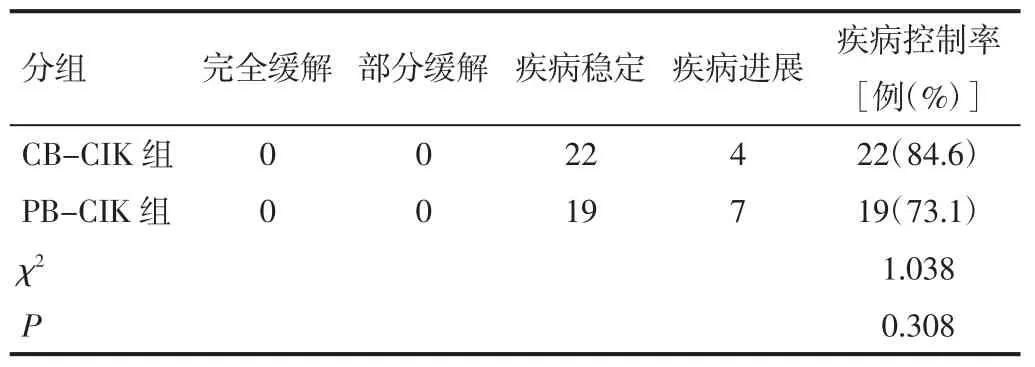
表4 两组患者临床疗效比较(例)
2.3 两组患者细胞免疫治疗前后CEA 变化 经细胞治疗后,52 例患者的CEA 平均值显著低于细胞治疗前(P>0.05)。治疗前后两组患者 CEA 无差异(P>0.05)。见表5。
2.4 两组患者细胞免疫治疗前后免疫学指标的变化两组患者治疗前总T 细胞、辅助性T 细胞、细胞毒性T细胞、NK 细胞及调节性T 细胞都无显著性差异(P>0.05),而治疗后也无显著差异(P>0.05)。见表 6。
表5 患者细胞免疫治疗前后CEA 变化(μg/L,)

表5 患者细胞免疫治疗前后CEA 变化(μg/L,)
分组 n 治疗前 治疗后 P总体 52 157.86±248.67 91.68±162.90 0.040 CB-CIK 26 151.92±229.16 89.87±120.52 0.111 PB-CIK 26 164.17±271.16 93.48±199.01 0.177 P 0.251 0.607
两组患者治疗前外周血 IL-2、IFN-γ 和 TNF-α 水平无显著差异(P>0.05)。治疗后,CB-CIK 组 IL-2 及IFN-γ 水平显著高于 PB-CIK 组(P<0.05),TNF-α 水平虽有增高但无显著差异(P>0.05)。见图1。
2.5 两组患者CIK 治疗的安全性分析 两组患者中,共有5 例在细胞回输后出现畏寒和发热,其中CB-CIK组有 2 例,PB-CIK 组有 3 例,两组无显著差异(P=0.638),对症处理后恢复正常。所有不良反应均未达3~4 级。
表6 患者治疗前后外周血淋巴细胞亚群的变化(%,)
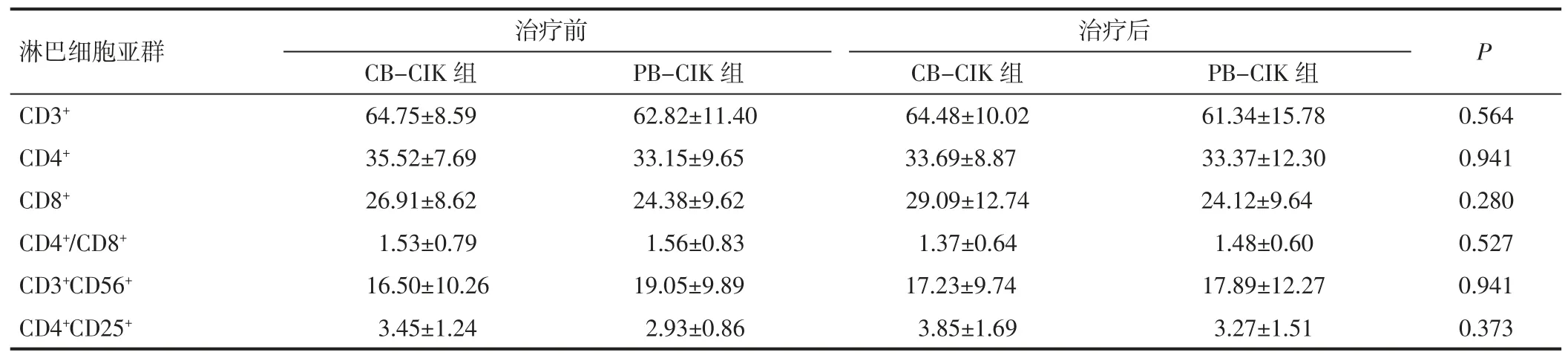
表6 患者治疗前后外周血淋巴细胞亚群的变化(%,)
淋巴细胞亚群 治疗前 治疗后 P CB-CIK 组 PB-CIK 组 CB-CIK 组 PB-CIK 组CD3+ 64.75±8.59 62.82±11.40 64.48±10.02 61.34±15.78 0.564 CD4+ 35.52±7.69 33.15±9.65 33.69±8.87 33.37±12.30 0.941 CD8+ 26.91±8.62 24.38±9.62 29.09±12.74 24.12±9.64 0.280 CD4+/CD8+ 1.53±0.79 1.56±0.83 1.37±0.64 1.48±0.60 0.527 CD3+CD56+ 16.50±10.26 19.05±9.89 17.23±9.74 17.89±12.27 0.941 CD4+CD25+ 3.45±1.24 2.93±0.86 3.85±1.69 3.27±1.51 0.373

图1 两组患者治疗前后外周血细胞因子含量的比较
3 讨论
脐血在临床上用于治疗肿瘤及非肿瘤的疾病已经有几十年的历史。脐血具有低免疫原性的特点,即使在供体与配体之间HLA 错配很高的情况下也能耐受脐血移植[15]。研究证明,脐血细胞移植到肿瘤患者体内能产生一定的临床反应且无严重不良反应产生[16,17]。脐血里含有的细胞种类很多,包括T 细胞、NK 细胞、B 细胞、树突状细胞、造血干细胞及间充质干细胞等,这使它成为细胞治疗领域非常有潜力的细胞来源[18-20]。已有的研究证实,使用脐血来源的CIK 治疗肿瘤是安全可行的[21]。同时,脐血具有来源广泛、同种异体反应弱、病毒传播风险低的特点。本研究结果显示,26 例使用CB-CIK 治疗的患者中,只有2 例出现畏寒和发热的自限性不良反应,与PB-CIK 的不良反应无显著差异,证明使用脐血来源的CIK 是安全的。
以往研究证实,CB-CIK 与PB-CIK 相比,其表面标志及抗肿瘤效应相似,增殖能力强,免疫原性低的特点[22-23]。本研究显示,从相同量的脐血中分离出的PBMC 数与外周血无太大差异,而以相同的方法培养15 天后,脐血来源的CIK 的增殖倍数明显高于外周血来源的,同时,CD3+CD56+细胞的倍数也显著高于外周血来源的CIK,证明CB-CIK 的增殖潜能高于PB-CIK。
使用CIK 治疗结直肠癌的临床研究有很多,多与其他治疗联用,如与DC 联用或与化疗联用。Dao 等[24]使用DC、CIK 联合化疗治疗胃癌及结直肠癌患者并与单独化疗治疗比较,结果显示与单独化疗相比,联合治疗组的DFS 与5 年生存期显著高于单独化疗组。另一项回顾性研究纳入了96 例手术后的结直肠癌患者,21例使用CIK 联合化疗治疗,其余75 例单独使用化疗治疗,联合治疗组的DFS 比单独治疗组显著提升[25]。2017 年一项Meta 分析纳入了29 项临床研究共2610例结直肠癌患者,结果显示,与单独化疗的患者相比联合CIK 或DC-CIK 治疗的患者的DFS 及OS 有显著提高[26]。本研究比较了脐血来源CIK 与外周血来源CIK的临床疗效,结果显示两组近期临床疗效无显著差异,且无1 例CR 或PR。可能是因为本研究纳入的都为晚期患者,病情较重,导致CIK 治疗近期临床疗效不显著,后期应将联合化疗进行比较。外周血肿瘤标志物是一种常用的肿瘤治疗评价指标。CEA 在多种肿瘤中表达,包括结直肠癌、肺癌、乳腺癌等。本研究显示,52 例接受CIK 治疗的结直肠癌患者CEA 水平有显著降低,证明CIK 治疗能使患者临床获益。但比较CB-CIK 组与PB-CIK 组治疗后的CEA 值并无显著差异,说明CBCIK 与PB-CIK 治疗结直肠癌患者的近期临床疗效相似。患者免疫学指标的变化也对免疫治疗的疗效有一定的意义。本研究结果显示,两组患者淋巴细胞亚群无显著差异,但 CB-CIK 组治疗后细胞因子(IL-2、IFN-γ)分泌水平显著高于PB-CIK 组,证明CB-CIK 治疗能更好地刺激患者免疫系统对抗肿瘤。
综上所述,脐血来源的CIK 与外周血来源CIK 治疗晚期结直肠癌患者是安全的,能使患者临床获益,但两者近期疗效无差异;同时脐血来源的CIK 比外周血来源CIK 更能改善患者免疫功能。这一区别可能会体现在长期的生存期上,后期将继续随访研究,对两组患者的DFS 及OS 进行比较。
