血栓素B2对急性主动脉夹层诊治的指导价值△
2021-05-09李汉平何国东罗淞元范小平
杨 轶,李汉平,何国东,罗淞元,范小平,杨 敏
[1.广东省人民医院(广东省医学科学院)药学部,广州 510080;2.广东省人民医院(广东省医学科学院)医学研究部,广州 510080;3.广东省心血管病研究所心内科广东省人民医院(广东省医学科学院),广州 510080;4.广东省心血管病研究所心外科广东省人民医院(广东省医学科学院),广州510080]
急性主动脉夹层(acute aortic dissection,AAD)是一种起病较急、病死率高的大血管急症[1]。在临床中,与急性心肌梗死(acute myocardial infarction,AMI)、急性肺栓塞(acute pulmonary embolism,APE)具有类似的症状,如胸痛、呼吸困难等。对于A型AAD患者,以尽快手术治疗为主要方案;对于B型ADD患者,可采取药物保守治疗并植入支架的方案,目的是通过控制血压和心率来控制血液流速,防止夹层进展。对于AMI患者,采取抗血小板、抗凝与抗缺血为基本治疗方案;对于APE患者,宜采取个体化的溶栓治疗方案。及时的鉴别诊断对于采取正确治疗方案尤为重要[2]。目前冠状动脉计算机断层扫描血管造影(CTA)、磁共振成像(MRI)是主动脉夹层诊断的“金标准”,但费用相对较高、耗时,且不适合普遍筛查[3-4]。临床上最常用的生物标志物如D-二聚体仍存在特异性与敏感性缺陷[5];寻找新的生物标志物仍是主动脉夹层诊断研究的热点。血栓素B2(thromboxane B2,TxB2)是一种源于血栓素A2(thromboxane A2,TxA2)的稳定的、无生物活性的代谢产物[6]。TxA2是一种极性较大的类花生酸类物质,微小的浓度就可以产生巨大的生理作用。TxA2具有促进血小板凝聚以及血管收缩作用。血小板激活与血管收缩与AAD有着密切关系[7];血小板对AMI与APE的发生、发展也起着重要的作用[8-9]。目前,TxB2是否对这3种疾病具有鉴别诊断意义并未见有报道。本研究检测了本院临床诊断为AAD、AMI与APE患者的血浆TxB2浓度,探讨TxB2对AAD临床诊治的指导价值。
1 资料和方法
1.1 一般资料
选取广东省人民医院2016至2017年采集的受试者血浆样本72例:AAD患者24例,其中A型主动脉夹层(AAD-A)12例,B型主动脉夹层(AAD-B)12例;AMI患者24例,其中ST段抬高(AMI-ST)12例,非ST段抬高(AMI-NST)12例;APE患者12例;健康对照(health control,HC)者12例。患者均为首次发生并诊断为相应疾病,抽血前14 d内出现过其中1种或以上如下症状:胸痛、背痛、腹痛。HC样本来源于广东省人民医院健康体检中心,问诊患者近半年均无出现过胸痛、背痛、腹痛等急性剧烈疼痛症状,患者体检结果排除AAD、AMI与APE。其他排除标准:曾有过主动脉创伤、假性动脉瘤、心力衰竭史、肾功能不全、严重肺部疾病或肿瘤。本研究经广东省人民医院医学伦理委员会批准,所有患者与HC研究对象均签署知情同意书。
1.2 试验方法
采用肝素锂标本管收集新鲜血浆样本。AAD、AMI与APE血样为患者入院后次日早晨6~7点空腹采血,HC血样为健康体检中心早晨8~10点空腹采血。血样采集后即刻送至医学研究部,在3 000 r/min、4℃条件下离心10 min,取上清,保存于-80 ℃冰箱。血浆样本的采集与处理方法一致。采用酶联免疫吸附法(ELISA)测定血浆TxB2浓度。酶标仪型号为Multiskan GO,试剂盒为R&D公司生产、货号KGE011,并按照说明书提供的方法完成实验。
1.3 统计学分析
使用SPSS 22.0统计软件。计量资料符合正态分布的以()表示,采用方差分析;不服从正态分布的用非参数检验。计数资料以[n(%)]表示,定序变量采用秩和检验;计数资料的类别变量用卡方(χ2)检验。所有检验均为双侧检验,当P<0.05时认为差异具有统计学意义。
2 结果
2.1 各组研究对象的基线资料比较
HC组、AAD-A组、AAD-B组、AMI-ST组、AMI-NST组与APE组研究对象的年龄比较,差异有统计学意义[(59.0±8.9)岁vs.(47.0±7.3)岁vs.(51.7±6.1)岁vs.(50.2±5.2)岁vs.(55.5±7.9)岁vs.(61.5±8.7)岁,P=0.018];各组研究对象的其他基线资料比较,详见表1。
2.2 各组研究对象间血浆血栓素B2浓度的比较
AAD-A组患者的TxB2浓度[8 501.1(6 444.5~13 096.7)pg/mL]显著高于AAD-B组[5 144.4(3 186.1~6 715.3)pg/mL]、AMI-ST组[5 536.5(4 406.6~7 551.5)pg/mL]、AMI-NST组[5613.5(4 912.3~6 879.8)pg/mL]、APE组[4 384.0(2 951.5~6 343.36)pg/mL]及HC组[3 747.7(1 929.9~4 611.0)pg/mL],差异有统计学意义(P<0.01)。HC组研究对象的TxB2浓度显著低于AAD-A组、AAD-B组、AMI-ST组与AMI-NST组,差异有统计学意义(P<0.05),详见图1。
3 讨论
TxB2是一种源于TxA2的较为稳定、但无生物活性的小分子代谢物。TxA2生物半衰期仅30 s。因此,通常采取测定TxB2来反映TxA2的激活水平。TxA2是一种前列腺素类物质,由血小板产生,具有血小板凝聚及血管收缩作用,与前列腺素作用相反,两者动态平衡以维持血管收缩功能及血小板聚集作用。血小板激活与主动脉夹层有着密切的关系,这可能与主动脉壁撕裂有关。TxA2具有强大的血管收缩功能,这与主动脉夹层最常见的临床表现——持续性高血压可能有着密切的关系。尽管如此,尚未见TxB2、TxA2与主动脉夹层的机制与诊断的研究报道。
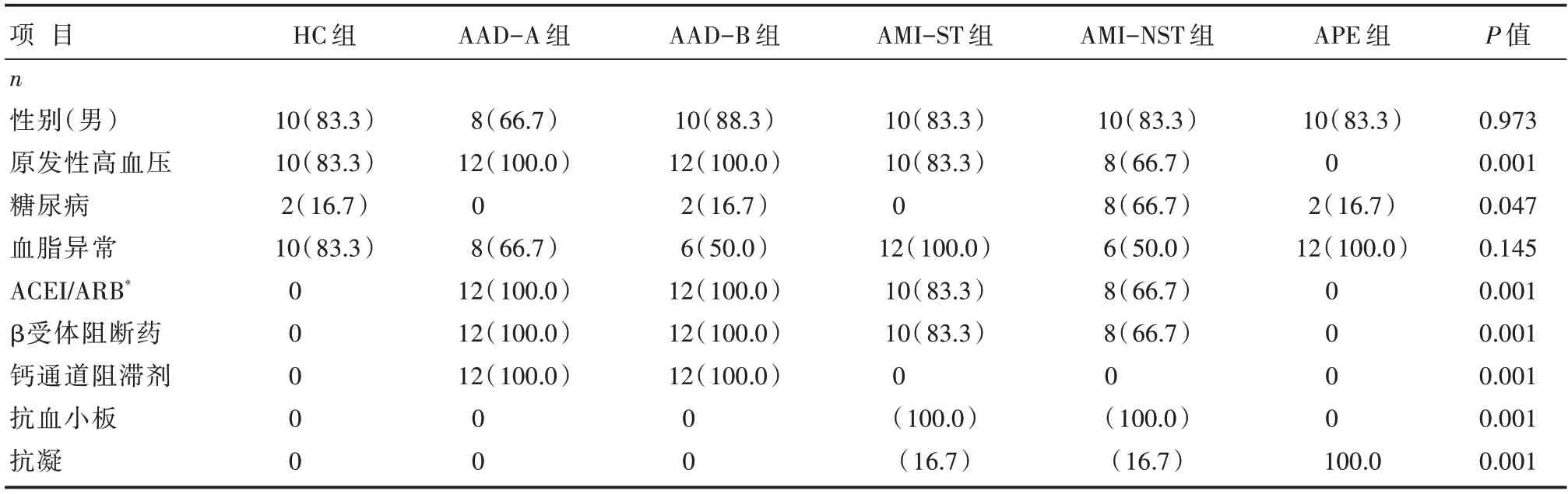
表1 各组研究对象的基线资料比较 [n=12,n(%)]

图2 各组研究对象血浆TxB2浓度比较箱图
本研究首次将TxB2对AAD临床诊治的可能价值进行探讨。商品化的酶联免疫吸附试验试剂盒能较稳定可靠地对血浆TxB2浓度进行检测[10]。本研究最重要的发现,与AAD-B、AMI-ST、AMINST、APE组患者和HC组研究对象相比,AAD-A组患者的TxB2浓度显著升高,差异有统计学意义(P<0.05)。
本研究存在缺陷。首先,样本量较少,不能排除患者基线资料对试验结果的影响,也不能明确TxB2对主动脉夹层鉴别诊断敏感性与特异性的程度;其次,在参与本研究的患者中,AMI患者采血前,均接受过1~7 d的阿司匹林(100 mg/d)与氯吡格雷(75 mg/d)进行抗血小板的治疗;且有研究认为,服用阿司匹林可使血栓素浓度降低,认为TxB2浓度可以反映阿司匹林抗血小板的疗效[11-12]。因此,阿司匹林可能是AMI患者TxB2浓度的干扰因素。尽管如此,一方面,Brun等[13]将两项关于阿司匹林对TxB2浓度影响的相关临床研究BOS⁃TON与ADRIE进行了对比分析,两项研究均使用75~250 mg/d剂量的阿司匹林,但TxB2浓度并未发生显著改变,因此Brun等[13]的结论是使用阿司匹林并不一定影响TxB2的浓度,用TxB2来反映阿司匹林抗血小板疗效的观点仍有待进一步研究;另一方面,Good等[14]研究发现,氯吡格雷等P2Y12抑制剂并不影响TxB2的浓度。因此,并没有定论阿司匹林与氯吡格雷治疗会影响血浆TxB2的浓度。
综上,TxB2可能是AAD鉴别诊断的生物标志物,其对临床诊治具有潜在的指导价值。
