乙肝免疫球蛋白阻断乙肝病毒在母婴间传播的动力学模型
2021-05-07李冬梅刘伟华郭美静
李冬梅, 刘伟华, 汪 琪, 郭美静
(1- 哈尔滨理工大学理学院,哈尔滨 150080; 2- 黑龙江省医院儿科,哈尔滨 150036)
1 引言
乙型病毒(Hepatitis B Virus, HBV)性肝炎,简称乙肝,是由HBV 感染引起的传染病.母婴传播是HBV 传播的三种方式之一.实施母婴传播阻断策略能够显著降低HBV 感染,且已经成为现阶段我国乙肝预防工作的重点[1].应用乙肝免疫球蛋白(Hepatitis B Immunoglobulin, HBIG)可有效的阻断HBV 通过胎盘对胎儿的感染,进一步提高出生人口的健康质量[2].
众多数学工作者通过研究HBV 的发病机制和治疗机理建立了数学模型,并希望通过定量研究HBV 变化规律对防治乙肝疾病带来一定的帮助[3–5].Lewin 和Ribeiro[6]通过数学模型进一步研究了抗病毒药物治疗对乙肝疾病的控制问题.Stanca 等人建立了具有抗体免疫反应的数学模型,这使得人们更加精确地刻画了宿主体内的HBV 变化规律[7].实际上,在临床医学中是通过观察母体内的体征情况来预测胎儿的患病情况.周煜等人[8]运用Meta 分析的方法对临床检验的数据分析来评价药物阻断HBV 母婴宫内免疫策略的可行性,发现HBV 携带孕妇注射HBIG 可降低新生儿的感染率,但目前对于母婴之间HBV 传播的定量模型研究结果很少.
本文综合考虑HBV 进入母体后的传播机理,以及药物对病毒的抑制作用,建立了母体怀孕期间的药物阻断HBV 在母婴间传播的动力学模型,研究了母体接受HBIG 来控制体内HBV 的数量,从而减少HBV 对胎儿的感染机率.再根据临床用药量数据,运用Matlab 模拟胎儿体内的病毒数量变化曲线,从理论上优化给药方案,为指导临床治疗提供了可参考的依据.
2 乙肝免疫球蛋白阻断乙肝病毒在母婴间传播的动力学模型的建立
研究发现,当个体感染了HBV 后,其作为抗原刺激宿主细胞的免疫系统产生抗体来阻滞感染HBV.若免疫系统不强无法抵抗HBV 复制,就会带来慢性持续性感染,从而演变成乙肝患者.乙肝免疫球蛋白(HBIG)是预防HBV 入侵复制的被动免疫制剂,当人体接受这种外源性抗体后,可以在短期内中和并清除血清中游离的HBV.临床上通常采用HBIG 阻断HBV 在母婴间的传播,有关方面的研究已取得了可观的结果[9,10].这为建立数学模型提供了可依据的理论基础.在妊娠初期,由于胎盘的屏障作用,母体与胎儿血液分开,互不干扰,除了可以进行选择性的物质交换外,胎盘还可以阻止母体内的一部分病毒进入胚胎、保障胎儿正常生长发育.但在孕妇妊娠20 周后,胎盘开始传递母体抗体给胎儿的功能,但胎儿体内的抗体不足以抵抗母体传递的病毒,为此要控制母体内的病毒数量.通过应用HBIG 来降低母体内HBV 数量,可以有效阻断HBV 感染胎儿[7].由文献[6]从数学和医学角度做出如下假设:
1) 胎儿体内的HBV 主要是来源于母体内HBV 输入;
2) 在胎儿的生长发育过程中,其免疫系统尚不完善,不足以抵御外来病毒的入侵.为了降低胎儿的感染可能性,药物可以减少母体内HBV,从而阻断HBV 在母婴间的垂直传播.因而不考虑胎儿免疫系统功能;
3) 每个个体乙肝传播机理相同;
4) 认为HBV 携带者与感染者之间存在着临界值.若个体的HBV 超过临界值,可诊断为HBV 感染者.
基于上述原因与假设,将母体与胎儿看成两个个体,胎盘连接两个个体,胎儿是否感染主要是受母体HBV 量的影响.下面分别讨论母体及胎儿体内的易感肝细胞(Ti)、感染肝细胞(Ii)、HBV(Vi)和免疫抗体(C1)的情况,其中i= 1,2,下角标为1 代表母体、下角标为2 代表胎儿.考虑到HBIG 对HBV 的作用机理,建立了如下的动力学模型

模型(1)中相关参数意义,如表1 所示.

表1 模型(1)相关参数表
3 主要研究结果
在临床实践中,对母体应用HBIG 阻断HBV 在母婴之间传播,药物可以有效控制母亲体内病毒的数量,使母体内的病毒不传播给胎儿.因此,先考虑母体在药物作用下病毒数量变化趋势,再分析胎儿体内HBV感染可能性.可将模型(1)分解成如下的母体模型、胎儿模型

将母体模型(2)的第一、二、四方程相加,令m=min{dT1,dI1,dC1},则由
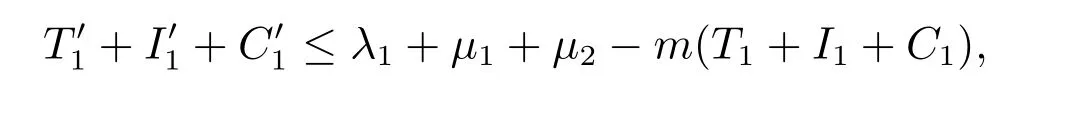
可知,存在t1,当t ≥t1时,有

再由模型(2)的第三个方程可求得,存在t2>t1,当t ≥t2时,有

且Γ 是模型(2)的不变集.
3.1 母体模型(2)的稳定性
模型(2)在平衡点处满足如下方程
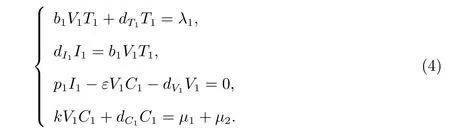
由式(4)求得

令

将式(5)代入式(4)的第三个方程,得到

其中

由式(5)、式(6)易求得无病毒平衡点

由二次函数性质知,式(6)确定的函数为f(V1) = 0.当R0> 1 时,有唯一正根V ∗1> 0,使得f(V ∗1) = 0.再将V ∗1代入式(5),可计算出模型(2)有病毒平衡点Q∗1=(T1∗,I1∗,V1∗,C1∗).
定理1当R0< 1 时,模型(2)存在局部渐近稳定的无病毒平衡点Q∗0;当R0>1 时,模型(2)无病毒平衡点Q∗0是不稳定.
证明 模型(2)的Jacobi 矩阵为
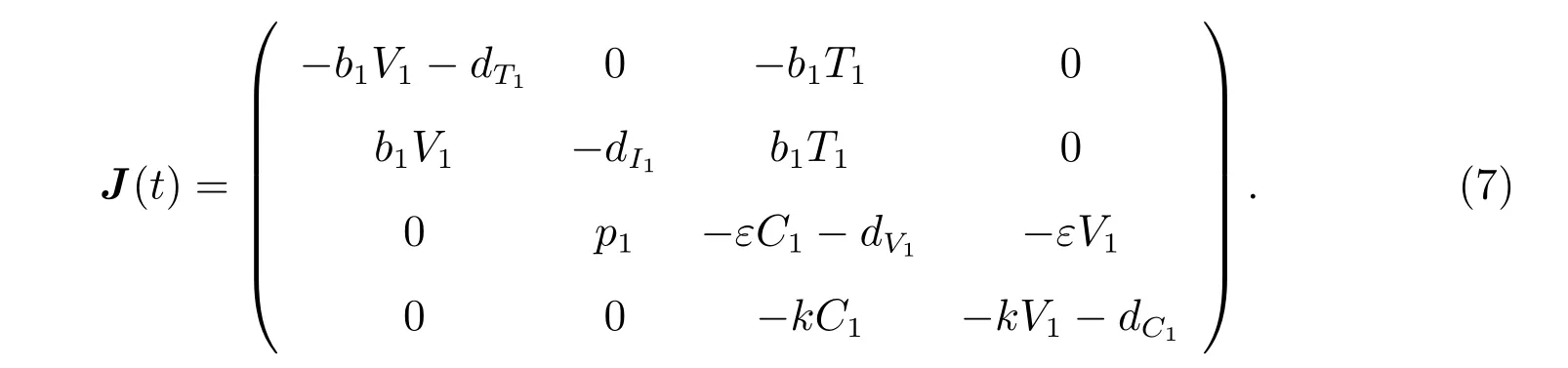
模型(2)在Q∗0处线性近似方程对应的特征方程为

当R0< 1 时,由Routh-Hurwitz 定理[11]知,式(8)的所有特征根均为负特征根,无病毒平衡点是局部渐近稳定点;当R0>1 时,无病毒平衡点是不稳定点.
考虑系统
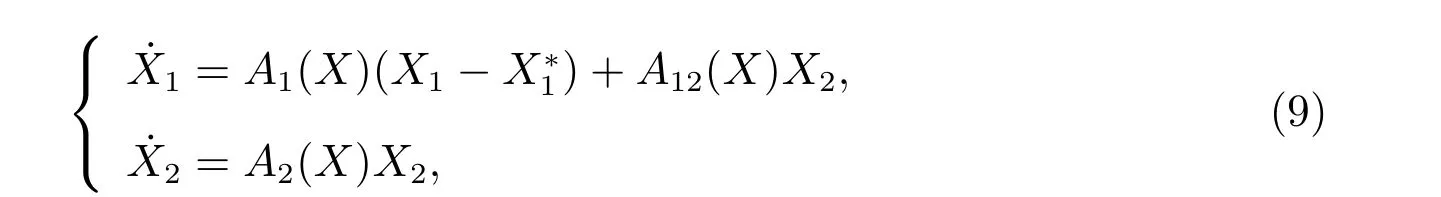
其中X1∈1, X2∈, X=(X1,X2), X∗=(,0)为平衡点.假设下列条件:
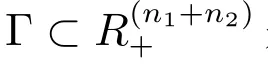
H2:·X1=A1(X)(X1−)系统(9)的子系统存在唯一的全局渐近稳定点;
H3: 对任意的X ∈Γ,A2(X)是Metzler 矩阵且不可约;
H4: 定义在Γ 上的A2(X)存在一个上界矩阵,即存在∈Γ,使得

H5: 矩阵的谱半径α()<0.
引理1[12]如果系统(9)满足条件H1–H5,那么平衡点X∗是系统(9)的全局渐近稳定点.
为了研究模型(2)无病毒平衡点的全局稳定性,将模型(2)写成具有形式(9)的矩阵方程形式.令

定理2当R0<1 时,模型(2)的无病毒平衡点是全局渐近稳定点.
证明 下面验证引理1 的条件.
H1: 由于Γ 是模型(2)的不变集,因而模型(2)在Γ 内是耗散的.
H2: 对于子系统
·X1=A1(X)(X1−X∗1),即有
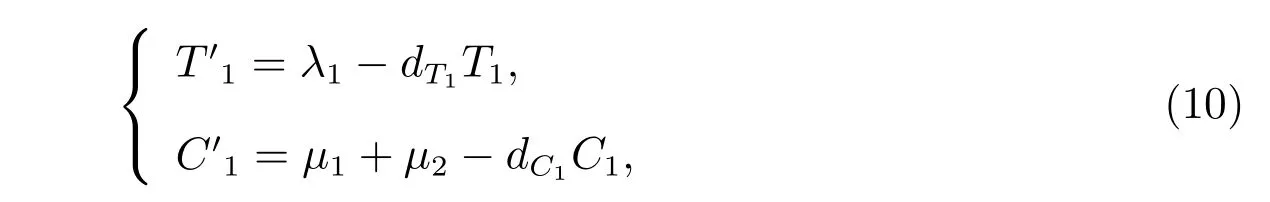
显然

是子系统(10)的全局渐近稳定点.
H3: 对于矩阵A2(X),非主对角线上元素均为正,故A2(X)是Metzler 矩阵且不可约[13].
H4: 由A2(X)的定义及式(10)的稳定性可知,A2(X)在Γ 内存在上界矩阵,取=(X∗1,0),可得
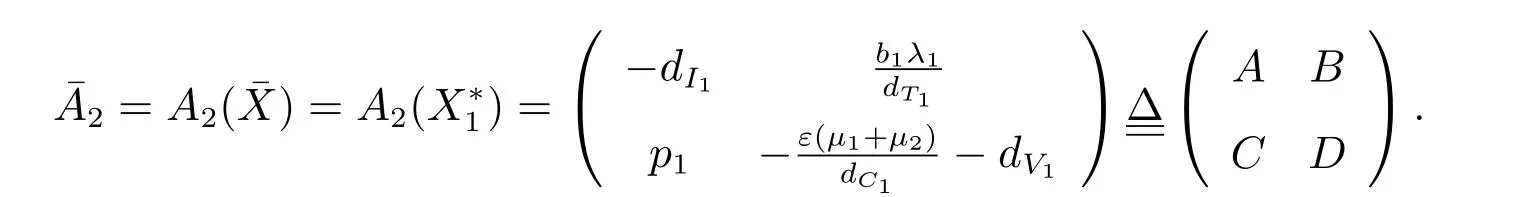
H5: ¯A2是常数矩阵,要证α()<0,等价于α(D −CA−1B)<0[11].
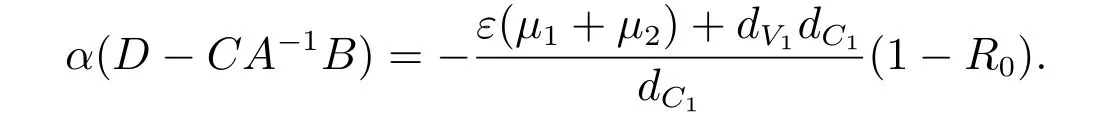
由引理1 知,当R0<1 时,模型(2)的无病毒平衡点是全局渐近稳定点.
定理3当R0>1 时,模型(2)在Γ 内是一致持久的.
证明 由定理1 知,当R0>1 时,在区域Γ 内模型(2)存在着两个平衡点Q∗0和Q∗1,且Q∗0是不稳定点.根据式(8)计算出模型(2)的特征值知,只有∂Γ 上初值(T10,0,0,C10)出发的轨线最终趋于唯一的平衡点Q∗0,其它轨线都将远离Q∗0.因此Q∗0是∂Γ 上孤立的最大紧的不变集.因而,存在正的常数a,对于从在Γ 的内部出发的模型(2)解有

由此模型(2)的解不会跑出∂Γ,从而,有Ws({})∩◦Γ=ϕ,其中

综上,当R0>1 时,模型(2)在空间区域Γ 内是一致持久的[13].
现考虑系统

其中F为Rn的连续函数,D ⊂Rn是连续的开集,X ∈Rn.令X(t,X0)是系统(11)的解,初始条件为X(0)=X0,假设:
1) 系统(11)存在吸引子集K ⊂D;
2) 系统(11)在D内有唯一的平衡点X∗.
引理2[14]如果假设(1)、(2)成立,且存在Lyapunov 函数L(X)、有界可导函数G(X)、正常数a1、g和a2满足:
(i)a1|X|≤L ≤a2|X|;
(ii)L′(X)≤(G′(X)−g)L(X);
则系统(11)的平衡点X∗是全局渐近稳定点.
定理4当R0>1 时,模型(2)的有病毒平衡点Q∗1是全局渐近稳定点.
证明 由式(7),可得模型(2)在Q∗1处线性近似方程对应的特征方程为
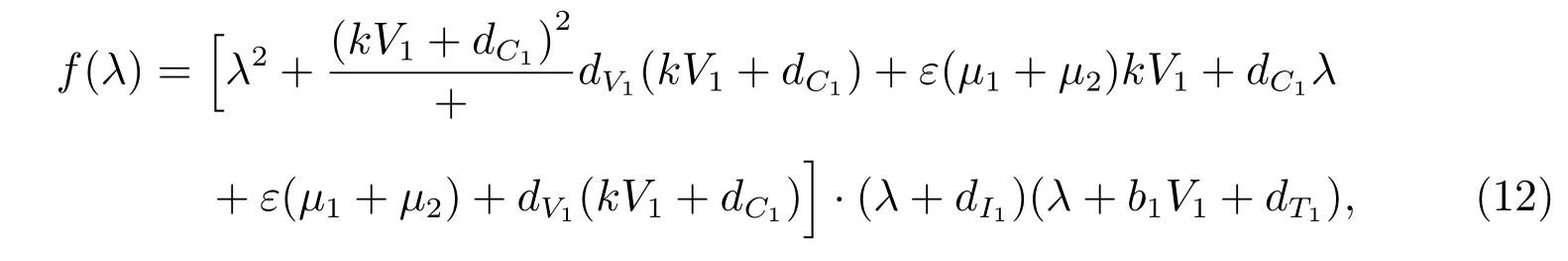
则由式(12)知,模型(2)的所有特征根均为负特征根.
由Routh-Hurwitz 定理[11]知,当R0>1 时,有病毒平衡点Q∗1是局部渐近稳定点.
再由式(7)可计算出模型(2)的第三加性复合矩阵为[15]

其中
a11=−b1V1−dT1−dI1−εC1−dV1, a22=−b1V1−dT1−dI1−kV1−dC1
a33=−b1V1−dT1−εC1−dV1−kV1−dC1, a44=−εC1−dI1−dV1−kV1−dC1.
式(13)对应的线性复合系统为

构造Lyapunov 函数
L(t,X,Y,W,Z)=max{C1|X|, V1|Y|, I1|W+Z|, I1|W|, I1|Z|}.
由定理3,在Γ 内存在a1>0, a2>0,使得

下面计算L的导数.
1) 若取L=C1|X|时,有V1|Y|≤C1|X|,可计算

其中G1=lnC1, g1=dT1+dI1+dV1.
2) 若取L=V1|Y|时,有C1|X|≤V1|Y|,则可计算

其中G2=lnI1+lnV1, g2=dT1+dC1.
3) 若取L=I1|W+Z|时,有V1|Y|≤I1|W+Z|,则可计算

其中g3=dT1+dI1+dC1.
4) 若取L=I1|W|时,有V1|Y|≤I1|W|,则可计算


其中g4=dT1+dC1.
5) 若取L=I1|Z|时,则可计算
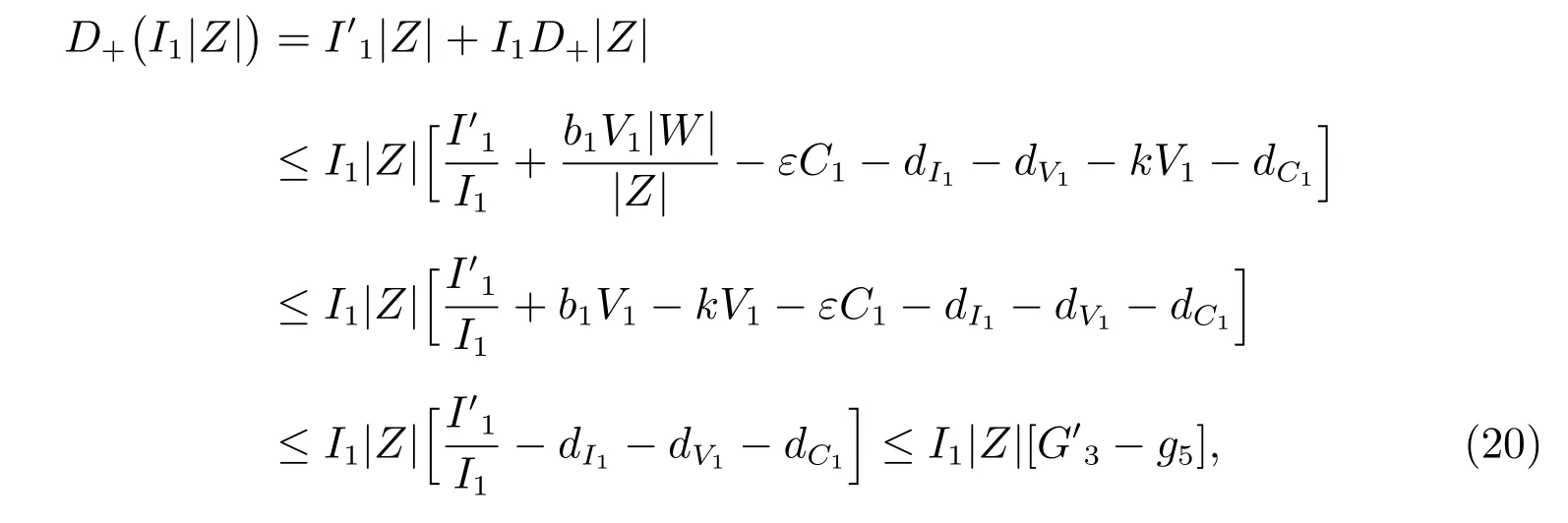
其中G3=lnI1, g5=dI1+dV1+dC1.
由式(16)–(20),可有
D+L ≤[G′−g]L,
其中G′=max{G1,G2}, g=min{g1,g2,g3,g4,g5}.
由引理2 知,模型(2)的有病毒平衡点Q∗2是全局渐近稳定点.
3.2 胎儿模型(3)的稳定性
在假设(1)的约定下,通过药物治疗后,母体内的HBV 最终趋于V ∗1,可以认为感染的母体输入给胎儿的HBV 量为¯η=ηV ∗1,由式(3)可得如下胎儿体内HBV 模型

同母体可行域Γ 的分析,可以求得方程(21)可行域为
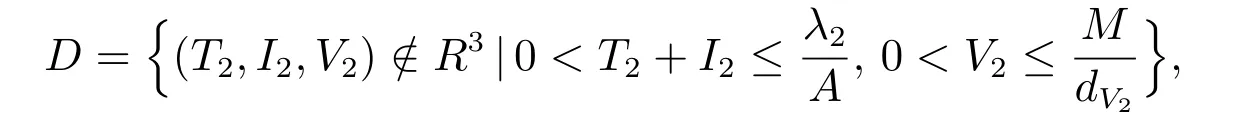
其中
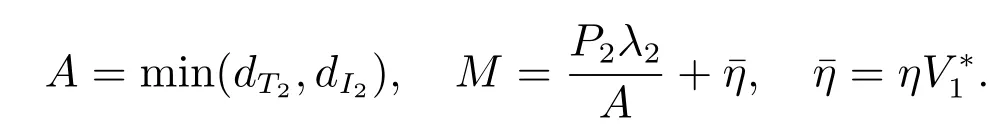
方程(21)的平衡点满足下列方程

整理得
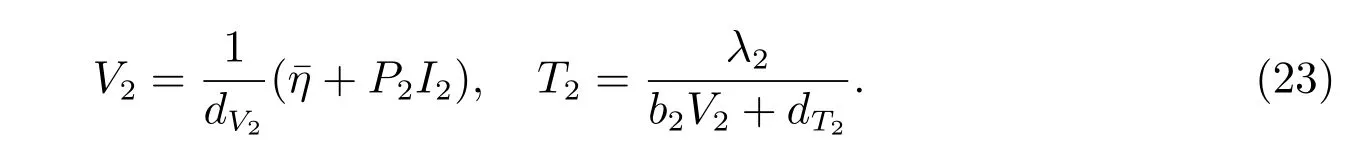
将式(23)代入式(22)中第二个方程,得

由二次函数性质知,f(I2)=0 存在唯一正根,使得f()=0.再将代入式(23)中,可得到方程(21)唯一的有病毒平衡点.
定理5当R0>1 时,模型(21)存在唯一的有病毒平衡点是全局渐近稳定的.
证明 模型(21)的Jacobi 矩阵为

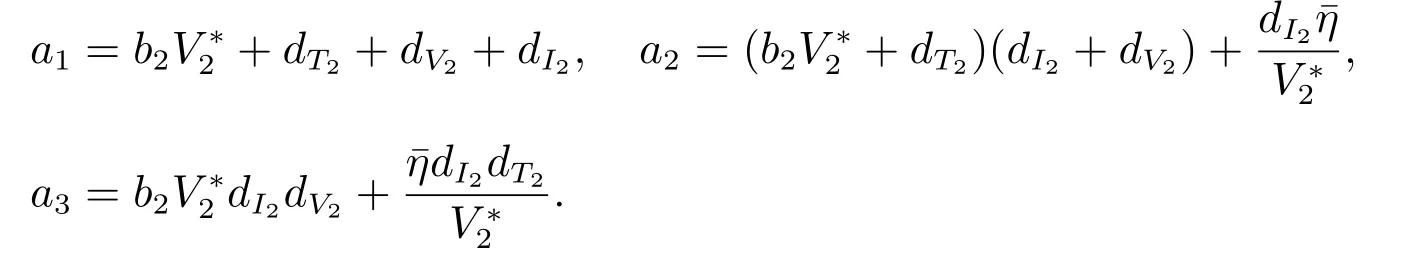
计算

显然有a1> 0, a3> 0,且a1a2−a3> 0.由Routh-Hurwitz 定理[11]知,有病毒平衡点是局部渐近稳定的.
模型(21)对应以ω为周期的任意周期解P(t) = (T2(t),T2(t),V2(t))的二阶复合系统为[15]

做Lyapunove 函数

由区域D内只含有稳定平衡点Q∗2,故存在c1,使得L ≥c1sup{|X|,|Y|,|Z|}.
将对(24)式求右导数,有
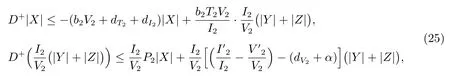
其中α=min{dT2,dI2}.
由式(25)得

其中

再由式(21)可知

由式(26)可得
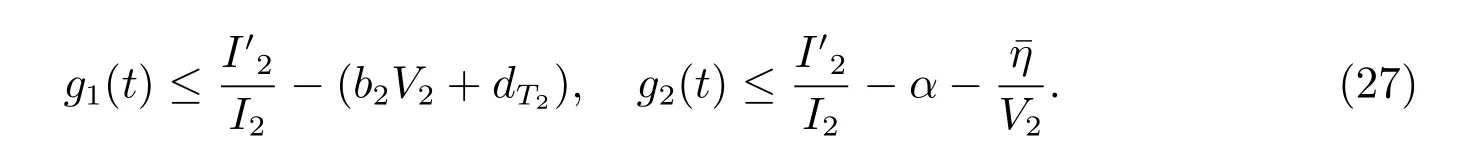
取

由式(27)知

由此可知,方程(24)零解是稳定的.
另一方面,取H= diag(−1,1,−1)可证明的非对角线元素非正,模型(21)是竞争系统,即模型(21)满足Poincare-Bendixson 性质,由文献[11]知,模型(21)有病毒平衡点是全局渐近稳定.
4 模型应用
目前,用HBIG 阻断携带HBV 的母体感染胎儿的治疗方案没有明确统一的标准,但已取得了阶段性的进展.临床实践中,通过检测治疗过程中母体的HBV-DNA 数据(其与HBV 存在正相关关系)来确定治疗效果.并认为HBV 携带者与感染者之间存在着临界值,若检测结果没有超过临界值,可以视为HBV 转阴,无传染性可能.因此,用药原则遵循着母体内HBV 不应超过临界[7].根据检测到母体HBV-DNA 数据,可以定性推测胎儿感染HBV 可能性.用数学模型可以定量分析母婴体内HBV 数量变化趋势,预测胎儿体内HBV 数量的变化情况.并且通过调整模型的参数,进一步优选用药量使得母体的HBV 控制在临界值之下.其中HBV-DNA 的临界值为277,HBV 的临界值为1000[7].模型(1)中参数见表2[16].

表2 模型相关参数数值表
下面根据模型(1)结果和表2 中乙肝患者的相关参数选取,针对于HBIG 治疗HBV 孕妇案例,分析模型结果的合理性,数值模拟HBIG 剂量对母体内HBV 的数量影响,预测胎儿感染HBV 数量的变化情况.
案例:孕妇怀孕第20 周,孕期检查时发现孕妇体内携带HBV,检测HBV-DNA 没有超过临界值为277,认为还没有发病.为避免将病毒传染给胎儿,在家属知情的情况下,对孕妇进行注射HBIG 的阻断治疗.治疗期间检测到母体内HBV-DNA 含量如下表3.采取的治疗方案是标准用药方案,即每月注射一针HBIG,每次剂量200 IU,直至分娩[17].

表3 孕妇血清中HBV-DNA 含量
由表3 中数据可以绘制出治疗期间孕妇血清中HBV-DNA 含量的曲线如下图1.
由图1 可以看出,在怀孕20 周时开始用药,母体内HBV-DNA 含量先增加,到了第22 周左右时达到峰值,随着时间的推移,母体内HBV-DNA 含量逐渐减少,直至40 周后趋于平稳.
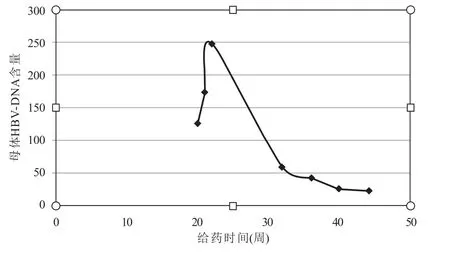
图1 母体内HBV-DNA 含量
4.1 模型的合理性分析
结合案例数据,用模型(1)数值模拟母体HBV 数量变化趋势,分析模型结果的合理性.选取母体内的HBV 数量的初值V1(20)<,将表2 中数据代入模型(1),计算出R0= 1.05> 1,由定理4 知病毒平衡点是全局渐近稳定点.应用Matlab 软件对模型(1)分别数值模拟出母体、胎儿体内的HBV 数量随时间变化的曲线图像如下图2 和图3.

图2 当µ2 =200IU 时,母体内V1(t)随时间的变化曲线

图3 当µ2 =200IU 时,胎儿体内V2(t)随时间的变化曲线
从图2 可以看出,在20 周时接受治疗,HBV 数量增加到第22 周时达到峰值,随后逐渐降低.图2 的HBV 数量曲线变化趋势与图1 反映的HBV-DNA 含量曲线变化趋势基本相同.在治疗期间内模型给出HBV 数量变化趋势与临床实际监测HBV-DNA 含量变化趋势一致,说明模型是合理的.同时,由图2 的数据可知,母体内HBV 达到的峰值数量900,低于在治疗期间(20 周–45 周)平均HBV 数量为483,HBV 数量在可控的范围内,降低了胎儿的感染HBV 的风险.由图3 数据可计算出孕期胎儿的HBV 数量是362.
4.2 药物剂量对携带HBV 孕妇病毒数量的影响
当孕妇携带HBV 的数量没有超过临界值数量时,胎儿感染HBV 风险很大.临床上应用HBIG 阻断HBV 在母婴间传播,4.1 中给出了标准用药方案下孕妇、胎儿体内HBV 数量,能够有效控制HBV 数量不超出临界数值.在不超出最小中毒剂量下,当增加用药剂量至时400IU[17],分析数值模拟HBV数量的变化趋势.选取母体内的HBV数量的初值V1(20) = 600<,其它参数仍取表2,计算出R0= 0.64<1.由定理3 知,无病毒平衡点是全局渐近稳定点.由于孕周期时间是有限的,在此只考虑45 周之内孕妇体内HBV 数量变化情况,用Matlab 数值模拟出母体、胎儿体内HBV 数量随时间变化的曲线图像如下图4 和图5.
由图4 数值可知,当改变药物剂量为时400IU,母体内HBV 数量峰值795 低于1000,平均病毒数量367.对比图2、图4,发现在孕期内HBV 数量均下降,说明调整剂量后的用药方案能更好的控制体内的病毒数量.由图5 数值可以计算出胎儿体内的HBV 的数量是340.由此说明增加药剂量可以快速降低母体内HBV 数量,胎儿的感染风险减小,达到更好的治疗效果.

图4 当µ2 =400IU 时,母体内V1(t)随时间的变化曲线

图5 当µ2 =400IU 时,胎儿体内V2(t)随时间的变化曲线
4.3 药物剂量对感染HBV 孕妇病毒数量的影响

图6 不同剂量下,母体内V1(t)随时间的变化曲线

图7 不同剂量下,胎儿体内V2(t)随时间的变化曲线
从图6 可以看出,随着药物剂量的增大,母体内HBV 的数量下降的速度越快,且在第12 周时HBV 数量分别为1050、830、810,说明给药剂量为200IU 时,不能严格的控制母体HBV 传染给胎儿,不能达到阻断的效果,通过剂量为400IU 与500IU 对比知,500IU 的母体内的HBV 数量下降得更快,则在临床实践中,在患者经济允许情况下,可适当地加大药物的治疗剂量,做出针对性的治疗方案.
