双硫仑联合铜通过调控视神经萎缩蛋白1诱导舌癌细胞凋亡
2021-05-07戴盼盼顾卫燕林海升施更生
金 杯,戴盼盼,孙 旺,顾卫燕,林海升,施更生
舌癌是常见的口腔恶性肿瘤,在所有口腔癌患者中的构成比为 32.5%~50.6%,并且手术治疗难度大,对放化疗特异性不佳,综合疗效不理想[1]。因此,寻找新的治疗方法具有重要意义。双硫仑(disulfiram,DSF)多年来被用于治疗慢性酒精中毒,近年来研究发现其与临床相关浓度的铜结合对多种恶性肿瘤显示出抗癌作用,但是与舌癌相关的研究甚少,具体机制尚不明确。视神经萎缩蛋白1(optic atrophy 1,OPA1)调控线粒体的网络融合,与线粒体功能密切相关,并在细胞凋亡中发挥了重要的作用[2]。此外,研究发现OPA1与肿瘤的恶性变有关[3]。因此,本研究探讨DSF-Cu对舌癌细胞Cal-27凋亡的影响以及OPA1在其中的作用,为DSF-Cu在临床上的应用提供实验依据。
1 材料与方法
1.1 主要材料与仪器
舌鳞状细胞癌细胞Cal-27(上海中乔新舟生物科技有限公司,批号ZQ0606);MEM细胞完全培养基(上海中乔新舟生物科技有限公司,批号ZQ-301);胰蛋白酶(美国Gibco公司,批号25200-056);DSF(美国Sigma公司,批号86720);氯化铜(美国Sigma公司,批号C3279);(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)(美国Sigma公司,批号M2128);二甲基亚砜(DMSO)(美国Sigma公司,批号D5879);Annexin V-FITC/PI细胞凋亡检测试剂盒(美国Sigma公司,批号APOBRDU);β-actin一抗(美国Sigma公司,批号A1978);ATP检测试剂盒(上海碧云天生物技术有限公司,S0026);OPA1(BD Biosciences,批号612606)。CO2恒温培养箱(Thermo,美国);酶标仪(Bio-TEK,美国);流式细胞仪(Becton,美国);电泳仪(BIO-RAD,美国);曝光仪(BIO-RAD,美国)。
1.2 方法
1.2.1 主要试剂配制 DSF经DMSO溶解并稀释成2 mmol/L,分装后-20 ℃保存;氯化铜用无菌PBS溶解配制成50 mmol/L后经孔径0.22 μm无菌过滤器过滤后4 ℃保存,临用前用培养基将上述溶液稀释成所需工作液浓度。
1.2.2 细胞培养及分组 将含100 U/mL青霉素G和100 μg/mL链霉素的MEM完全培养基培养细胞,置于37 ℃、5%CO2培养箱,待细胞长至70%~80%融合时,用胰蛋白酶消化传代。细胞处理:对照组:MEM完全培养基培养;DSF-Cu低浓度组:50 nmol/L的DSF-Cu培养24 h;DSF-Cu中浓度组:100 nmol/L的DSF-Cu培养24 h;DSF-Cu高浓度组:400 nmol/L的DSF-Cu培养24 h。
1.2.3 细胞增殖活性率检测 采用MTT法进行检测。将细胞以1×105个/mL的密度接种于96孔板,培养24 h后按不同分组处理后弃上清,换成无血清培养基,每孔加入20 μL 5 g/L的MTT,37 ℃、5%CO2培养箱避光培养4 h。小心吸弃孔内上清液,每孔加入150 μL DMSO,摇床上避光低速震荡10 min使结晶完全溶解,酶标仪490 nm检测吸光度值,实验重复3次。细胞增殖活性率=(各实验组吸光度值-调零孔吸光度值)/(对照组吸光度值-调零孔吸光度值)×100%。
1.2.4 细胞凋亡检测 采用Annexin V-FITC/PI双标记结合流式细胞仪进行检测。根据Annexin V-FITC/PI细胞凋亡检测试剂盒说明书进行操作,流式细胞仪检测细胞凋亡。
1.2.5 ATP含量检测 根据ATP试剂盒说明书进行操作,采用荧光素酶发光法以酶标仪检测细胞中ATP的含量。
1.2.6 蛋白表达检测 采用Western blot法检测。将蛋白提取定量后加入上样缓冲液,100 ℃煮沸10 min使蛋白充分变性。配制5%浓缩胶以及12%分离胶,每孔上样20 μg蛋白,SDS-PAGE电泳分离后湿转法将蛋白电转至PVDF膜,5%脱脂奶粉封闭,将膜分别转入含一抗的稀释液中(OPA1 1∶2 000,β-actin 1∶3 000),4 ℃孵育过夜,洗膜后二抗室温孵育1 h,化学发光成像仪曝光,扫描图像并用image J软件分析灰度。
1.3 统计学方法
采用SPSS 19.0软件对结果进行单因素方差分析以及 LSD-t检验,P<0.05认为差异具有统计学意义。
2 结 果
2.1 SF-Cu对Cal-27细胞增殖活性的影响
如图1所示,与对照组相比,50、100、200、400、600、800、1 000 nmol/L的DSF-Cu处理Cal-27细胞24 h后增殖活性均下降(P<0.05),并且浓度越高,抑制作用越大,呈浓度依赖性。
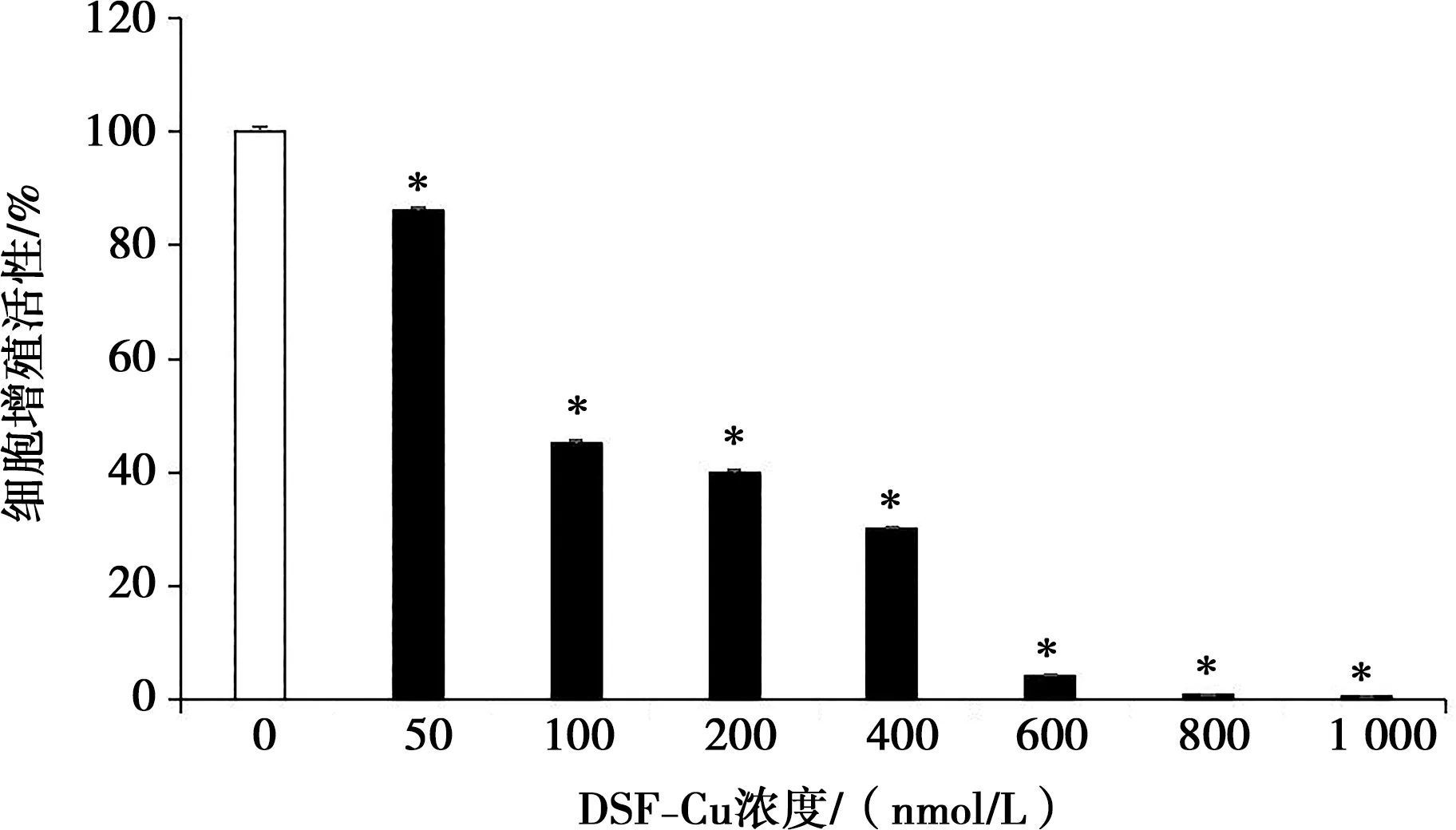
*表示实验组与对照组比较,P<0.05
根据MTT结果,100 nmol/L浓度的DSF-Cu处理后达到半数抑制率,而200 nmol/L的浓度与之比较结果相近,此外,考虑600、800、1 000 nmol/L的DSF-Cu处理后细胞多数死亡,分析意义不大,因此,本实验后续研究采用50 nmol/L低浓度、100 nmol/L中浓度以及400 nmol/L高浓度的DSF-Cu进行后续实验。
2.2 DSF-Cu对Cal-27细胞形态的影响
如图2倒置显微镜下( ×100)所示,与对照组相比,不同浓度DSF-Cu处理后细胞数目减少,细胞皱缩,贴壁不牢,并且浓度越高,抑制作用越明显。细胞状态与MTT结果相符。
2.3 DSF-Cu对Cal-27细胞凋亡的影响
应用流式细胞术比较DSF-Cu对Cal-27细胞凋亡的作用,如图3所示,50 nmol/L的DSF-Cu处理后与对照组无明显差异,而100、400 nmol/L的DSF-Cu处理后细胞早凋及晚凋率均显著增加,与浓度变化呈正相关,差异有统计学意义(P<0.05),说明DSF-Cu能够诱导舌癌细胞凋亡。
2.4 DSF-Cu对Cal-27细胞ATP含量的影响
与对照组相比,50 nmol/L的DSF-Cu处理后细胞ATP含量稍下降(P<0.05),而100、400 nmol/L的DSF-Cu显著降低了细胞的ATP含量,其中400 nmol/L的浓度抑制作用最强,说明DSF-Cu对ATP生成的抑制作用与浓度相关(图4)。
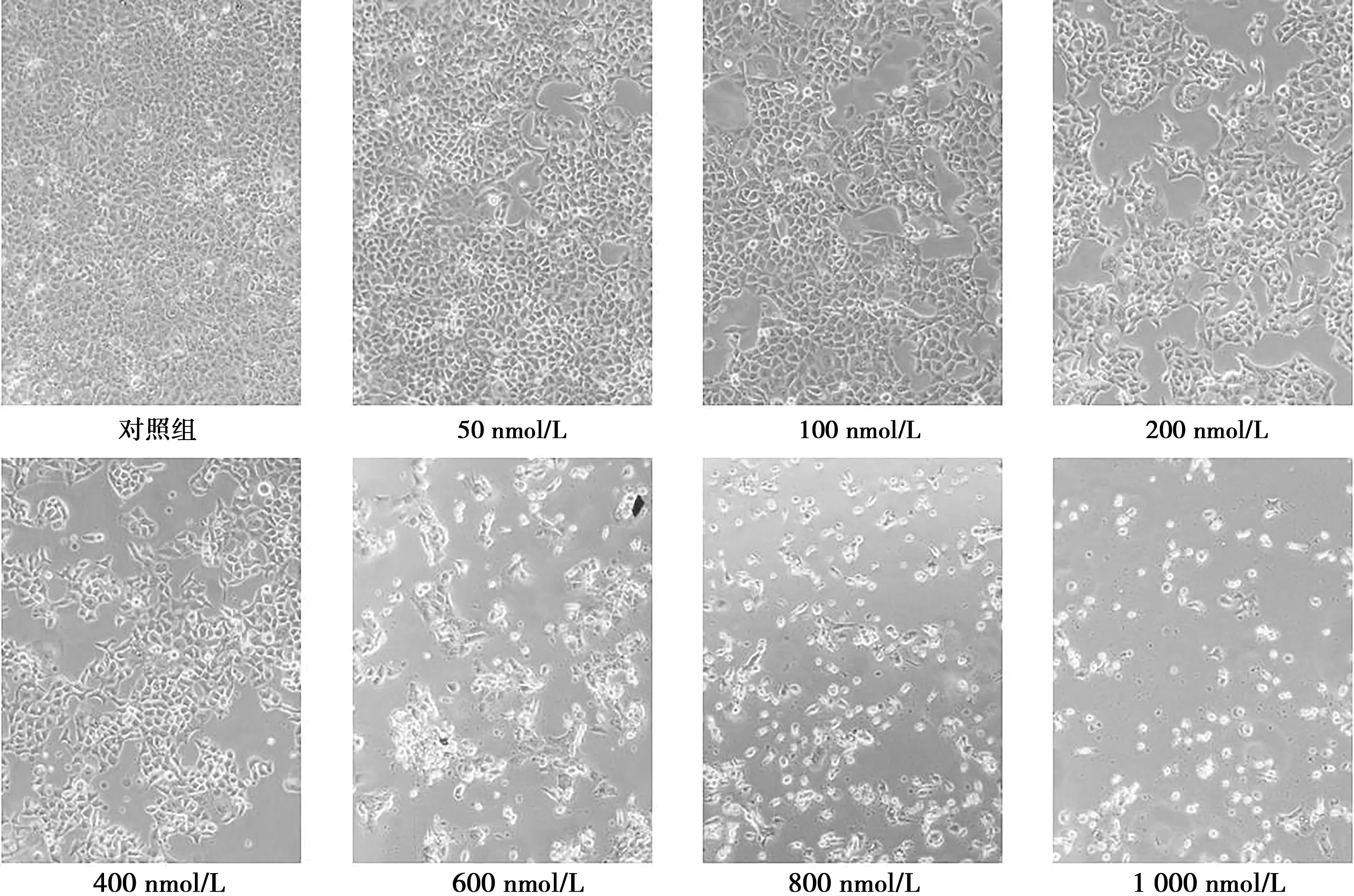
图2 不同浓度DSF-Cu对Cal-27细胞形态的影响( ×100)Fig.2 The effect of DSF-Cu on the morphology of Cal-27 cells( ×100)

A: 0 nmol/L的DSF-Cu; B: 50 nmol/L的DSF-Cu; C: 100 nmol/L的DSF-Cu; D: 400 nmol/L的DSF-Cu

*:与对照组比较,P<0.05
2.5 DSF-Cu对OPA1蛋白表达的影响
DSF-Cu对舌癌细胞OPA1蛋白表达水平影响结果如图5所示,低浓度50 nmol/L的DSF-Cu对OPA1蛋白表达水平无明显影响,而高浓度100、400 nmol/L的DSF-Cu处理后OPA1蛋白表达水平较对照组显著下降(P<0.05),但两者之间比较差异无统计学意义。
3 讨 论
口腔癌是世界排名第十六的常见肿瘤,据估计,仅2018年就新诊断出35.5万病例,超过17.7万人死亡[4]。舌癌发病率居口腔癌首位,近年来在年轻人中发病率逐渐增加,尤其是在年轻女性中[5]。由于舌癌发病位置特殊,术后对颌面形态、功能及生活质量均有影响,且手术难度高, 放化疗疗效不佳,五年生存率仅为50%~60%[1],因此寻找疗效高、副作用小的替代药品尤为迫切。考虑到诸如成本低、风险低和耗时少等优点,将已获批准的药物重新用作新的抗癌药物是一种有前景的策略。

*:与对照组比较,P<0.05
DSF用于抗酗酒治疗已经有60多年的历史。在过去的十年中,越来越多的证据表明DSF在治疗人类癌症方面具有巨大的潜力。DSF的抗癌活性已在体外和体内模型中得到验证[6-7]。目前已证实DSF可以使肿瘤细胞对放疗敏感,并增强抗癌药的细胞毒性,可以作为辅助治疗。DSF能通过靶向作用于醛脱氢酶(一种癌症干细胞的标志物)抑制癌症干细胞,此外,DSF还能诱导癌细胞凋亡,抑制癌细胞增殖及转移[8-9]。研究表明,DSF是强金属螯合剂,与Cu离子结合形成二乙基二硫代氨基甲酸铜[Cu(DDC)2]络合物,具有优异的抗癌功效[10],但其在舌癌的研究甚少,并且相关机制尚不明确。本研究结果显示,DSF-Cu有抑制舌癌细胞增殖、诱导其凋亡的作用,并且呈浓度依赖性,符合既往研究结果。
线粒体是细胞的动力工厂,其损伤会导致细胞能量生成障碍,进而细胞功能失调,最终发生病理性凋亡[11]。研究发现,线粒体靶向药物通过线粒体功能障碍触发癌细胞的凋亡较其他药物更有效[12],改变线粒体代谢可能是治疗癌症的潜在方向。已有研究证实,DSF-Cu能够导致线粒体活性氧增加,膜电位降低,引起线粒体功能紊乱,诱导乳腺癌细胞[13]、脑癌细胞[14]凋亡。本研究检测DSF-Cu处理后的细胞ATP含量发现,DSF-Cu显著降低癌细胞ATP含量,并且与处理浓度呈正相关,说明DSF-Cu诱导舌癌细胞凋亡可能与线粒体功能障碍有关。
线粒体稳态的维持、有效的呼吸作用和线粒体DNA的遗传取决于线粒体膜的正确结构以及内膜的动态重塑。OPA1位于线粒体内膜中,是调节线粒体融合的主要蛋白,参与线粒体的分裂、融合,维持线粒体的动态平衡及功能[2]。线粒体分裂、融合的不平衡会导致线粒体动力学改变,进而出现线粒体功能紊乱,导致细胞凋亡[15]。最新研究表明,OPA1与肿瘤的恶性生物学行为有关[16-18]。应用抗肿瘤药物可以有效抑制OPA1表达,破坏线粒体动力学平衡,已被证实能导致乳腺癌细胞[19]、骨肉瘤细胞[20]凋亡。本实验采用Western blot检测舌癌细胞中OPA1蛋白的变化,结果显示中、高浓度的DSF-Cu能够下调OPA1蛋白表达水平,这提示OPA1参与了DSF-Cu诱导的舌癌细胞凋亡。
综上所述,DSF-Cu可以抑制舌癌细胞增殖,促进其凋亡,其机制可能是通过抑制OPA1蛋白的表达,进而导致线粒体功能紊乱,ATP合成减少来作用。本研究结果有望为DSF-Cu在抗癌治疗方面的应用提供理论基础。
