社区获得性肺炎患者肿瘤坏死因子α-308位点基因多态性与多药耐药菌感染的相关性
2021-05-07邓鸿飞崔宏娣
邓鸿飞,李 双,崔宏娣
(郴州市第一人民医院,湖南 郴州 423000)
伴随人口老龄化、宿主免疫损伤的增加以及广谱抗菌药物的大量使用,导致社区获得性肺炎(community acquired pneumonia,CAP)致病原发生了重大改变[1].CAP是指医院外罹患的感染性肺实质炎症,其中革兰阳性菌和革兰阴性菌均会导致多重耐药的产生,包括铜绿假单胞杆菌、肺炎克雷伯菌以及肺炎链球菌等[2-3].因此,积极探寻CAP患者多重耐药菌感染的机制尤为重要.
组织的炎症反应是导致肺组织损伤的重要原因,肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)是一个多功能的细胞因子,在炎症的介导中发挥重要作用.既往研究[4]大多探讨TNF-α-308基因多态性与医院获得性肺炎(hospital acquired pneumonia,HAP)易感性的相关性研究,TNF-α-308位点G转向A可能是增加HAP患者的死亡风险.另外,多药耐药菌感染也是导致HAP死亡的重要原因[5],但是有关其与CAP患者多重耐药菌感染之间的相关性却少见报道.本研究旨在探讨TNF-α-308位点G/A基因多态性与CAP患者多重耐药之间的关系.
1 材料与方法
1.1 研究对象
选取郴州市第一人民医院2018年1月—2019年12月收治的140例社区获得性肺炎患者,所有患者均符合社区获得性肺炎诊断标准.其中,男78例,女62例,年龄42~63岁,平均(52.5±10.2)岁.140例CAP患者中非多药耐药菌感染者20例,革兰阳性菌感染者76例,革兰阴性菌感染42例,其他耐药菌22例.另外选取97例健康体检中心的受试者,其中,男50例,女47例,年龄39~64岁,平均(51.2±12.4)岁,两组人员在年龄、性别上无显著性差异.
1.2 方 法
1.2.1 基因组DNA抽提
人外周血白细胞基因组DNA抽提:取对照者和患者清晨空腹静脉血5 mL,EDTA-2K抗凝,使用西安天隆科技有限公司的全血核酸提取试剂盒(磁珠法)和西安天隆科技有限公司的NP968全自动核酸提取仪进行抽提.
1.2.2 基因多态性分析
位点-308A/G的基因分型采用TaqMan 探针 SNP 基因分型技术对rs1800629位点进行分型:引物和探针由生工生物工程(上海)股份有限公司定制完成.见表1.PCR 反应试剂 TaqMan Universal PCR Master Mix 由ABI公司提供,所使用的仪器为ABI QuantStudio 5实时荧光定量PCR 仪,反应体系:10 × Taq buffer (Mg2 +plus) 4 μL,2 UHS-Taq 0.4 μL,25 mmol/L dNTP 0.32 μL,100 μmol/L上、下游引物各0.08 μL;基因组DNA 20 μL,ddH2O 补足至30 μL,反应条件50 ℃ 2 min,95 ℃预变性10 min,95 ℃变性15 s,56 ℃退火1 min,共45个循环,40 ℃延伸5 min.以水代替模板DNA作为阴性对照.RT-PCR反应完成后读板,结果采用Quant StudioTMDesign and Analysis SE software分析.FAM通道为阳性表示携带G等位基因;ROX通道为阳性表示携带A等位基因;VIC通道为内标基因,扩增曲线有明显指数增长即表明实验有效.
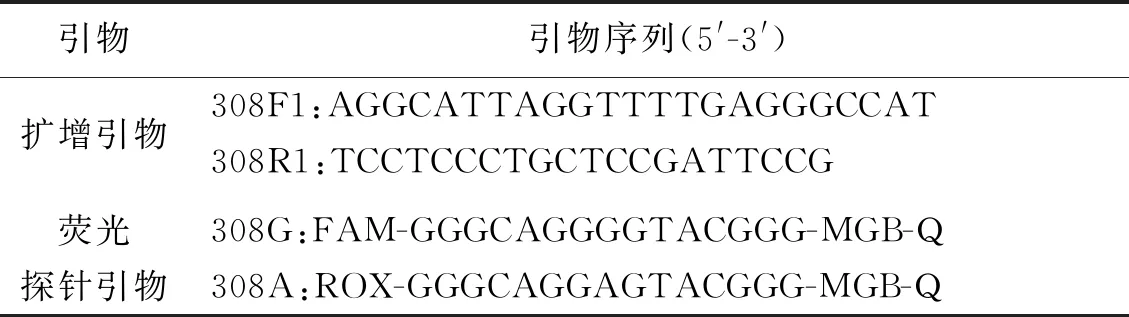
表1 TNF-α基因引物、探针序列
1.3 酶联免疫吸附法(enzyme-linked immunoso- rbent assay,ELISA)测定TNF-α含量
分别抽取对照组和CAP组静脉血3 mL,设置3 000 r/min离心10 min,分离得到血清,利用ELISA试剂盒测定血清中TNF-α含量.
1.4 统计学分析

2 结 果
2.1 TNF-α-308位点基因型和等位基因频率
TNF-α-308位点基因多态性实时荧光定量PCR TaqMan检测结果见图1.CAP患者与正常对照组 TNF-α-308位点的GG、GA、AA基因型频率见表2.经过Hardy-Weinberg遗传平衡(χ2值分别为0.887、0.678和0.769,均P>0.05)检测,具有群体代表性.与对照组比较,CAP患者中TNF-α-308位点GG、GA、AA基因型频率和G、A等位基因频率无显著性差异(P>0.05).与对照组比较,CAP感染多重耐药菌组患者GG、GA、AA基因型频率和G、A等位基因频率比较差异具有统计学意义(P<0.01).CAP患者与其多重耐药菌感染患者各基因型以及等位基因分布频率之间比较差异具有统计学意义(P<0.05)
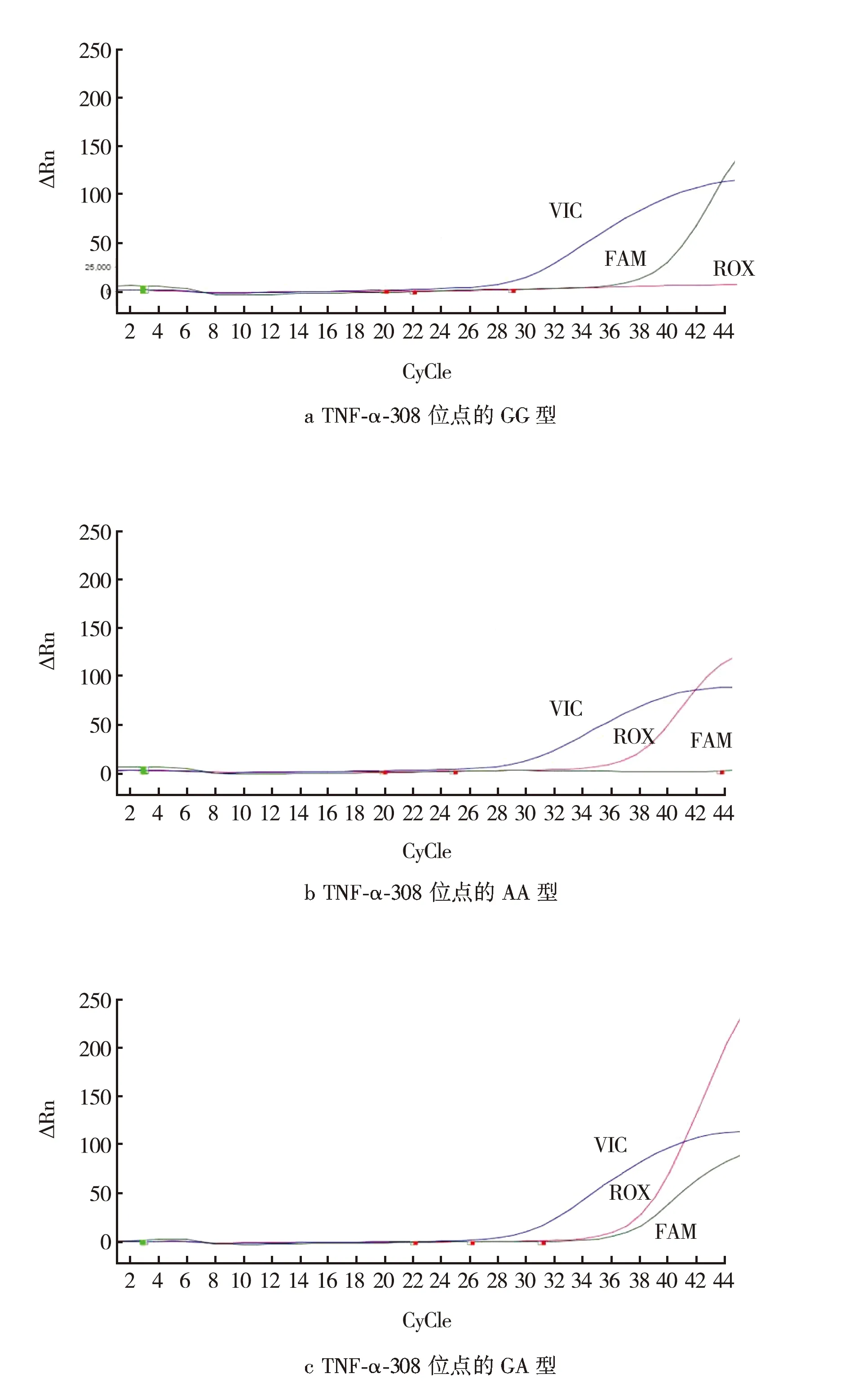
图1 不同基因型荧光定量PCR结果
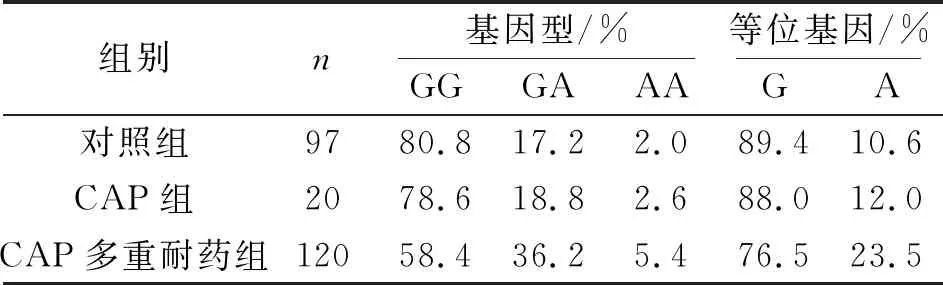
表2 各组TNF-α-308位点基因型和等位基因频率
2.2 CAP相对危险度
CAP和CAP多重耐药菌组感染者TNF-α-308位点GA、AA基因型、A等位基因的相对危险度(relative risk,RR)以及95%置信区间(confidence intervals,CI)见表3.
2.3 TNF-α-308基因多态性对CAP多药耐药菌感染预后的影响
CAP多重耐药菌感染组TNF-α-308位点基因型、等位基因频率与死亡组比较差异具有统计学意义(P<0.01).见表4.
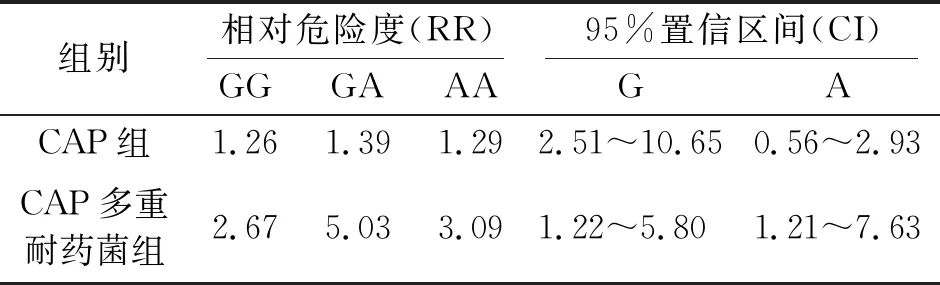
表3 TNF-α-308位点基因型和等位基因罹患CAP多药耐药菌感染的RR和95%CI
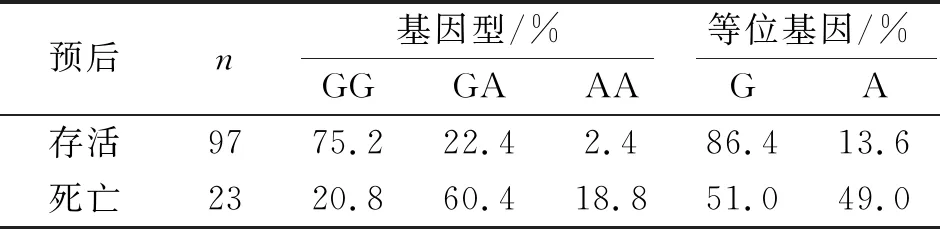
表4 TNF-α-308位点基因型和等位基因对CAP多重耐药菌感染患者预后的影响
2.4 CAP多重耐药菌感染患者不同基因型TNF-α水平
与对照组比较,CAP多重耐药菌感染患者TNF-α-308位点GG、GA、AA基因型血清TNF-α水平显著升高(P<0.05或P<0.01).与GG基因型患者比较,GA和AA基因型TNF-α水平显著升高(P<0.01),GA基因型与AA基因型CAP患者TNF-α水平无显著性差异(P>0.05).见表5.
表5 各组TNF-α水平
3 讨 论
CAP发病机制复杂多样,其中,细胞因子和炎症基因过多表达是导致肺炎发生的重要因素[6-8].TNF-α是一类重要的炎症细胞因子,位于6号染色体21区域3带[9].以往研究[10-11]发现:在肺部炎症患者肺泡清洗液中TNF-α表达显著升高.在肺部炎症中,TNF-α能够通过促进中性粒细胞表面的黏附分子表达及氧化自由基的释放,介导中性粒细胞黏附在肺毛细血管内皮,导致肺血管损伤.另外,有研究[12]也证实:TNF-α能够诱导多种细胞合成并分泌炎症介质,从而加重肺组织的炎症反应和损伤程度,因此,血清中TNF-α浓度可作为评价肺部严重损伤的一种重要参考指标.有研究[13-14]报道,TNF-α的基因多态性与疾病的发生发展密切相关,其主要涉及TNF-α基因1031位点T/C、863位点C/A、857位点C/T、308位点G/A以及238位点G/A的基因多态性[15],其中,TNF-α-308位点G/A的多态性与肺炎密切相关.进一步研究[16-17]发现:TNF-α-308位点A携带者比TNF-α-308位点G产生更多的TNF-α,活性更强.同时,TNF-α-308位点长度约为10 bp的DNA片段可能是激活子蛋白2(activator protein 2,AP-2)的识别序列,当308位点是G等位基因时AP-2可以识别相应的片段序列抑制TNF-α转录活性,若当G转化为A时,AP-2就无法识别,导致TNF-α转录活性显著升高[18].因此,通过探讨TNF-α-308位点G/A与TNF-α水平的关系以及其与CAP患者多药耐药菌感染的相关性分析显得尤为重要.
本研究结果显示:对照组及CAP组TNF-α-308位点基因型均以GG基因型频率最高,TNF-α-308位点AA基因型频率最低,符合Hardy-Weinberg相关的遗传平衡检验.与对照组和CAP组比较,CAP多药耐药菌感染患者TNF-α-308位点GG、GA、AA基因型频率和A、G等位基因频率差异具有显著性(P<0.01).而CAP组与对照组比较TNF-α-308位点GG、GA、AA基因型频率和A、G等位基因频率无显著性差异(P>0.05);CAP多药耐药菌患者相对危险程度、预后比较,TNF-α-308基因位点AA基因型或是A等位基因时,死亡风险显著增加.TNF-α水平是介导CAP损伤的重要炎症介质,CAP患者TNF-α-308位点为AA基因时,血清TNF-α水平最高.CAP患者TNF-α-308位点的基因型不同可能会影响TNF-α启动子的转录活性,导致膜TNF-α转向可溶性TNF-α.
综上所述,本研究初步证实了TNF-α-308位点G/A导致血清TNF-α水平升高,进而导致多药耐药菌感染CAP患者死亡风险增加,TNF-α-308G/A位点G /A 和AA型相对于GG型依然是CAP感染多药耐药菌危险因素.
