含Pb(II)废水的辐射还原处理及其机制
2021-05-06王志浩王运龙洪勇智
王志浩 王运龙 洪勇智 马 骏
(南京航空航天大学 材料科学与技术学院 南京211106)
工业化和城市化产生的有机物和重金属离子对水环境的污染正在严重威胁人类的健康。近年来,利用高能商业电子束射线处理水体中的污染物被认为是一种新的途径,国内外研究人员对水溶液中有机物的辐射分解机理进行了大量的研究[1-2]。但使用辐射法处理废水中的重金属离子的研究较少,特别是对辐射还原过程中影响去除效率的因素研究仍不充分。
含重金属离子废水具有来源广泛,排放地点分散,污染面积较大,污染物浓度不稳定,难于控制等特点,这使得其处理难度较大。传统的处理方法有中和法、吸附法和人工湿地法等,但这些方法存在成本高,生成物不稳定和处理时间长等问题。因此,根据重金属离子废水的形成和危害特点,研究和探索一些更经济高效的处理方法是目前废水处理领域重点关注的焦点[3]。
辐射技术还原处理重金属离子的研究可以追溯到20世纪70年代末,研究表明一定剂量的电子束辐照能还原水溶液中有毒的金属盐[4],将其转化为稳定的价态,使其不易被植物吸收,从而有效地降低其毒性及其对生态环境的影响;此后,Lyu 等[5]研究了电离辐射对污泥和重金属的影响,证实了利用辐射技术结合浮洗的方式可以有效去除工业废水中的汞。在辐射去除机制以及优化处理工艺方面,相关研究指出了羟基自由基屏蔽剂的重要性;Breitenkamp等[6]以甲酸或异丙醇(1 mol/L)为添加剂,研究了高氯酸铅和醋酸铅水溶液中Pb(II)的γ辐射还原,实验测定了铅离子的还原产额G为3/100 eV,研究表明氢自由基不能直接还原Pb(II),而是通过与Pb(I)络合-歧化反应进行还原;Chaychian[7]使用辐照法还原Pb(II)和Hg(II),实验结果显示,以乙醇作为羟基清除剂时,从1×10-3mol/L 溶液中去除96%的铅离子,需吸收剂量高达40 kGy;Drtinova 等[8]使用甲酸钾和异丙醇作为羟基清除剂,研究辐射诱导铅离子的去除,研究表明当甲酸钾浓度高于铅离子的浓度时,将会产生碳酸铅沉淀;上述结果表明屏蔽剂的种类会极大影响重金属离子的去除效率,因此设计新的对照实验以阐明其中的辐射还原与自由基转化机制是十分必要的。
国内的研究学者也对辐射技术应用于金属废水处理比较关注:袁守军等[9]利用电离辐射还原水中的六价铬离子,结果表明通入氮气会增强还原效果,氧气的存在会抑制还原;南京大学郭照冰老师课题组[10]研究了γ 射线去除镉离子和铅离子的效果,研究表明溶液的酸度越大,含氧量越低,越有利于铅离子的还原,此外,随着吸收剂量的增加,溶液的pH会降低,但其中的变化机理尚不清晰;中国科学技术大学林铭章老师课题组[11]提出了γ射线还原是分离放射性核素99Tc的有效方法,并对反应机理进行了详细的研究。上述研究工作表明,辐射技术是处理重金属与放射性核素污染的潜在途径之一,但其处理效率还与众多因素相关,需进行深入探索。
在实际应用中,含重金属离子废水的组成往往要比单纯的模拟溶液更为复杂。在矿山开采、金属冶炼与加工等行业中,废水中除含有大量的重金属离子污染物外,还具有不同含量的固体颗粒悬浮物。此外,在电镀等重金属离子污染行业所产生的废水中,重金属离子浓度通常较高,其辐射还原机理可能与通常研究中所使用的稀溶液体系存在差异。为了考察辐射技术在真实环境中的适用性,研究低浓度固体杂质存在及不同重金属离子浓度下的辐照还原机制是非常有必要的。本文以Pb(II)为例,考察了不同气体氛围、阴离子种类、羟基清除剂、Pb(II)浓度以及硅溶胶含量等因素对重金属离子去除的影响。
1 材料与方法
1.1 原料与试剂
氯化铅(PbCl2,分析纯,99.5%)、高氯酸铅(Pb(ClO4)2·3H2O,97%)、乙 酸 铅(Pb(C2H3O2)2,分析纯,99.5%)、两种不同粒径纳米二氧化硅(99.5%,直径(15±5)nm;(50±5)nm)均购自上海麦克林生化科技有限公司;甲酸(HCOOH,分析纯)、甲醇(CH3OH,分析纯)、乙醇(C2H5OH,分析纯)、异丙醇((CH3)2CHOH,分析纯)、叔丁醇((CH3)3COH,分析纯)均购自南京化学试剂股份有限公司;中性硅溶胶(ZS-30,质量分数30%)购自浙江宇达化工有限公司;实验用水均为18 MΩ超纯水。(试剂性质:在20 ℃下氯化铅溶解度1 g/100 mL,在20 ℃下高氯酸铅溶解度440 g/100 mL,在20 ℃下乙酸铅溶解度44.3 g/100 mL)。
1.2 仪器
火焰原子吸收分光光度计,TAS-990,北京普析通用仪器有限责任公司;离心机,H1650-W,湖南湘仪离心机仪器有限公司;pH计,STARTER 3100,奥豪斯仪器(上海)有限公司。
1.3 方法
(1)溶液配制。配置不同浓度的Pb(II)溶液:1.035×102mg/L(0.5 mmol/L),2.07×103mg/L(0.01 mol/L),2.07×104mg/L(0.1 mol/L),8.073×104mg/L(0.39 mol/L);加入羟基清除剂:浓度为0.5 mmol/L 的铅离子溶液中分别加入1 mol/L 羟基清除剂(甲酸/甲醇/乙醇/异丙醇/叔丁醇),其他浓度铅离子溶液中加入1 mol/L 羟基清除剂(异丙醇)。在空气氛围下或通氮气15 min。
(2)γ射线辐照。将配置好的样品密封后置于南京航空航天大学辐照中心60Co 源(7.4×1015Bq)进行辐照,剂量率为0.48 kGy/h,剂量率使用Fricke剂量计进行标定。
(3)后处理与检测。辐照后的样品以11 000 r/min(8 150 g)的转速离心10 min,取上清液,按比例稀释后使用火焰原子吸收分光光度计进行检测。溶液中的Pb(II)离子浓度依据标准溶液的工作曲线(线性系数R2=0.999 8)计算。
2 结果与讨论
为了评估辐射技术处理重金属废水的可行性,并进一步优化相关工艺与缩减成本,需系统研究真实环境中不同变量的影响。本文在使用辐照还原法去除Pb(II)的过程中,研究了各类因素(包括吸收剂量、气体氛围、阴离子种类、羟基屏蔽剂、杂质颗粒、Pb(II)离子浓度等)对Pb(II)去除效率的影响。
2.1 气体氛围、阴离子种类和羟基屏蔽剂对Pb(II)去除效率的影响
稀水溶液的辐射化学效应主要是水辐解产生的自由基与溶质之间的反应引起的[12],初始自由基主要包括∙H、eaqˉ和∙OH,如式(1)所示[13]。
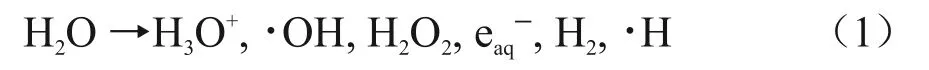
式中:eaqˉ是高效的还原性自由基(标准电势Eo=-2.87 V),可以将Pb(II)还原为Pb(I),经歧化反应后转化为固态Pb(0),氢自由基也是还原性自由基,但其不能直接将Pb(II)还原。Pb(II)的辐照还原途径见式(2)[14]。
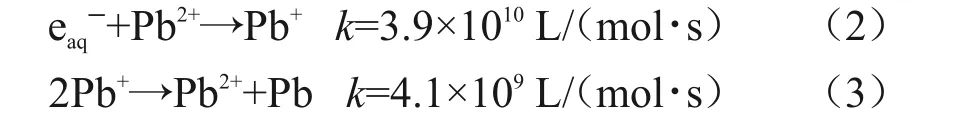
羟基自由基∙OH 是氧化性自由基,在中性和酸性溶液中,其氧化还原电位分别为1.90 V、2.72 V。它与还原性自由基竞争会抵消Pb(II)的还原,也可将被还原的Pb(II)重新氧化,见式(4)和(5)。

因此,为了抑制∙OH 对还原产物的氧化,在体系中添加了过量(1 mol/L)的羟基屏蔽剂来消除其影响。
在含铅废水的去除过程中,溶液的气体氛围(氮气与空气),阴离子种类和不同羟基屏蔽剂等都会对Pb(II)的还原产生影响。因此本文研究了上述条件下Pb(II)去除率随吸收剂量的变化(0.5 mmol/L Pb2+(如无说明默认为PbCl2)+1 mol/L羟基清除剂(如无说明默认为异丙醇)+不同气体氛围(如无说明默认为氮气氛围)),实验数据如图1所示。
2.1.1 气体氛围的影响
图1(a)为样品溶液(1.035×102mg/L 氯化铅,1 mol/L 异丙醇)分别在在氮气与空气氛围下Pb(II)去除率随吸收剂量变化的曲线。随着吸收剂量的增加,两种氛围下Pb(II)去除率均持续增加,但氮气氛围下去除效率与去除效果较空气氛围下高。例如,在氮气氛围下,当吸收剂量达到20 kGy 和50 kGy 时,Pb(II)的去除率已经达到70%和95%,而在空气氛围下,相应去除率仅为20% 和84%。溶液中的溶解氧(9.089 mg/L,20 ℃)可能通过两种途径影响Pb(II)的去除效率:第一,溶解氧可将还原后的0价铅重新氧化为二价铅[7];第二,溶解氧的存在会与水中的溶剂化电子、氢自由基和醇自由基反应[15-16],阻碍离子的还原。具体反应见式(6)~(9)。

图1 不同气体氛围(a)、不同阴离子(b)以及不同羟基清除剂(c)下Pb(II)去除率随吸收剂量的变化Fig.1 Removal ratios of Pb(II)with the absorbed dose under different gas atmosphere(a),different anionic(b),and different hydroxyl scavenger(c)
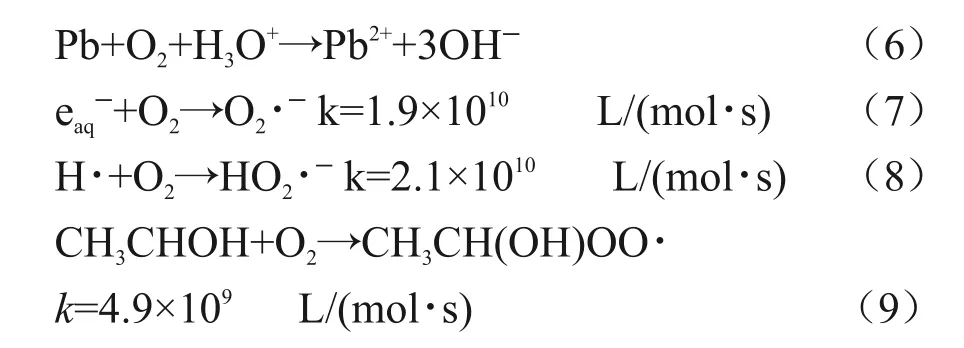
溶剂化电子与氧气反应过程中,按照近似一级反应,溶剂化电子的消耗速率为keaq-+O2[O2]=1.9×1010×2.8×10ˉ4=5.32×106sˉ1;溶剂化电子还原Pb (II) 时 , Pb (II) 还 原 速 率 为[Pb(II)] =3.9×1010×5×10-4=1.95×107s-1。 上两式为消耗eaqˉ竞争反应,溶剂化电子还原Pb(II)的速率为O2消耗溶剂化电子速率的3.7倍,故溶解氧影响Pb(II)去除的原因主要是其将还原后的零价铅重新氧化为二价铅。
氮气氛围下,还原速率随吸收剂量的增加而降低,这是由于随着Pb(II)不断被还原,溶液中Pb(II)的浓度下降,导致体系中还原反应速率变慢;相反,在空气氛围下,铅离子的还原速率随吸收剂量而增加,这是因为体系中的氧气不断被消耗,氧气参与的竞争反应逐渐消失,使得还原速率加快。因此,通过在辐照前去除溶液中的溶解氧能够提高Pb(II)的去除效率,降低去除Pb(II)所需的时间,此实验结果与袁守军等[9]和Guo 等[10]的实验结果一致。当吸收剂量为20 kGy时,溶液经氮气保护后提升效率最大,约空气氛围下的2.5倍。
2.1.2 不同阴离子的影响
图1(b)为不同阴离子对Pb(II)去除率的影响。当吸收剂量达到50 kGy 时,不同阴离子条件下的Pb(II)去除率近乎一致。由于过量异丙醇的存在,羟基自由基不和阴离子反应,在高氯酸根离子存在的体系中(初始pH=5.2),Pb(II)的去除率略低于氯离子和乙酸根离子体系(初始pH=6),这可能是因为不同溶液的初始pH 略有差异,导致自由基的活性不同。初始pH低的溶液中自由基的活性相对较低。
在水辐解产生的主要自由基中,起还原作用的主要是esolˉ(标准还原电位Eo=-2.87 V),且仅当pH<4 时,氢自由基才会发挥作用,因此氢自由基在中性或碱性溶液中不是重要的还原剂。尚云等[11]在研究辐射法去除水溶液中的铼时,发现随着NaOH/HCl 的增加,水中铼的去除率也随之增加,但随着pH的下降,由于初始产物的还原性下降,导致还原速率降低。由图1(b)结合pH测量结果可以看出,初始的pH相同时,图1(b)中Pb(II)的去除速率相同,初始pH 低,Pb(II)的去除速率低,这与尚云等的研究结果一致。由于不同阴离子存在的条件下初始pH差距较小,与还原过程中pH的变化相比可忽略不计。因此,随着吸收剂量的增加,不同阴离子Pb(II)溶液去除率差距逐渐减小,最终可忽略不计。
2.1.3 不同羟基屏蔽剂的影响
为了提高Pb(II)的还原效率,本文研究了5种典型的羟基屏蔽剂下Pb(II)去除量随吸收剂量的变化(羟基屏蔽剂自身的辐解产物影响忽略不计),如图1(c)所示。实验结果表明,羟基自由基清除剂对Pb(II)去除效果由高到低依次为甲酸>异丙醇>甲醇>乙醇>叔丁醇。该实验数据结果与自由基的动力学理论数据保持一致。
以甲酸作为羟基屏蔽剂的体系中,会发生如下反应[8],见式(10)~(13)。
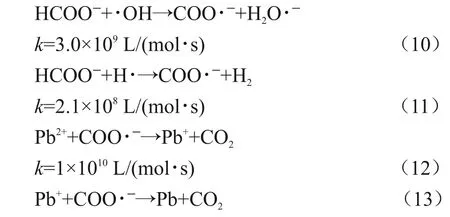
甲酸与羟基自由基和氢自由基反应后均能产生COO∙ˉ,COO∙ˉ可进一步将Pb(II)和Pb(I)还原为Pb(0)。
在以甲醇作为羟基屏蔽剂的溶液体系中,发生如下反应[17],见式(14)~(17)。
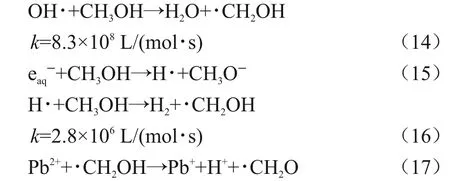
在甲醇体系中,甲醇自由基能够将Pb(II)还原为Pb(I),促进Pb(II)的还原。
在以乙醇作为羟基屏蔽剂的体系中,乙醇与羟基自由基和氢自由基反应见式(18)和(19)[18]。
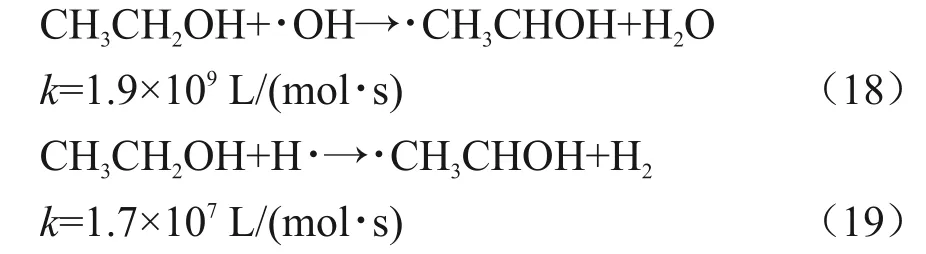
乙醇自由基和Pb(II)的反应被认为十分缓慢,反应速率常数k=3×104L/(mol∙s)[6]。但乙醇自由基却能够和Pb(I)快速反应,反应速率常数为k=1.7×109L/(mol∙s),反应见式(20)和(21)。
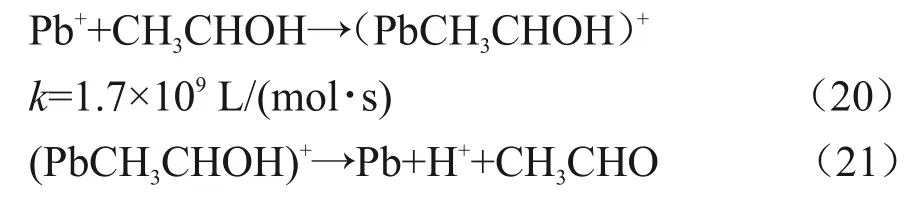
在高剂量下,会有如下乙醇自由基的反应与式(21)竞争[19],如式(22)所示。

异丙醇作为羟基自由基清除剂的体系中[20],异丙醇和∙OH 与H∙反应生成异丙醇自由基,反应见式(23)和(24)[21]。
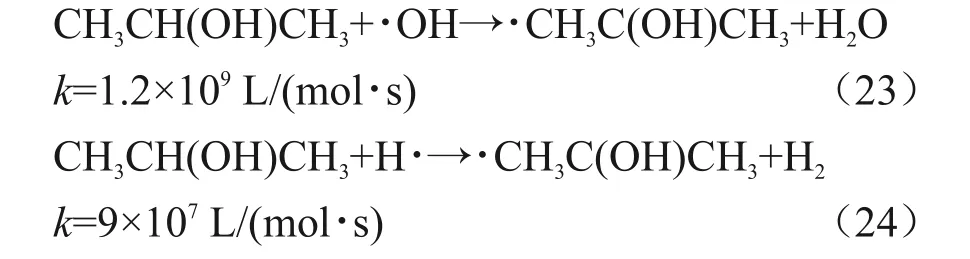
异丙醇自由基能够将Pb(II)还原为Pb(I),如式(25)所示[22]。
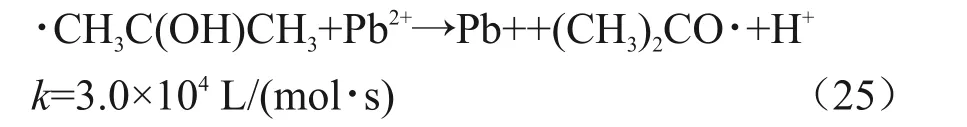
在以叔丁醇作为羟基清除剂的体系中,发生下列反应,见式(26)和(27)。

由叔丁醇形成的自由基的还原能力小于COO∙ˉ、甲醇自由基、乙醇自由基和异丙醇自由基[23],且叔丁醇自由基能够将Ni+和Cd+氧化为二价[24],因此,在叔丁醇体系中,Pb(II)还原效率低的可能原因见式(28)。
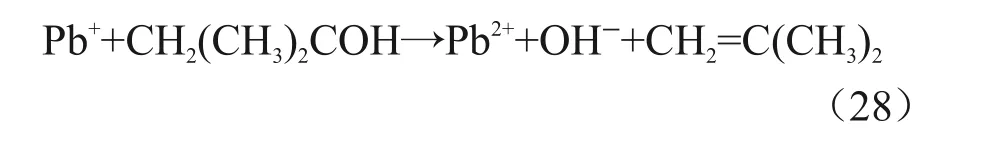
比较分析不同羟基清除剂清除羟基的能力及其产生的自由基与Pb2+的反应速率,结果表明,不同的羟基清除剂对Pb(II)还原效果由高到低依次为甲酸>异丙醇>甲醇>乙醇>叔丁醇,与图1(c)所示实验结果一致。由于COO·ˉ能够同时将Pb(II)和Pb(I)还原为Pb,而甲醇、乙醇、异丙醇等自由基仅能将Pb(II)还原为Pb(I),因此甲酸对Pb(II)还原效果的提高较低元醇类更为明显。因此,在辐射法去除重金属离子时,甲酸作为羟基清除剂是去除废水中重金属离子最好的辅助剂,在较小的吸收剂量(10 kGy)时,去除率已经达到78%。
2.2 高浓度Pb(II)辐照还原过程中热电子效应
重金属离子废水处理所面临的关键挑战之一为浓度跨度大,为了进一步优化工艺条件,需全面考察铅离子浓度的影响。前期皮秒脉冲辐解研究表明,当水溶液中重金属离子(如Cd2+)浓度较高时,有预溶剂化电子参与重金属离子的还原,且其反应速率常数通常高于溶剂化电子1~2个数量级[25]。为此,本文研究了不同Pb(II)浓度在辐照还原过程中随吸收剂量的变化(0.01/0.1/0/39 mol/L Pb2+(Pb(ClO4)2)+1 mol/L 异丙醇+氮气氛围),如图2所示。
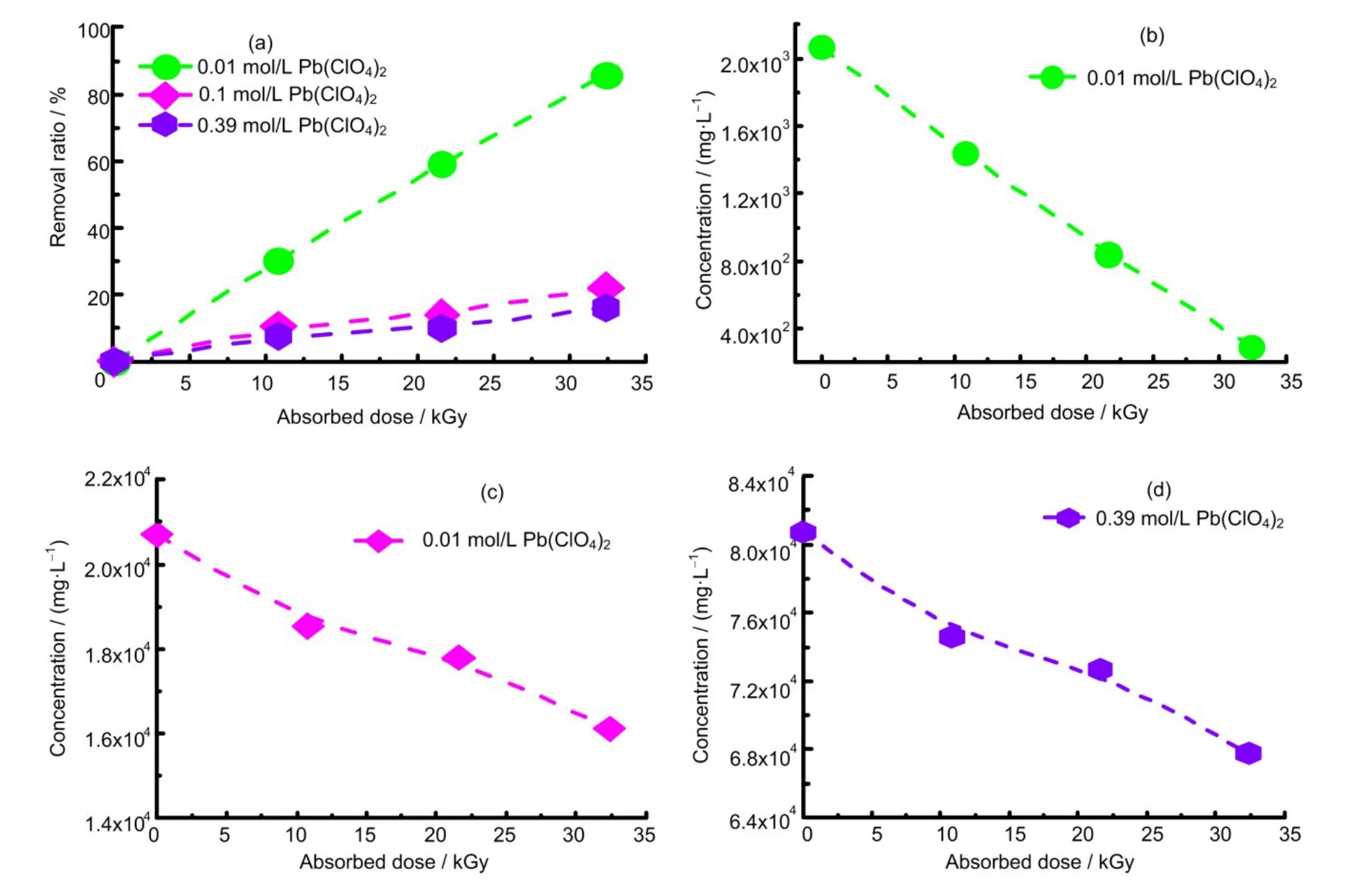
图2 不同浓度Pb(II)对还原的影响Fig.2 Effects of different concentrations of Pb(Ⅱ)on reduction
在以异丙醇作为羟基清除剂的溶液体系中,Pb(II)还原的理论产额G为G(Pb)=(1/2)G(eˉ)+(1/2)G(·H)+(1/2)G(·OH)。在稀溶液中(如2.07×103mg/L),相关的自由基扩散反应时间约为10-7s,因此,水辐解初始产物的G值/100 eV分别为G(eaqˉ)=2.7,G(·H)=0.6,G(·OH)=2.7。当溶液中Pb(II)的浓度升高到0.1 mol/L,其自由基平均反应时间为10-10s,此时的理论G(eaqˉ)=4.25,羟基产额为G(·OH)=4.8,实验结果高于理论产额,推测有预溶剂化电子参与了还原反应。然而,当Pb(II)浓度进一步升高到8.073×104mg/L(0.39 mol/L)时,实验所测Pb 去除的产额远高于理论值,推测除有预溶剂化电子参与反应外,还有其余途径导致铅离子的去除。Jonah 等[26]也曾对预溶剂化电子产额做出估计,当时间尺度为10-14s 时,其估计值约为5.4,相应羟基产额也大于4.8。
当溶质浓度高于2.07×104mg/L 时,溶质铅盐所沉积的射线能量较大,溶液吸收剂量不能再用D(H2O)近似,需要采用相应修正因子F(见式(29))进行修正。

式中:dsol为溶液密度;Z 为电子数;A 为质量数;p为溶质的质量分数。
此外,当铅离子浓度为0.01~0.1 mol/L 时,Pb(II)会和Pb(I)反应,与还原反应竞争,如式(30)所示[7]。
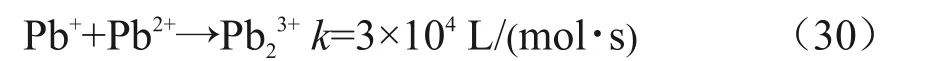
此反应速率远低于还原速率,且对火焰原子吸收分光光度计检测铅离子含量的结果无影响,故不考虑此反应。实验所测的Pb(II)的去除量产额如表1所示。
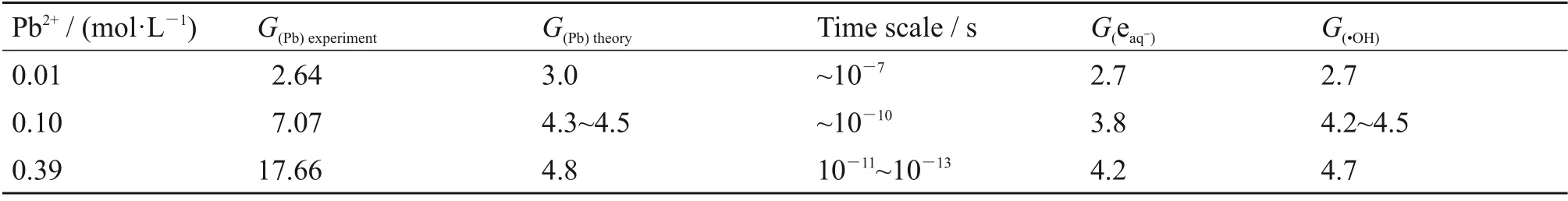
表1 不同浓度下Pb(II)在吸收100 eV能量的去除产额Table 1 Removal yield under different concentrations of Pb(II)after absorbing 100 eV
由图2 和表1 可以看出,随着Pb(II)浓度的增加,溶液中Pb(II)的去除量也在增加,且去除量产额高于稀水溶液辐解还原的理论条件下的G值,推测有预溶剂化电子参与了还原反应或其与高度激发的溶剂化电子前体H2O**发生了反应[27],详细反应机理还需后续进一步研究。但目前现象表明辐射技术对于处理高浓度的废水效率较高,对高浓度废水的处理尤其具有优势。
2.3 溶液中硅溶胶和纳米二氧化硅对Pb(II)去除的影响
在固-液界面辐射化学中,固体会吸收一部分能量从而被活化和离子化,并进一步将其电荷转移到液相中,该过程为固液两相中的能量转移过程[28]。在真实环境中,含铅废水一般不会是澄清的溶液,溶液中会含有少量悬浮杂质颗粒。本文将硅溶胶添加到溶液中形成悬浮液,模拟废水中的固体悬浮颗粒,同时使用固体纳米二氧化硅作为添加物进行对照(0.5 mmol/LPb2+(PbCl2)+1 mol/L异丙醇+氮气氛围+不同杂质颗粒),如图3所示。
很多研究表明,溶液中的固体添加物会对辐射化学反应产生影响。例如,水溶液辐解产生的氢气会随二氧化硅溶胶的浓度的增加,呈现先增加后减小的趋势[29]。在辐射场中,二氧化硅纳米颗粒吸收能量后,在固液界面处可发生电荷转移并产生水合电子[30]。对于金属离子的辐射还原,前期研究发现,较高质量分数(10%)的二氧化硅溶胶,能够提高辐射还原的效率[31]。本研究添加低浓度的纳米二氧化硅和二氧化硅溶胶,模拟了低浓度水体固态悬浮杂质对辐射去除重金属离子的影响。结果表明,与高浓度情况下不同,低浓度溶胶的存在对金属离子的还原起到抑制作用。
图3(a)和(b)表明,气相纳米二氧化硅纳米粒子的添加并不会影响Pb(II)的去除率,原因在于其在水中分散性能较差,从而产生团聚及沉淀,无法产生大量的固液界面,因而对辐射化学过程影响有限;与之相比,由于硅溶胶在水中具有良好的分散性,在水中分散后可以产生大量的固液界面。

图3 不同浓度的二氧化硅对Pb(Ⅱ)去除的影响Fig.3 Effects of different concentration of SiO2 on Pb(Ⅱ)removal
实验结果表明,同等质量分数硅溶胶的存在会显著抑制Pb(II)的还原,且在实验添加的范围内,随着硅溶胶质量分数的增加,其抑制效果相应增强。随着硅溶胶质量分数不断增加,Pb(II)的去除率会相应降低,当吸收剂量为80 kGy 时,加入5 mmol/L、25 mmol/L、50 mmol/L硅溶胶后,去除率仅为43%、37%、8.9%。其原因可能在于硅溶胶中的二氧化硅颗粒有较大的表面电势,能够和Pb(II)形成静电作用,使Pb(II)还原所需的电势升高,从而使相同剂量下Pb(II)的辐射还原去除率降低。在真实污水中,悬浮固体颗粒也可能会产生类似的结果,因此,在辐射还原去除金属离子的实际应用中,也应考虑并科学评估固体悬浮物的影响。
2.4 Pb(II)辐射还原过程中pH的变化
在辐射还原过程中,溶液的pH 也会随吸收剂量而变化,其趋势如图4所示。

图4 不同条件下辐解溶液pH的变化Fig.4 pH of radiolysis solution under different conditions
由式(18)、(22)、(26)可知,初始pH 较高的甲醇、乙醇、异丙醇体系中,有机溶液中被羟基自由基氧化后的醇自由基能够将Pb(II)还原,同时产生氢离子,因而溶液的pH随吸收剂量的增加而下降;而叔丁醇自由基无法将Pb(II)离子进一步还原产生氢离子,故添加叔丁醇的Pb(II)离子溶液pH下降幅度最小,其轻微下降可能是叔丁醇的辐解产生少量氢离子导致。郭照冰等[10]的研究也发现,随着吸收剂量的增加及金属离子的还原,溶液的pH 也随之下降,与本研究的结果一致。
与氮气氛围不同,空气氛围中的溶解氧会与氢离子、溶剂化电子反应,使得溶液的pH下降较小。与其他阴离子相比,由于乙酸根离子在水中会水解,故而乙酸铅溶液辐解过程中pH均高于其他阴离子溶液。而低浓度二氧化硅的添加,对溶液的pH几乎没有影响,pH随吸收剂量的变化与未添加杂质时并无区别。
在甲酸的酸性条件下,氢离子可以与溶剂化电子通过如下反应形成H·自由基,并成为主要的还原性物种,如式(31)所示。
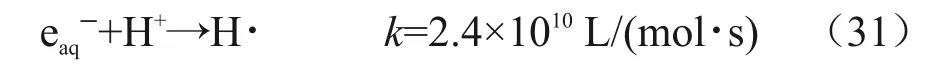
因而,在添加甲酸后,随着吸收剂量的增加,氢离子不断被消耗,使得溶液的pH随辐解进程反而升高。
3 结论
本文研究了不同条件下γ辐射去除废水中的Pb(II)的效果与机制。结果表明:Pb(II)的去除率随着吸收剂量而增加,通过优化条件,当吸收剂量为50 kGy 时,去除率可达98%。氮气氛围下Pb(II)去除率较空气氛围高,当吸收剂量为20 kGy时,去除率为空气氛围下的3.5倍;不同阴离子存在的体系中,阴离子对Pb(II)离子去除效率影响可忽略不计;添加不同羟基清除剂能显著提高Pb(II)的去除率,提升效果由高到低依次为甲酸>异丙醇>甲醇>乙醇>叔丁醇,甲酸的添加可以大幅降低处理所需的吸收剂量,仅在较小的吸收剂量(10 kGy)下,去除率就高达78%,因此,在辐射法去除废水中的重金属离子时,甲酸为效果最佳的羟基清除剂;Pb(II)的辐射还原产额随着Pb(II)离子浓度而增加,当Pb(II)浓度达到0.39 mol/L(80.73 g/L)时,其辐射去除产额为G=17.66/100 eV,远高于稀水溶液辐解还原的理论G值(4.8/100 eV),推测在高浓度下,除有预溶剂化电子或高度激发的溶剂化电子前体H2O**参与还原反应外,还有其余反应途径导致铅离子的去除。这表明废水中铅离子浓度较高时,辐射法去除铅离子较低浓度时更具有优势;此外,低浓度(5~50 mmol/L)硅溶胶的存在,大大降低了Pb(II)的去除率。这可能是由于硅溶胶具有负电性,与带正电的Pb(II)存在静电力导致还原电势升高造成,这为真实环境中辐射法去除废水中的重金属离子提供了实验依据与借鉴。本文对辐射还原Pb(II)离子废水各种潜在影响因素进行了研究,研究表明,使用γ射线辐照法去除水中的重金属是处理污染物的潜在途径之一,同时对其他放射性核素的辐射还原去除以及纳米金属催化剂的辐射合成,也提供了一些值得借鉴的经验和方法。
