Octavius1500 电离室矩阵基于模体和CT 影像剂量验证的分析
2021-05-06郭逸潇李亚洲刘志强缪国英蔡宏懿
郭逸潇 李亚洲 刘志强 缪国英 蔡宏懿
1(甘肃省人民医院放疗中心 兰州730000)
2(中国科学院兰州近代物理研究所生物医学中心 兰州730000)
利用各种影像引导设备,精准放射治疗技术已经实现了位置精准基础上的剂量精准。然而,由于治疗计划的制定和实施过程仍然存在不同程度的系统和随机误差,为检测患者治疗计划参数传输的准确性,确保治疗在容许的误差范围内传输计划的剂量分布,容积旋转调强放疗(Volumetric modulated arc therapy,VMAT)和快速旋转调强放疗(Volumetric modulated arc therapy,RapidArc,即瓦里安医疗系统容积调强的商品名称)技术在计划用于病人治疗前需进行三维剂量验证[1-2]。目前常用的三维验证系统(如Delta4、ArcCheck 和COMPASS),利用计划剂量扰动法(Plan dose perturbation,PDP)能够得到修正的3D 剂量分布[3-5],而Octavius 验证系统三维剂量重建无需治疗计划系统(Treatment planning system,TPS)的数据,且消除了角度依赖,在模体γ 分析的基础上,是否可实现此系统基于患者解剖结构的治疗前剂量验证,目前国内尚未见报道。Octavius二维矩阵所使用探测器的类型、尺寸以及相邻探测器之间的距离是保证其测量精度和分辨率的重要参数。常规的Oct729 矩阵由于单个电离室类型和尺寸限制,导致单位面积上探测器的个数非常有限,粗糙的分辨率和采样过疏致使3D剂量重建过程会导致更多的错误。而比Oct729 探头数目更多和空间分辨率更高的Oct1500电离室矩阵可得到更精确的3D 剂量数据[6]。本研究采用Oct1500 矩阵对甘肃省人民医院放疗中心106例RapidArc计划进行验证并与Oct729 结果对比,探讨此系统由平面测量剂量重建为3D剂量精度的影响因素和基于解剖结构验证的可行性。
1 材料与方法
1.1 研究对象
根 据 AAPM (American Association of Physicists in Medicine)119号报告对调强放射治疗测试基准计划的选取建议[7],本研究依据靶区形状、大小和位置及危及器官的不同,选取106例不同部位的RapidArc 计划,其中31 例头颈部为鼻咽癌计划,36 例胸部为肺和食管单靶区,39 例盆腔计划(包括多靶区宫颈癌计划,直肠和前列腺同步加量计划)。
1.2 加速器和计划系统
Varian EDGE 直线加速器,6 MV X 射线,剂量率600 MU/min(Monitor unit/min)。所有计划包括两个或多个非零准直器角度的圆弧或段弧,同时采用铅门自动跟随技术,以更好地减少叶片间的漏射。Eclipse 13.6 计划系统使用Photon Optimizer优化算法(PO-13.6.23),最终剂量计算使用各向异性解析算法(AAA-13.6.23),算法计算函数为笔形束核函数,计算网格2.5 mm。计划参数如表1所示。
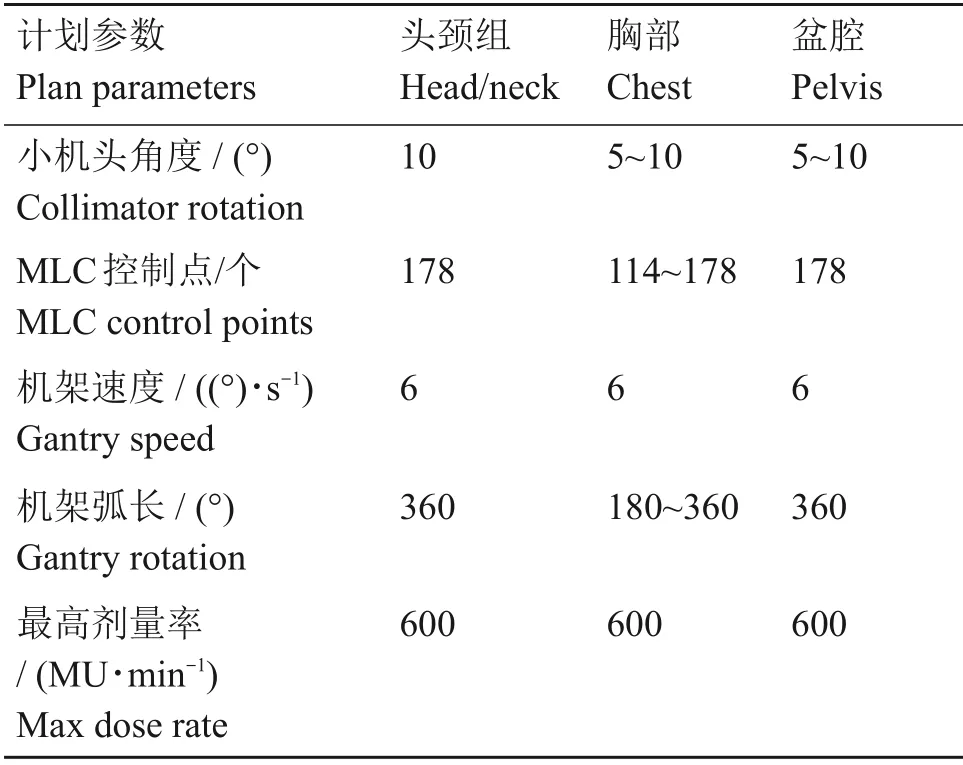
表1 RapidArc计划参数Table 1 RapidArc plan parameters
1.3 Octavius验证系统
Oct 验证系统的基本组成包括:Oct1500 和Oct729 矩阵、旋转模体、倾角仪、控制单元和Verisoft 7.1 剂量分析软件。Oct1500 电离室矩阵由1 405 个空气电离室组成,单个电离室几何尺寸0.44 cm×0.44 cm×0.30 cm,电离室中心间距0.71 cm,可测量剂量率高达48 Gy/min,有效测量范围27 cm×27 cm,与Oct729矩阵相比,电离室数量增加了近两倍[8]。最上层是0.5 cm 的聚苯乙烯建成层,有效测量点位于电离室的中心。Oct729矩阵由729 个空气电离室组成(尺寸:0.5 cm×0.5 cm×0.5 cm),相邻两个电离室中心间距1 cm。模体的相对电子密度在Verisoft 剂量重建选项中设置为水等效(为1.016 g/cm3),相应的TPS 剂量在旋转模体的人工CT 数据上计算,仅包含一个直径32 cm 的圆柱形轮廓,设置HU(Hounsfied unit)值16,则模体的相对电子密度为1.019g/cm3。
利用不同机架角度的测量剂量和源皮距(Sourceto-surface distance,SSD)85 cm 处4 cm×4 cm 到26 cm×26 cm 大小射野的百分深度剂量(Percentage depth dose,PDD)数据,Verisoft软件通过线性插值得到整个模体内的3D剂量分布。无需使用TPS 的剂量信息,重建算法流程如图1所示[9-10]。
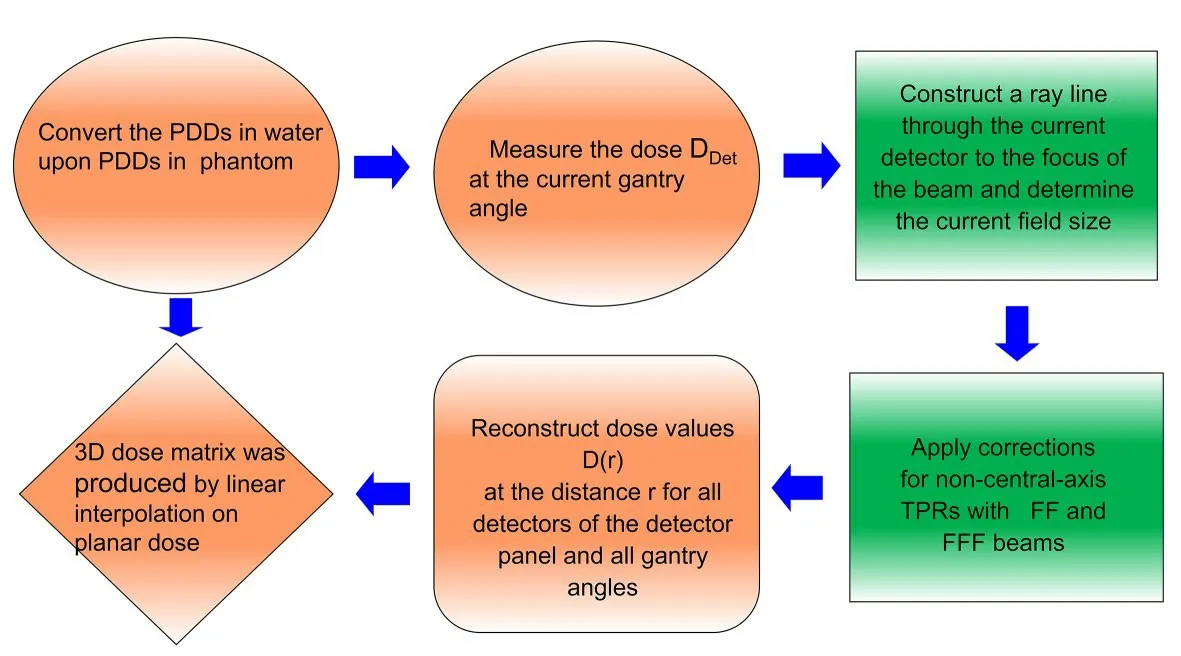
图1 3D剂量重建流程图Fig.1 3D dose reconstruction flow chart
对于RapidArc计划,近110万个剂量点通过这种方式重建,约需25 s。在此基础上,将TPS计划导入到Verisoft 软件中运用模体测量结果进行患者CT影像的剂量重建。
1.4 电离室矩阵的校准
与标准剂量比较的剂量校准应在每次测量前进行,以便将探测器响应和加速器输出的变化因素并入剂量测量中。Oct1500和Oct729矩阵通过使用由TPS提供的期望值和因子Kcross(TPS计算值与矩阵面板中心电离室测量值的比值)对中心电离室进行交叉校准。方法:首先在TPS 做一个10 cm×10 cm大小射野的单野垂照计划,处方剂量设为1 Gy,源皮距84 cm,计算完成后,读取中心电离室跳数MU,此为期望值(Expected value=1 Gy);然后在加速器输入与TPS 相同的跳数进行测量,Accept后得到因子Kcross,即完成对中心电离室的交叉校准,这种标定方式可同时校准温度、气压和能量依赖,以消除由加速器日常输出波动引起的任何测量剂量偏差。
1.5 验证与评估方法
与Oct729电离室矩阵不同的是,Oct1500矩阵可不进行预热照射[8],连接好测量设备后调取验证计划,以QA(Quality assurance)模式进行测量数据的采集。利用VeriSoft 7.1 对计算与实际测量的剂量在全局归一方式下以3%/3 mm、3%/2 mm、2%/2 mm 和2%/1 mm 的 剂 量 偏 差(Dose difference, DD)/距 离 误 差 (Distance to agreement,DTA)标准进行3D体积通量的γ评估,阈值10%。此外对横断面(Transverse,T)、冠状面(Coronal,C)和矢状面(Sagittal,S)进行评价,通过对比分析三个平面的3D γ 通过率来验证不同空间方位的剂量响应是否存在差异。
1.6 统计学方法
2 结果
2.1 三个层面3D γ 指数分析结果
对三个层面γ 值分别做正态性检验,结果显示,除3%/3 mm 标准横断面γ 值不符合正态分布(双侧渐进显著性p=0.034)外,其余组数据均符合正态分布(p>0.05),方差齐性检验结果显示,4个标准下三组数据均符合方差齐性(p>0.05)。横断面3D γ 值均高于其他两个层面,更严格的标准导致更低的γ平均值和更大的偏差,单因素方差分析表明除3%/2 mm外,其他标准下三个平面的γ值差异不具有统计学意义,如表2所示。
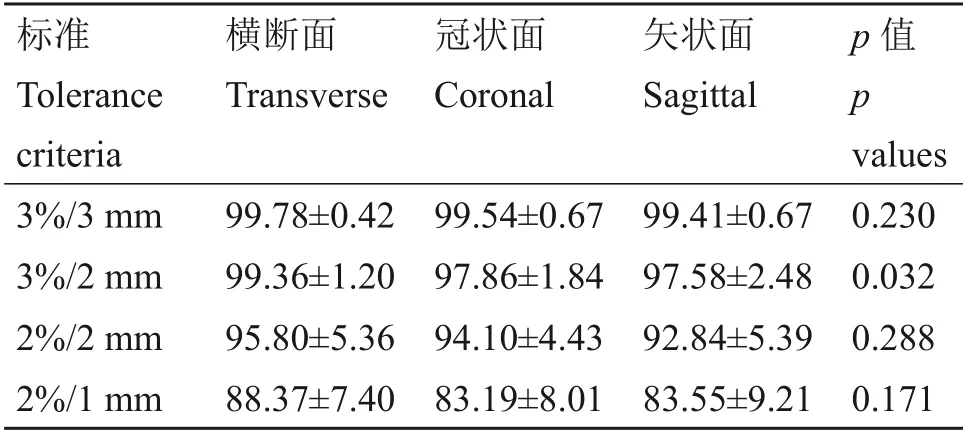
表2 三个层面的3D γ通过率Table 2 3D γ pass rates at three levels (%)
2.2 模体内3D γ指数分析结果
对模体内测量结果做正态性检验,结果显示,除3%/3 mm标准胸部计划γ值不符合正态分布(双侧渐进显著性p=0.029)外,其余组数据均符合正态分布(p>0.05),方差齐性检验结果证实均符合方差齐性条件(显著性p>0.05)。不同解剖部位的通过率如表3 所示,3%/3 mm 和3%/2 mm 标准的3D γ值差异不具有统计学意义。
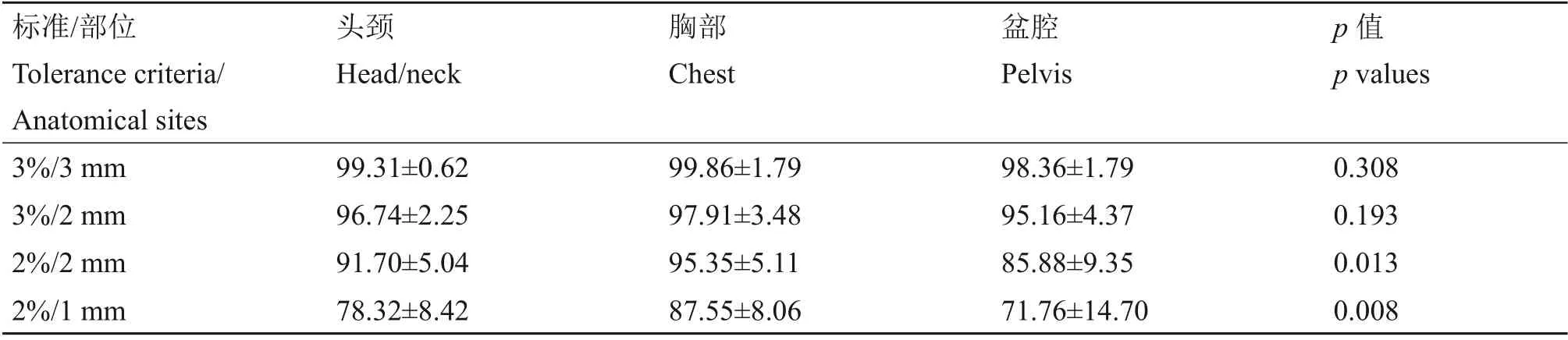
表3 整个模体内的3D γ通过率Table 3 3D γ pass rates in the phontom (%)
2.3 Oct729与Oct1500结果的密度直方图
任选不同部位36 例计划用Oct729 矩阵测量后与Oct1500 进行对比,结果如图2 所示。将显著性水平α设为0.05,则置信度为95%,得到3%/3 mm方式下Oct729 和Oct1500 的通过率均值为96.05%和99.05%,对应的置信区间(Confidence interval,CI) 分 别 为[95.16, 96.93]% 和[98.53,99.58]%;3%/2 mm 均值是91.09%和96.78%,CI为[89.56,92.63]%和[95.57,97.99]%;2%/2 mm 均值是83.75%和91.49%,CI 为[81.41,86.09]%和[88.89,94.10]%;2%/1 mm 均值是70.86% 和79.9%, CI 为[67.68, 74.05]% 和[75.66,84.14]%。

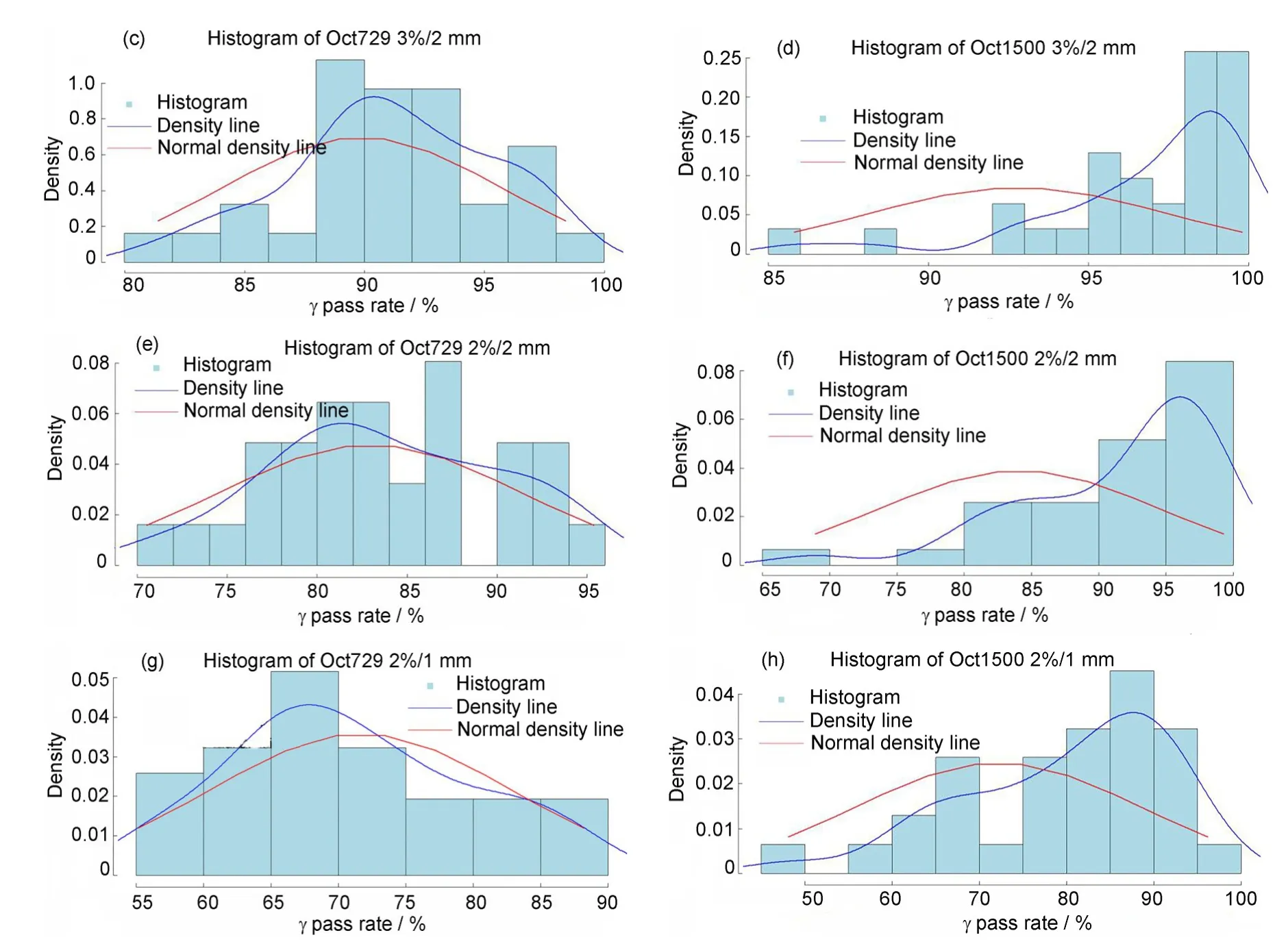
图2 Oct729 and Oct1500密度直方图(彩色见网络版)Fig.2 Density histogram of Oct729 and Oct1500(color online)
2.4 Oct729与Oct1500左右(LR)和枪靶(TG)方向曲线图
任选一例宫颈计划使用Matlab 软件对两个矩阵左右和枪靶方向103个测量点剂量与计算值进行拟合对比(3%/2 mm 标准),见图3(c)、(d)、(e)和(f),受限于探测器面板的尺寸测量点数少于计算点数,可看出Oct1500的测量与计算曲线吻合更好。图3(a)和(b)是测量与计算剂量分布叠加图,蓝色区域代表不符合γ标准的测量点,黄色靶区内失败点分散,且Oct729 矩阵测量失败点数更多。
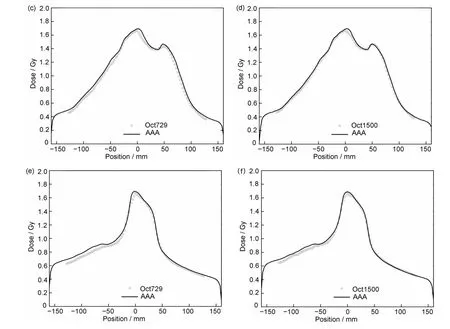
图3 Oct729与Oct1500剂量分布对比线剖面图:(a)Oct729测量和计算的横断面剂量分布图;(b)Oct1500测量和计算的横断面剂量分布图;(c)通过Oct729矩阵等中心左右方向测量与计算拟合图;(d)通过Oct1500矩阵等中心左右方向测量与计算拟合图;(e)通过Oct729矩阵等中心枪靶方向测量与计算拟合图;(f)通过Oct1500矩阵等中心枪靶方向测量与计算拟合图(彩图见网络版)Fig.3 Dose line profiles for Oct729与Oct1500:(a)transversal dose profile measured and calculated by Oct729;(b)transversal dose profile measured and calculated by Oct1500;(c)the fitting diagram for measure and calculation via left and right direction of Oct729;(d)the fitting diagram for measure and calculation via left and right direction of Oct1500;(e)the fitting diagram for measure and calculation via gun and target direction of Oct729;(f)the fitting diagram for measure and calculation via gun and target direction of Oct1500(color online)
2.5 通过率箱图分析
图4 为全局归一方式下满足3%/2 mm 标准的106个计划,整个模体内平均通过率在95%以上。
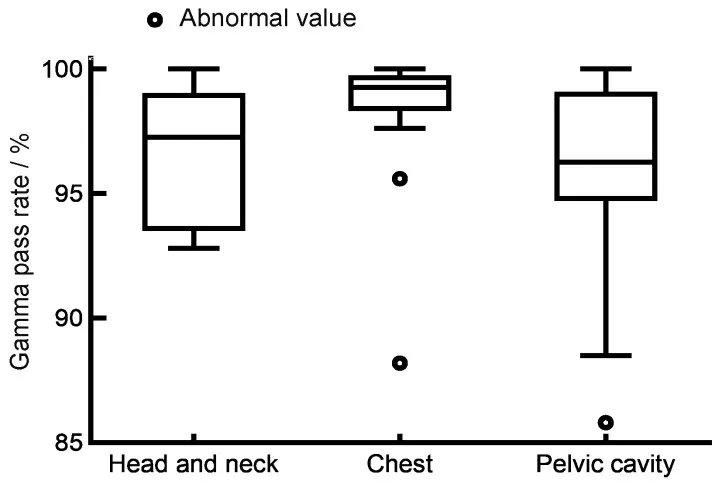
图4 106个病人整个模体内3%/2mm标准的通过率Fig.4 Pass rate of 3%/2 mm for 106 patients in the phantom
2.6 一鼻咽计划验证失败的点(γ>1)在模体和解剖结构的位置
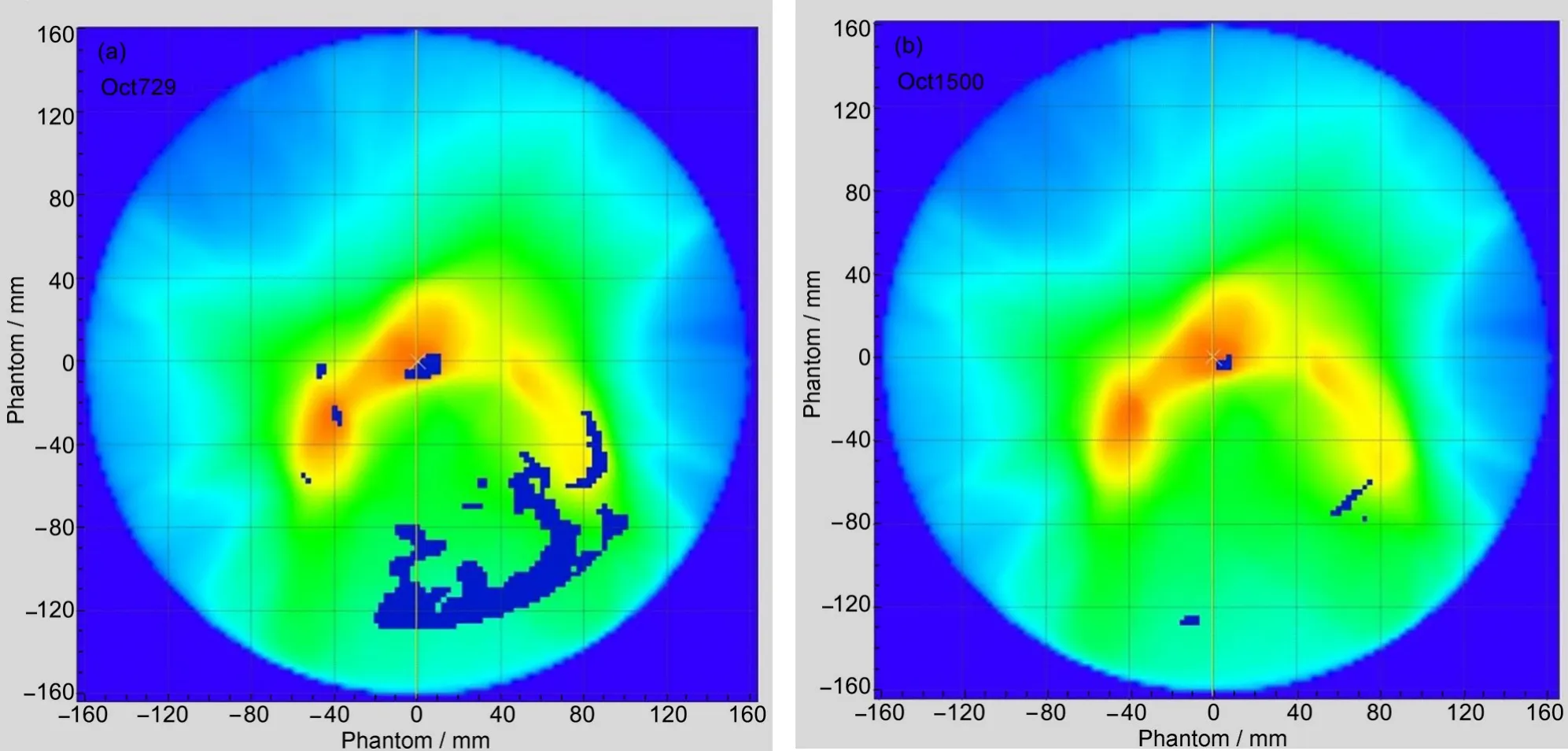
由图5 可见,γ>1 的点主要是冷点(蓝色区域),大多出现在计划靶区边缘高剂量梯度区域和低剂量区,表明这些区域的剂量测量值低于计算值。矢状面视图低剂量区出现小范围的热点(红色区域),表明测量值高于计算值。
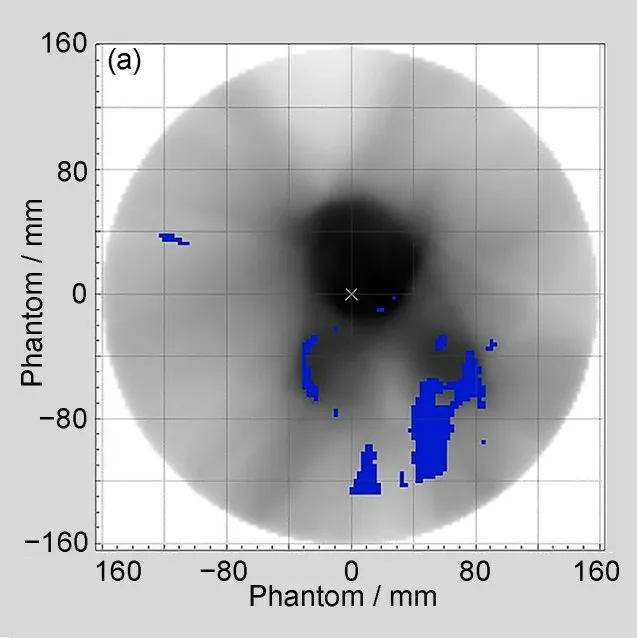

图5 γ>1的点(蓝色和红色)在模体和病人解剖结构上的分布图:(a)模体横断面;(b)模体冠状面;(c)模体矢状面;(d)病人横断面;(e)病人冠状面;(f)病人矢状面(彩色见网络版)Fig.5 Graphical representation of the γ>1 points(in blue and red)in the phantom and patient:(a)transversal phantom;(b)coronal phantom;(c)sagittal phantom;(d)transversal patient;(e)coronal patient,and(f)sagittal patient(color online)
3 讨论
放射治疗计划QA的主要目标是获取反映计算剂量分布与“实际”剂量分布之间的临床相关差异。在QA 过程中,“真实”剂量由测量值表示。首先,医学物理师需了解自己使用的测量系统及分析软件的准确性和局限性。根据厂家的数据倾角仪和旋转单元存在(±1)°的固有容差,Octavius系统依赖倾角仪的精度来确定探测器总是垂直于射线束,这将造成机架和探测器矩阵不完全垂直的状态,以及倾角仪传输机架角度微小的误差,此误差作为系统误差被引入每位患者治疗计划测量剂量分析中。Verisoft 剂量分析软件在进行解剖结构剂量重建过程中有时会出现等中心位置偏移的情况,因此在分析验证结果前应检查CT影像等中心位置是否和模体的一致。此外,使用第三方计算软件重建剂量分布验证TPS 结果,应该先对该软件进行测试,确定其精度不差于待验证计划的TPS。其次,应该对测量过程可能引入的误差有所了解,如MLC 叶片位置误差和走位精度误差、机架旋转稳定性、射野稳定性、剂量率偏差等,这些主要作为随机误差。再次,不同计划系统所使用的剂量计算模型存在一定的误差,Eclipse 计划系统AAA 算法是三维的笔型束卷积叠加算法,该模型的建立考虑了原射线、电子线污染及准直器散射影响,对不均匀介质中的剂量计算能进行更准确修正。相关研究表明,AAA 算法相对于以往光子笔型束卷积算法更接近实际测量值,是一种更精确的算法,但会低估肺受量,在有空腔(如肺组织)存在的情况下TPS 计算误差甚至可达基础误差的3~5倍[11-13]。本研究对于头颈和盆腔所选计划均为多靶区,存在剂量梯度子野优化相对复杂,剂量计算误差也会相对增加,TG 218 报告指出在弧形出束期间,通过率随MU与每部分剂量比率的增加而降低,这表明复杂靶区所致的高度调制计划具有稍微较差的QA结果[14-15],本实验测量结果也证明了这一点,由此推断AAA 算法受计划复杂程度引起的剂量计算误差高于空腔存在时的误差。此外,治疗计划系统存在不同程度的优化和计算随机误差,个别计划首次验证通过率较低不能执行,经重新优化计算后再次测量通过率提高了。调强计划质量保证结果是各种不确定误差之间的复杂相互作用,有时会观察到同一计划经多次验证,但γ通过率的差异比较大,特别是对于2%/1 mm、1%/1 mm 更严格的标准,难以找出同一验证计划两次测量γ 通过率不一致的确切原因[16]。对此,本研究选取4 例通过率在93%~95%(3%/2 mm)的计划间隔一周重复测量,发现第二次测量时通过率均有1%~2%的增加,反复确认验证系统摆位均无明显差错,引起通过率差异的原因应该主要来自测量过程(一是加速器出束时的机械误差、剂量率不稳定等,二是剂量插值重建过程中的误差,三是电离室矩阵对不同射野大小和剂量率的响应等),但具体原因不明。因此采用γ通过率作为评判治疗计划是否能执行具有一定的局限性,需要结合具体治疗部位和存在的危及器官进一步分析验证不通过的具体区域及其相关临床意义。
对三个层面的γ 通过率,单因素ANOVA 分析表明,除3%/2 mm外,其他标准下三个平面的γ值差异不具有统计学意义,组间比较发现只有3%/2 mm 标准下横断面和冠状面、横断面和矢状面之间差异具有统计学意义,因此读者在使用时可任选感兴趣层面进行γ 值分析。对临床常用的3%/3 mm 和3%/2 mm 标准,不同部位不同复杂程度的计划通过率差异不具有统计学意义,说明Verisoft 软件将Oct1500 测量剂量重建为3D 剂量的精度在较宽松的剂量差异标准下受计划复杂程度和剂量梯度陡峭程度影响不大。进一步降低剂量差异到2%,头颈和盆腔复杂靶区的通过率明显降低,差异具有统计学意义,表明Octavius系统由测量的平面剂量重建为3D剂量的精度可能依赖于治疗计划的复杂程度和剂量梯度的陡峭程度。对3%的剂量误差,当距离误差标准由3 mm 降为2 mm时,三个部位平均γ值降低≤3.25%,说明较宽松的剂量差异标准下,降低距离一致性标准对γ通过率影响不大。对2 mm的距离误差标准,剂量差异标准由3%降为2%时,三个部位平均γ 值降低在9.75%以内,说明较严格的距离误差标准下,降低剂量差异标准对γ 通过率影响较明显。对更严格的2%/2 mm和2%/1 mm标准,所有计划的通过率降低更显著且偏差更大。当标准由3%/3 mm 降到3%/2 mm时引起所有计划γ通过率的下降,这一现象在Oct729 系统中同样被观察到,这表明在常规的病人QA 中需要将DTA 设置为2 mm 的标准。依据TG 218报告3%/2 mm通过率95%的标准(阈值10%),使用Oct1500 系统在本工作中获得的平均γ值均高于95%,最低γ值为85.8%(15例γ值低于95%),具有一定的错误计划检出率。目前二维平面剂量验证以胶片测量结果为标准进行对比,对于三维体积剂量分析,各厂家采用不同的工具和插值重建算法,各有优缺点。
本研究结果显示:使用Oct1500测量剂量重建的3D 剂量与计划剂量吻合度明显高于Oct729 方式,与报道的结果类似[8,17-18],这是由于其改进的分辨率和探测器数目及探测器棋盘式设计提高了剂量重建的精度,表明Octavius 系统重建3D 剂量的精度还可能依赖于电离室矩阵空间分辨率。此外,依据γ评估方法的计算公式可知,参考矩阵分辨率越高,在计划系统导出的平面或体积剂量上,更容易在给定距离偏差范围内搜索到小于给定剂量偏差的点,导致其通过率较高[19]。Van Esch等[8]的研究表明新的Oct1500 二维矩阵显示出与729 和Oct729(729 电离室矩阵的升级版,用于容积旋转调强的剂量验证)同样良好的剂量测定性能之外还具有其他优势:一是拥有近两倍于729和Oct729 的探测器数目和探测器棋盘式设计;二是Oct1500具有更好的电子电路保护,能进行更高剂量率的测量,且具有更快的读出时间(100 ms),而且无论测量前是否进行过预热或数分钟未使用,Oct1500均显示出好的测量重复性和稳定性,而对于729和Oct729矩阵,预热对于确保探测器充分响应是必需的,在机器超过5 min 没有使用的情况下,探测器就会冷却,这时需再次预热才能进行测量。Bruschi等[17]利用旋转模体和三种不同分辨率的矩阵(Oct729/Oct1500/SRS1000)重建三维剂量,对比测量设备分辨率在立体定向体部放射治疗(Stereotactic body radiotherapy,SBRT)病例中对剂量验证精度的影响,结果显示矩阵分辨率可显著影响SBRT 治疗前剂量验证结果。Van Esch等[8]和Stelljes 等[18]通过Verisoft 软件提供的四步测量法获取更高分辨率的测量结果,通过合并多个测量值以增加剂量分布与电离室敏感区域覆盖范围的方式可增加空间采样频率,从而提高剂量验证精度。同时也证明Oct1500 矩阵的剂量稳定性、线性和脉冲依赖性分别小于±0.20%、±0.58%和±1.00%。国内也见多篇文献报道Octavius验证系统能满足临床多病种旋转调强计划和HalcyonTM治疗计划剂量验证要求,可行性值得认可[20-22]。
对比106个计划Max.dose方式下满足3%/2 mm标准的整个模体内3D γ 通过率,发现有15 个计划的通过率低于95%。对此分别验证了每个弧,发现6例计划单弧验证通过率都高于95%,而合成弧低于95%,说明各个弧不通过体素γ 指数误差放大,5例单弧通过率均低于合成弧,说明出现误差抵消的情况,4例一个弧通过率高于合成弧,另一个弧通过率低于整体通过率。对这三种情况,除了分析γ 指数及通过率还应分析其区域分布、最大值、平均值、最小值、中位数、γ 值超过1.5 所占的比例和直方图。通过率低于90%的5个计划,通过将患者计划从TPS导出以Dicom格式导入Verisoft 7.1软件在CT 影像观察不通过点的具体位置,发现4个计划靶区和临近的危及器官内出现范围较广的剂量冷点和热点,对这4 个计划重新进行优化计算。
综上所述,Octavius系统由测量的平面剂量重建为3D剂量的精度可能依赖于治疗计划的复杂程度、剂量梯度的陡峭程度及电离室矩阵空间分辨率。调强治疗计划的QA结果主要受计划系统和测量过程系统与随机误差的影响,在计划系统和加速器调试验收时应进行相关测试以督促减少系统误差,同时做好日常设备质控减少随机误差。对于常规的旋转调强治疗,可将通过率标准设为3%/2 mm通过率95%(阈值10%),但使用此套设备进行SBRT 和立体消融体部放射治疗(Stereotactic ablative radiotherapy,SABR)及立体定向放射外科治疗(Stereotactic radiosurgery,SRS)时,建议将通过率标准设为2%/2 mm 通过率95%(阈值10%)以增加测量不确定度。通过率低的RapidArc计划可实现基于CT影像的不通过点分析,但不能得到计算和测量之间定量的差异,下一步工作将通过此系统对计划和执行差错检出能力的探究评估出现的差错对患者实际接收到剂量的影响程度,对比计划和测量剂量体积直方图(Dose volume histogram,DVH)差异的临床意义及Octavius 验证系统测量重建的剂量信息是否能真实反映实际情况。
致谢感谢中山大学肿瘤防治中心邓小武教授对于本文撰写和研究思路所给予的关键性指导。
