二氟沙星光敏损伤溶菌酶的十二烷基磺酸钠-聚丙烯酰胺凝胶电泳研究
2021-05-06李海霞刘艳成王文锋
李海霞 刘艳成 王文锋
1(南京工业大学浦江学院 南京211132)
2(中国科学院上海应用物理研究所 上海201800)
喹代诺酮类药物(Fluoroquinolones,FQs)是目前用于治疗各种细菌性感染类疾病最广泛的化学合成药。随着FQs的广泛应用,出现了一个值得关注的问题,那就是这类药物的副作用,包括消化系统的不良副反应[1]、中枢神经系统的不良副反应[2-4]、循环系统的不良副反应[1,5]、肝肾的毒性反应[6-8]、软骨的毒性反应[8-9]、损伤跟腱的副反应[1,7]和光敏毒性副反应[10-12]等。由于光敏副反应是该类药物不良反应中较小的一部分,因此其光敏毒性副反应长期被人们所忽视。
20 世纪末,人们发现了8-甲基补骨脂素,一种治疗白癜风的药物。该类药物能够引起很强的光毒性副反应,同时发现临床上一些经常使用的药物,如非甾体抗炎药物、FQs等,也会导致明显的光毒性反应。从此现代药物的光敏性副反应得到的进一步研究。
自20 世纪末以来,FQs 的光敏毒性[10-13]引起了众多研究者的关注。经研究发现,其药物发生光敏毒性副反应的发生概率与该类药物的分子结构有很大的关系。为了更好地探究FQs的光敏毒性机理,很多学者对FQs的光物理和光化学性质进行了广泛的研究,为认识和理解FQs类药物在水溶液和生物环境条件下产生的光化学反应和光敏损伤大分子机理提供了大量的理论依据。
目前关于FQs光敏毒性机理的研究结果主要是通过紫外-可见分光光度法、荧光分光光度法、凝胶电泳法、色谱分析法等稳态手段获得的。部分稳态研究结果表明,FQs 可以对DNA 造成光敏损伤[11,14-20],从而引发分子链断裂。在无氧条件下,各类FQs对DNA损伤的能力大小依次为氟罗沙星、洛美沙星、萘啶酸、诺氟沙星、以诺沙星[21]。氟罗沙星和洛美沙星对DNA 造成的损伤主要是由于这两个分子的8号位的脱氟反应生成的阳离子造成的[21-22],这两类药物的气氛(有氧或无氧)的变化对DNA 的损伤程度影响不是太大,这是由于氧气对该类FQs激发三重态的猝灭并不明显,相应的单线态氧或超氧阴离子自由基的产率会很低[21,23]。而依诺沙星、诺氟沙星和环丙沙星只有6号位含氟的FQs能很好地被氧气有效地猝灭,生成单线态氧和超氧阴离子自由基。因此,这类氟喹诺酮类药物在有氧的条件下,对DNA 的光敏损伤程度会比无氧条件下大大增强[14,16]。
二氟沙星药物(DFX)属于第三代氟喹诺酮类药物,又叫做双氟沙星,该药物首次研制成功是由美国的Abbott 公司的研发人员在1984 年完成的。在第4届的亚洲农业和畜牧业国际会议上首次报道了该药物成分对畜牧业上的应用潜力。2000年,我国农业部正式批准其作为国家三类新兽药。二氟沙星药物的结构式见图1。
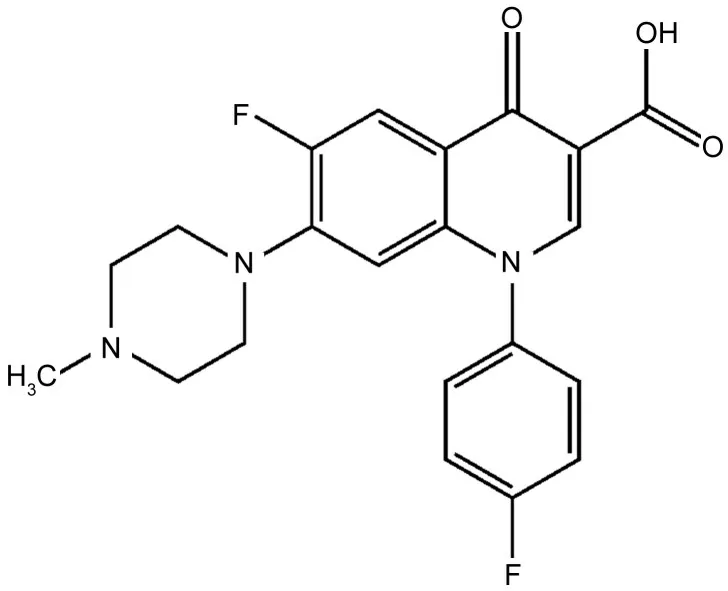
图1 二氟沙星的结构Fig.1 Dofloxacin molecular structure
DFX 是畜禽专用药物,大部分欧洲国家都已经在广泛使用,我国也早已经成功研制出来并进行了生产。对比其他喹诺酮类药物的结构,DFX在结构上的喹诺酮环部分的N-1位引入基团4-氟苯基,因此,其抗菌谱得到了进一步扩大,在抵抗革兰氏阳性菌方面,尤其是在抵抗链球菌和绿脓杆菌的活性上得到了进一步的增强,而且该药物对幼年动物的软组织损伤副作用和毒理副作用相比其他类喹诺酮更小。同时该药物在6位结构上引入了氨基,这样可以大大增强二氟沙星的抗菌活性及对抗促旋酶的活性,也改善了对酶的拮抗作用。与此相比,二氟沙星的另一个毒副作用——光敏毒性的研究却比较少。二氟沙星对酶类等生物大分子在光照作用下会引起分子链断裂,国内王文锋课题组[24-25]前期通过激光光解、脉冲辐解等时间分辨技术对二氟沙星的激发三重态、阴阳离子自由基、以及二氟沙星的激发三重态氧化损伤色氨酸、酪氨酸、半胱氨酸和脱氧鸟苷酸进行了详细的研究。在前期研究基础上,本文利用凝胶电泳稳态光照手段研究了二氟沙星对溶菌酶的光敏损伤,研究结果表明,DFX 光敏损伤生物分子是通过I型和II型机理共同作用的结果。
1 材料与方法
1.1 药品
二氟沙星,美国西格玛(Sigma)试剂公司;溶菌酶(Lysozyme,分子量14.6 kDa),美国福禄克(Fluka)公司。试剂均直接使用。溶液配制用水为Millipore新鲜制备纯水。
1.2 装置与检测方法
实验中的稳态光照技术采用500 W的氙灯作为稳态光照的光源,并经过中心波长为345 nm 的滤光片透射后,聚焦到石英的样品池上,通过测定该实验中光辐照的能量强度为12 mJ,稳态光照装置如图2所示。通过稳态光照后的样品,使用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分析测试,然后用考马斯亮蓝G-250溶液对分析凝胶染色10 min 左右,最后由醋酸和乙醇组成的混合脱色液进行脱色30 min。染色后的胶体用美国伯乐(Bio-Red)公司生产的凝胶定量成像分析系统拍照分析染色好的胶体。
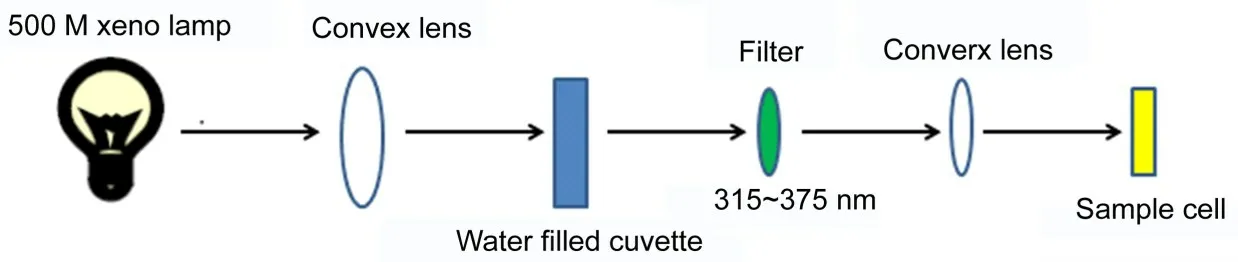
图2 稳态光照装置的示意图Fig 2 Steady state irradiation system
2 结果
2.1 稳态光照波长的选定
图3为二氟沙星水溶液的紫外吸收光谱。

图3 二氟沙星水溶液的紫外可见吸收光谱Fig 3 UV-visible absorption of DFX aqueous solution
从图3可以看出,二氟沙星在可见光及紫外光区有两个吸收峰分别位于273 nm 和336 nm。短波段位于250~300 nm 吸收峰主要是由芳香环的π-π*电子跃迁所引起的[26-27],长波段位于300~360 nm的吸收峰主要是由n-π*电子跃迁(HOMO-LUMO)所引起的,该波段的吸收包含了两个次级吸收峰,这主要是由二氟沙星分子与水分子之间形成的分子间氢键,以及二氟沙星分子中4位的酮基和3位的羧基形成的分子内氢键共同影响所导致的[26]。从文献[28]中可以查出,溶菌酶在大于315 nm的波长后几乎对可见光没有吸收,因此本文实验选用了中心波长为345 nm、波带宽为60 nm的干涉滤色片滤光,这样就可以保证在稳态光照实验中,所有的能量均是由二氟沙星吸收并产生的。
2.2 不同气氛对溶菌酶损伤的影响
图4为5×10-4mol/L溶菌酶溶液和1.8×10-4mol/L二氟沙星的混合液分别在饱和氮气条件、饱和氧气条件、饱和空气条件下的稳态光照50 min 后得到的SDS-PAGE图谱。图中数据都是三次试验结果的平均值。从图4可以看出,同种混合液在不同的气氛条件下进行稳态光照,结果均在28~30 kDa处出现了大分子量的蛋白质片段,而该处的分子量恰好是溶菌酶分子量的两倍,这可以说明其产物是溶菌酶的二聚产物。在相同气氛的条件下进行稳态光照,只对溶菌酶溶液进行光照时,溶菌酶几乎没有二聚产物。可以看出,二氟沙星的存在使溶菌酶二聚产物明显增加,二氟沙星促使了溶菌酶的损伤。从图4还可以发现,在不同的气氛饱和条件下,纯氧气饱和条件时溶菌酶的损伤最严重,空气饱和条件下损伤程度次之,纯氮气饱和条件下溶菌酶受到的损伤程度相对最小。结合激光光解研究二氟沙星激发态氧化损伤氨基酸的实验结果可以知道,在氮气饱和条件下,二氟沙星是通过I 型光氧化反应直接造成溶菌酶的损伤[24]。在纯氧气存在的条件下溶菌酶损伤最严重,且氧气的浓度越大,损伤程度越严重(即实验结果表明纯氧气条件下的损伤大于空气条件下损伤),进一步实验表明,二氟沙星对溶菌酶的损伤机理在不同条件下同时存在II型反应机理。在氧气饱和条件下溶菌酶的光敏损伤比在氮气饱和条件下的损伤要更严重,说明在有氧条件下二氟沙星对溶菌酶的光敏损伤是I型和II型反应共同作用的结果。
2.3 不同二氟沙星浓度对溶菌酶损伤的影响
图5为相同的光照时间都是50 min,相同的空气饱和条件下,混合溶液中含有相同浓度的溶菌酶都是5×10-4mol/L,在含有不同浓度二氟沙星混合溶液中得到的电泳图。
改变其中二氟沙星的浓度,图5中1~6 号二氟沙星的浓度分别为2×10-4mol/L、1.6×10-4mol/L、1.2×10-4mol/L、0.8×10-4mol/L、0.4×10-4mol/L。从图5 可以看出,随着二氟沙星的浓度在(0~2)×10-4mol/L 范围内的逐步增加,在28~30 kDa 处出现的溶菌酶的二聚产物条带强度逐渐增强,这表明了在相同的光照强度和光照时间的条件下,随着二氟沙星浓度的增加溶菌酶的损伤加剧。主要原因是因为随着二氟沙星浓度的增加在相同的光照条件下更多的二氟沙星能够吸收更多光能转化为二氟沙星的激发态,二氟沙星激发态通过I型反应和II型反应促进了溶菌酶的光敏损伤。
2.4 不同光照时间对溶菌酶损伤的影响
图6 为空气饱和条件下,5×10-4mol/L 溶菌酶和1.8×10-4mol/L 二氟沙星的混合液经过不同时间的稳态光照后,再进行的SDS-PAGE实验并成像的结果。
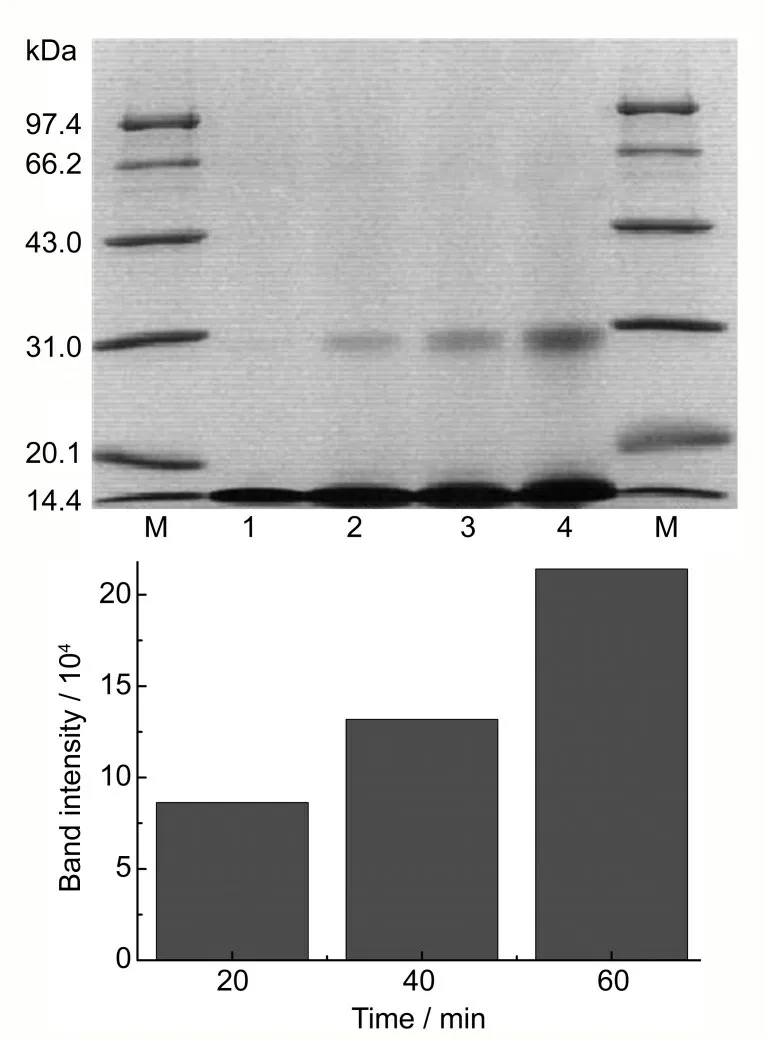
图6 不同光照时间条件下二氟沙星对溶菌酶的损伤Fig.6 Gel electrophoresis pattern presents the effect of time of irradiation on the photodamage of Lysozyme
图6 显示的为不同光照时间对二氟沙星的损伤,从图中可以看出,当没有稳态光照的时候二氟沙星对溶菌酶几乎没有损伤,当稳态光照20 min后即可在28~30 kDa的位置观察到第二条带。实验结果表明,随着稳态光照时间的延长,二氟沙星对溶菌酶的光敏损伤程度逐渐加剧。二氟沙星损伤溶菌酶的稳态光照时间效应与二氟沙星损伤溶菌酶的浓度效应相似,随着稳态光照时间的延长会产生更多的二氟沙星激发态,并通过电子转移和激发能量转移这两种途径(I 型反应和II 型反应)加剧溶菌酶的光敏损伤。
3 结论
溶菌酶的结构比较稳定,主要原因是由于溶菌酶分子是由129 个氨基酸分子组成的单肽链。在溶菌酶分子中有3个酪氨酸基团位于溶菌酶分子的内部,不易在溶剂中暴露,对稳定溶菌酶分子的结构有着十分重要的作用[29]。在溶菌酶的分子中有6个色氨酸和4个色氨酸位于该分子的表层部位,还有2个色氨酸位于溶菌酶分子的活性中心部位,这些基团都可以参与溶菌酶的催化反应。
实验研究结果表明,在氮气饱和条件下,二氟沙星也能够光敏损伤溶菌酶分子。这是由于溶菌酶分子在水溶液中有4个位于表层部位色氨酸都会不同程度地受溶液中活性物质的攻击[30],因而位于外部的色氨酸基团是自由基攻击的最主要目标之一,即位于溶菌酶分子外部的色氨酸基团对产生的二氟沙星三重态会表现出比较高的反应活性。通过王文锋课题组前期瞬态光解研究表明,二氟沙星产生的激发三重态与色氨酸基团可以发生分子间的电子转移反应,这样产生的色氨酸自由基能够使两个色氨酸残基之间成键,这个反应就是溶菌酶蛋白质发生交联的主要原因[31]。从图7的稳态反应示意图中可以断定,在氮气条件下,二氟沙星光敏损伤溶菌酶分子的途径主要是二氟沙星激发三重态直接与溶菌酶分子中的色氨酸残基发生分子间电子转移,先生成以色氨酸为中心的自由基,再由色氨酸分子自由基和色氨酸分子自由基发生自由基终止成键反应造成的溶菌酶大分子的损伤,这也就是I型反应机制。
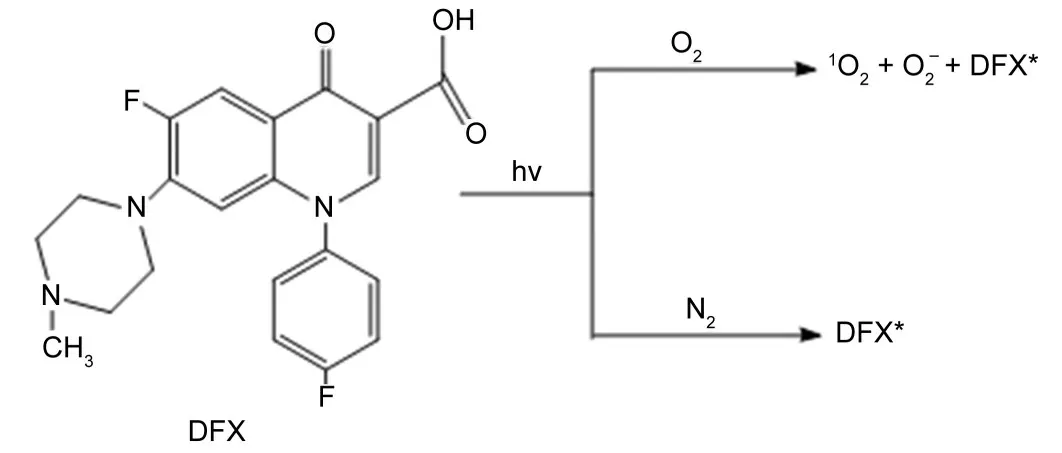
图7 稳态光反应示意图Fig.7 Schematic diagram of steady state photoreaction
当混合溶液中所通气体发生变化时,在空气和氧气饱和的二氟沙星水溶液中,二氟沙星的三重激发态可以被氧气迅速猝灭,生成单线态氧和超氧阴离子自由基[32]。因此在有氧气饱和的条件下,在光照条件下发生的主要反应是二氟沙星产生激发三重态并将能量转移给溶液中的溶解氧,进而产生单线态氧或超氧阴离子自由基反应,最后由单线态氧或超氧阴离子自由基引发溶菌酶分子的损伤,这也就是II型反应机制。同时由于在有氧气饱和条件下产生的二氟沙星激发三重态不会全部与氧气发生反应,还有部分未反应的通过电子转移直接导致溶菌酶分子的损伤,说明在有氧气存在的条件下,主要通过II 型反应损伤溶菌酶,同时还存在少量I型反应对溶菌酶的损伤。由于溶菌酶分子侧链上的不同氨基酸残基与单线态氧的反应速率差别很大,导致特定氨基酸的选择性损伤溶菌酶分子的反应速率差别较大,比如单线态氧对色氨酸的反应速率3×107L/(mol∙s)[33]。随着氧浓度的提高,光照时间的延长以及二氟沙星浓度的增大,溶液中的自由基浓度增大,加快了混合液中溶菌酶分子的交联反应。理论推导验证了实验结果,表明在有氧气存在的条件下溶菌酶分子的光敏损伤程度明显大于在氮气条件下的溶菌酶分子的损伤,进一步印证了二氟沙星药物对溶菌酶分子的光敏损伤是I型反应和Ⅱ型反应协同作用的结果,在不同的条件下两种反应所占比例不同。
