献血人群抗-TP ELISA 检测呈反应性S/CO 值ROC 曲线分析
2021-05-06黄伯泉李仲平梁浩坚谢君谋黄爱琼郑优荣广州血液中心广州市医学重点实验室广东广州510095
黄伯泉,李仲平,梁浩坚,谢君谋,黄爱琼,郑优荣(广州血液中心/广州市医学重点实验室,广东广州510095)
梅毒是由苍白密螺旋体(TP)感染引起人体多器官和神经损害的慢性性传播疾病,也是血液传播疾病之一,危害极大[1]。近年国内外梅毒感染率呈增长趋势,美国近十年感染率翻一番[2],在2019 年国内甲乙类传染病发病数报告中排名第3[3]。无偿献血者中因梅毒抗体呈反应性报废仍是主要原因之一[4],威胁输血的安全[5]。目前,国内采供血机构多采用2 种不同厂家的检测梅毒螺旋体抗体酶联免疫吸附法(ELISA)试剂盒对献血者进行初筛和复检,有条件的单位会对全部抗-TP ELISA 不合格者进行TPPA 确认。国内有一些关于抗-TP ELISA S/CO 值与TPPA的相关性分析文献,但对于献血人群分析案例较少[6],或只是针对医院就医人群[7]的分析案例,不同试剂又有不同分析结果。笔者统计分析2014-2015 年广州地区无偿献血梅毒情况以及对一段时间内2 种抗-TP ELISA 试剂筛查呈反应性结果(包括双试剂、单试剂和灰区)的吸光度/校准临界值(S/CO 值)与其TPPA 确认结果进行ROC 曲线分析,对比2 种试剂在本实验室的检测能力(灵敏度、特异性),并评估2 种试剂S/CO 值的阳性预测值,旨在优化本地区TP 抗体筛查策略,提高工作效率以及保障献血者权益。另外,探讨对所有抗-TP ELISA 呈反应性的标本进行确认的必要性。
1 材料和方法
1.1 实验对象
选取2014 年6 月-2015 年4 月广州血液中心无偿献血者的全血标本,献血者献血前知情同意相关传染病检测项目。标本采集为EDTA-K2 抗凝试管,并以3 000 r/min 离心10 min。留取血浆标本置-30 ℃冰库保存。
1.2 主要试剂和仪器
梅毒螺旋体抗体酶联免疫吸附(ELISA)试剂分别是北京万泰生物技术有限公司试剂盒(A)、上海科华生物技术有限公司试剂盒(B)。梅毒螺旋体抗体颗粒凝集试剂盒(日本富士株式会社,TPPA)为确认试剂。检测试剂均经国家批检合格并在有效期内使用,实验操作均严格按照试剂说明书要求以及按本实验室标准操作规程进行。主要使用仪器为:瑞士哈曼顿公司STAR 8CH 自动加样仪、FAME24/30 自动酶联免疫处理系统;奥地利Anthos 公司酶标比色仪340RT;洗板机;久保田离心机;孵育箱。以上仪器设备均经过计量部门检定校准合格。
1.3 实验方法
采用A 和B 试剂盒对标本进行梅毒螺旋体抗体筛查,单试剂或双试剂呈反应性标本进行双试剂双孔复核检测,复核后单或双试剂仍呈反应性则判读为TP 抗体不及格,对不及格标本进行TPPA 确认,确认阳性即为TP 阳性。本实验室对试剂判读S/CO 值下限的10%(即0.9≤S/CO<1,判读为反应性)设为灰区,对灰区标本作为反应性标本处理,最终所选取复检双孔S/CO 值均值作为统计资料。
1.4 统计学处理
采用SPSS 20.0 软件进行数据学处理,绘制受检标本的工作特征曲线(ROC),利用ROC 曲线确定S/CO 值最佳阈值:计算出最大ROC 曲线下面积(AUC),约登指数最大时对应S/CO 值即为最佳阈值,95%的置信区间用CI 表示。计数资料用率(%)表示,采用χ2检验。分析2 试剂的灵敏度和特异性,并计算其对TPPA 确证试验结果的预测值。采用GraphPad Prism 7 对A、B 试剂S/CO 值数据绘制直方图,并对其TPPA+和TPPA-的A、B 试剂组内和TPPA+中A、B 组间比较,采用Z检。P<0.05 为差异有统计学意义。
2 结果
2.1 广州地区献血人群梅毒筛查以及TPPA 确认结果
2014 年6 月-2015 年4 月广州地区献血人群为295 766 例,抗-TP ELISA 检测呈反应性标本(包括双试剂、单试剂和灰区)为1 103 例(0.37%,1 103/295 766),其中抗-TP ELISA 呈反应性的1 103 例标本进行TPPA 确认,确认阳性738 例(66.91%,738/1 103),阴性353 例,不确定12 例,2 种试剂检测与TPPA 确认情况见表1,2 种试剂检测S/CO 值的差异有统计学意义(P<0.05),见表2、3。
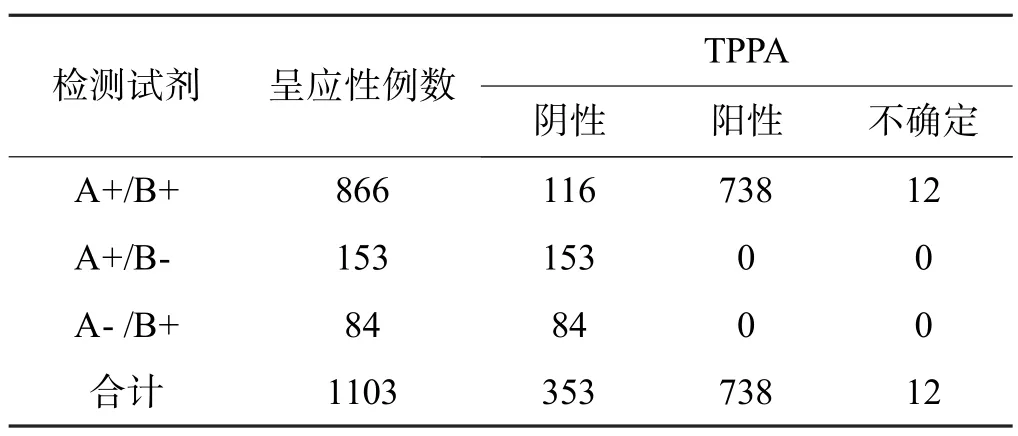
表1 ELISA 抗-TP 呈反应性标本TTPA 确认表
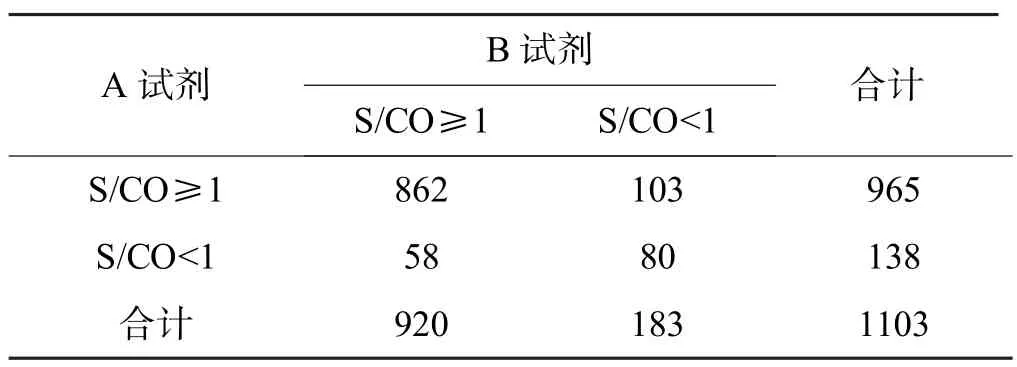
表2 抗-TP ELISA 2 种试剂检测结果S/CO 值的比较

表3 抗-TP 2 种试剂检测结果S/CO 值与TPPA 确认关系
2.2 2 种试剂检测结果S/CO 值比较结果
2 种试剂ROC 曲线A 试剂灵敏度为0.944,特异性为0.975,AUC 为0.992(95%CI:0.988~0.997,P<0.01);B 试剂灵敏度为0.948,特异性为0.972,AUC为0.993(95%CI:0.990~0.996,P<0.01),A、B 试剂在S/CO 最佳阈值分别为11.5 和9.05,均可预测大于95%的确认实验阳性结果,见图1;A 和B 2 种试剂的S/CO 值,TPPA 确证阴阳性之间的S/CO 值差异有统计学意义,P<0.01,见图2。
2.3 A、B 试剂S/CO 值范围与TTPA 阳性预测值结果
A、B 试剂S/CO 值在(5~9.99)和(10~14.99)时阳性预测值分别为67.9%、52.3%和95.3%、93.2%;当S/CO 值≥5 时,A、B 总阳性预测值达到95.5%、95.2%。而当5≤S/CO≤14.99 时,A、B 总阳性预测值仅为83.2%、80%,见表4。2 种试剂抗-TP ELISA S/CO 值各段范围与TPPA 阳性率关系,见图3。

图1 A 和B 2 种试剂S/CO 值ROC 曲线

图2 A 和B 确认TPPA S/CO 值比较

表4 A 和B 检测结果与TPPA 阳性预测值

图3 2 种试剂抗-TP ELISA S/CO 值各段范围与TPPA 阳性率关系
3 讨论
本文实验结果显示广州血液中心无偿献血者梅毒抗体不及格率为0.37%,比本地区10 年前报道的0.45%[8]有所降低,低于佛山报道的0.38%[9],大大低于商丘的0.55%[10]、北京的0.462%[11]。剔除部分单试剂和灰区不及格标本,广州地区献血人群真实梅毒感染率会更低,以本文在2014 年6 月-2015 年4 月内TPPA 确认来计算只有0.25%(738/295 766),佛山是0.34%[9]。广州地区梅毒阳性率比较低的主要原因有:近年不断加强的献血宣传以及单位团体献血动员的力度,其次是严格执行献血前的筛查。虽然ELISA方法的灵敏度高,特异性较好,但会出现非特异性反应,出现假阳性,这不但增加经济成本,同时加大检测部门确认复核的工作量,而且假阳性献血者会被献血信息系统屏蔽,打击献血者的献血热情和爱心,给献血者带来极大的影响,甚至导致医疗纠纷,不利于献血事业的发展。TPPA 是目前梅毒公认的确认试验,但试剂昂贵、操作耗时繁琐,本文中A、B 试剂S/CO“灰区”共84 例,TPPA 确认全为阴性,显示抗-TP ELISA 的“灰区”设置并没起到实质作用,反而增加复核工作量、提高血液报废率以及给这部分假阳性献血者带来极大影响,但是“灰区”设置是否必要以及设置的范围,笔者认为还要对本次84 例TPPA 确认阴性献血者进行复查后的追踪查证,而且需要收集更多数据论证。不可否认“灰区”的设置发挥一定的作用,谭艳等[7]报道医院筛查的3 例0.5≤S/CO<1“灰区”样本,最后TPPA 确诊阳性。有文献报道ELISA 灰区设置在检测抗-HBV、抗-HCV 和抗-HIV 中发挥重要作用[12]。另外,国内大多采供血机构“灰区”设置为0.5≤S/CO<1[6],笔者认为这是国内大部分地区TP 阳性率高的原因之一。酶联免疫吸附检测虽然在血液筛查中有很多优点,但也有容易发生非特异性反应的缺点,假阳性的出现主要是存在内源性(类风湿因子RF、补体、高浓度非特异性免疫球蛋白和异嗜性抗体等)和外源性(标本溶血、放置时间过长和抗凝不全等)干扰因素[13],也有可能是感染“窗口期”和病毒变异等原因所致[7]。美国CDC 对Ortho 的抗HCV ELISA 试剂盒研究发现,检测结果S/CO 值≥3.8 才有95%以上初筛检测呈反应性标本是真阳性,小于3.8的假阳性高;国内的某些抗HCV 试剂即更高,个别甚至S/CO 值≥12.0 才有95%的真阳性[13]。本文抗-TP ELISA 的S/CO 值比较中,我们发现A、B 2 试剂的差异有统计学意义(P<0.05),2 种试剂的S/CO 值以TPPA 确认分类之间比较差异有统计学意义(P<0.01),见表2、图2,可能与它们包被的单克隆抗原和反应体系差异造成的,但是2 种试剂的检测形成了互补降低假阴性的可能,大大保证血液安全,见表3、表4 和图3。
2 种试剂ROC 曲线显示它们与TPPA 确认结果均具有较高的符合度,A、B 试剂灵敏度和特异性比较一致,S/CO 最佳阈值分别为11.5 和9.05,均可以预测大于95%的确认实验阳性结果。这与何芮[6]报道的万泰抗-TP ELISA 试剂最佳阈值8.99(即本研究的B试剂)基本一致。根据表4,我们发现A、B 试剂S/CO值(10~14.99)时阳性预测值分别达到95.3%、93.2%,有文献报道当S/CO 值达到一定高值时可以取消TPPA 的确认[14]直接屏蔽献血者。因此,笔者认为本文中2 种抗-TP ELISA 的S/CO 值均≥10 时,即无需作TPPA 的确认,可直接屏蔽这类献血者。而对于单试剂S/CO 值≥10 或双试剂S/CO 值均<10 的均需要进行TPPA 确认,再给献血者进行结果反馈和日后追踪复查,给这部分假阳性献血者正名,为日后尽早归队提供保障。
综上所述,对于“灰区”不及格献血者,笔者将继续追踪其复查检测数据以及收集更多的数据以探讨献血者梅毒筛查“灰区”中是否存在TP 真阳性的问题。潜伏性梅毒、不同梅毒期或者用药治疗后都会影响梅毒血清检测结果[15-16],所以需要严格把关献血者献血前的体格检测,同时梅毒的检测还需要综合考虑,对于ELISA 不确定结果还是要做TPPA 确认;不同抗-TP ELISA 血液筛查试剂有各自的最佳阈值,抗-TP ELISA 通过最佳S/CO 阈值和阳性预测值设定出适合本试验室在用试剂的“总最佳阈值”和使用条件。以上检测策略在保证检测质量同时能大大提高工作效率以及节省成本,从而更好地为献血者归队服务提供支持。
