Gefitinib 对人结肠癌Caco-2 细胞增殖与凋亡的影响
2021-05-06孙锦辉李春潮范旋燕全娟花广东医科大学附属医院消化内科广东湛江5400北京大学深圳医院皮肤性病科皮肤病研究所广东深圳58036
孙锦辉,李春潮,范旋燕,黄 聪,全娟花* (.广东医科大学附属医院消化内科,广东湛江 5400;.北京大学深圳医院皮肤性病科/皮肤病研究所,广东深圳 58036)
结肠癌由遗传和环境因素相互作用引起[1],目前早期癌可予内镜黏膜下剥离术治疗,中晚期癌首选根治性手术并辅以化疗,但肿瘤的复发转移以及耐药等问题使近30 年结肠癌的5 年生存率维持在50%~60%。近年来,肿瘤的靶向治疗可特异性作用于特定的分子,且对正常组织损伤较小,这为结肠癌的治疗提供了新的方向[2]。Gefitinib 是一种酪氨酸激酶受体抑制剂,有研究报道Gefitinib 对多种肿瘤有明显的抑制作用,而正常组织表现出良好的耐受性[3-4]。本研究主要通过体外实验探讨Gefitinib 对Caco-2 细胞增殖凋亡的影响及其潜在机制,为其应用于结肠癌的治疗提供理论依据。
1 材料和方法
1.1 材料
1.1.1 主要试剂与仪器 Gefitinib(美国Sigma 公司),人结肠癌细胞株Caco-2 购于中科院上海细胞库,胎牛血清FBS(乌拉圭Lonsera 公司),RPMI1640 培养基(美国HyClone 公司),100×青霉素/链霉素双抗(美国Gibco 公司),胰蛋白酶含0.25% EDTA(美国Sigma 公司),10×PBS 缓冲液(美国Solarbio 公司),Cell Banker2冻存液(日本ZENOAQ 公司),MTS(美国Promega公司),AnnexinV-FITC/PI 细胞凋亡检测试剂盒(日本Dojindo 公司),Texas RedTM-X Phalloidin 试 剂(美国Life Technologies 公司),DAPI (美国 Vector Laboratories 公司),JC-1 线粒体膜电位试剂盒、免疫染色固定液、免疫染色洗涤液、SDS-PAGE 凝胶配制试剂盒(中国碧云天公司),CETi Lysis Buffer(韩国Trans Lab 公司),BCA 试剂盒(中国Genstar 公司),0.2 μm PVDF 转印膜(美国Millipore 公司),20×TBS(美国Solarbio 公司),发光液(美国MILLIPORE 公司),α-Tubulin(美国SANTA CRUZ 公司),兔抗IgG-HRP、鼠抗IgG-HRP(美国Cell Signaling 公司),p-p38、p38、p-ERK、ERK、p-JNK、JNK、Caspase-3、PARP(美国Cell Signaling 公司),超声细胞破碎仪(中国宁波新芝生物公司),酶标仪(美国Thermo 公司)Azure c500(美国Azure Biosystems 公司),荧光显微镜(德国Leica 公司),流式细胞仪(美国BD 公司)
1.2 方法
1.2.1 细胞培养 将Caco-2 细胞培养于含10%胎牛血清、1%抗菌-抗真菌剂(青霉素、链霉素、两性霉素B)的RPMI1640 培养基中,置于37 ℃、5% CO2环境下培养,每3 d 更换培养基,待细胞融合度达到80%~90%,用含0.25%-EDTA 胰蛋白酶消化、传代备用。
1.2.2 MTS 检测Gefitinib 对Caco-2 细胞增殖的影响 取对数生长期的细胞,经胰酶消化后,用含10%胎牛血清的培养基配成活细胞密度为5×103个/mL 的细胞悬液,按每孔100 μL 接种于96 孔培养板中,培养24 h 后,更换含浓度为0、2.5、7.5、15、30 μmol/L Gefitinib 的完全培养基,每个浓度设4 个复孔。处理24、48、72 h 后参照MTS 试剂盒说明书操作,用酶标仪在492 nm 波长处测定各孔吸光值并计算细胞增殖抑制率,抑制率(IR)=(对照组吸光值-实验组吸光值)/对照组吸光值,统计并分析。
1.2.3 流式细胞术检测Gefitinib 对Caco-2 细胞凋亡的作用 取对数生长期的细胞,经胰酶消化后,用含10%胎牛血清的培养基配成活细胞密度为3×105个/mL 的细胞悬液,接种于6 孔板中,培养24 h 后,更换含浓度为0、2.5、7.5、15、30 μmol/L Gefitinib 的完全培养基,每个浓度设3 个复孔。处理48 h 后胰酶消化,收集细胞,用预冷PBS 漂洗1 次。Binding Solution 重悬细胞,调整细胞浓度为1×106个/mL,取100 μL 细胞悬液转移至流式管中,各加入FITC-Annexin V 和PI 溶液5 μL,室温避光孵育30 min 后加Binding Solution 400 μL,流式细胞仪检测。
1.2.4 细胞免疫荧光染色
1.2.4.1 细胞免疫荧光染色检测Gefitinib 对Caco-2细胞形态的影响 取对数生长期的细胞均匀接种于置有灭菌盖玻片的12 孔板(2×104个/孔)培养。用Gefitinib 处理后,取出细胞爬片,免疫染色固定液室温固定30 min。0.1% Triton X-100 透化10 min。滴加Texas Red®-X 鬼笔环肽(1 ∶100 稀释)暗盒室温放置30 min,染色细胞骨架。用DAPI 抗荧光淬灭封片剂封片,倒置荧光显微镜下观察细胞并采集图像。
1.2.4.2 细胞免疫荧光染色检测Gefitinib 对Caco-2细胞线粒体膜电位的影响 取对数生长期的细胞均匀接种于置有灭菌盖玻片的12 孔板(2×104个/孔)培养。用Gefitinib 处理后,每孔加入1 mL 配置好的JC-1染色工作液后于细胞培养箱中37 ℃孵育20 min,用预冷的JC-1 染色缓冲液洗涤3 次。取出细胞爬片,用甘油抗荧光淬灭封片剂封片,倒置荧光显微镜下观察细胞并采集图像。
1.2.5 Western-blot 检测细胞MAPK 通路及凋亡相关蛋白表达 取对数生长期的Caco-2 细胞接种于培养皿中,细胞贴壁后,用不同浓度的Gefitinib 处理Caco-2细胞48 h 后,收集上清液和贴壁细胞,用CETi Lysis Buffer 蛋白裂解液和超声细胞破碎仪裂解提取细胞蛋白并制备蛋白样品,进行SDS-PAGE 凝胶电泳,将蛋白电转至PVDF 膜。5%脱脂奶粉封闭液孵育1 h,一抗孵育过夜,二抗室温孵育1 h。用Azure Biosystems C500 近红外成像系统图像采集并利用Image J软件分析蛋白条带灰度值,进行统计分析。
1.3 统计学处理
采用Graphpad Prism 8.0 软件进行数据分析,计量资料以±s表示,组间差异采用单因素方差分析(One-way ANOVA)及LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 Gefitinib 对Caco-2 细胞增殖的影响
不同浓度(0、2.5、7.5、15、30 μmol/L)的Gefitinib处理Caco-2 细胞24、48、72 h 后,MTS 法检测细胞增殖。结果显示,在同一时间点,Caco-2 细胞的生长抑制率随着Gefitinib 浓度的增加而升高,而且在药物浓度相同的情况下,Caco-2 细胞的生长抑制率随着处理时间的延长而升高,提示Gefitinib 对Caco-2 细胞增殖的抑制呈浓度-时间依赖性,Caco-2 细胞的生长抑制率升高,与对照组比较,差异有统计学意义(P<0.05)。见表1、图1。
表1 不同浓度Gefitinib 处理Caco-2 细胞的细胞生长抑制率(±s,n=3,%)

表1 不同浓度Gefitinib 处理Caco-2 细胞的细胞生长抑制率(±s,n=3,%)
同一时间点,与0 μmol/L 组比较:aP<0.01;与2.5 μmol/L 组比较:bP<0.01;与7.5 μmol/L 组比较:cP<0.01;与15 μmol/L组比较:dP<0.01

图1 各组Caco-2 细胞生长抑制率的变化趋势
2.2 Gefitinib 对Caco-2 细胞凋亡的作用
以不同浓度(0、2.5、7.5、15、30 μmol/L)的Gefitinib处理Caco-2 细胞48 h 后,流式细胞术检测结果显示随着Gefitinib 浓度的递增,Caco-2 细胞的晚期凋亡率(Q2)和早期凋亡率(Q3)呈递增趋势;各实验组与0 μmol/L 组相比,晚期凋亡率(Q2)、早期凋亡率(Q3)和总凋亡率(Q2+Q3)差异有统计学意义(P<0.05),且呈浓度依赖性。结果提示Gefitinib 能促进Caco-2 细胞凋亡并呈浓度依赖性。见表2、图2。
2.3 免疫荧光染色观察Gefitinib 对Caco-2 细胞凋亡的作用
以不同浓度(0、2.5、7.5、15、30μmol/L)Gefitinib 处理Caco-2 细胞48 h 后,利用鬼笔环肽对细胞染色。图3 结果显示,0μmol/L 组的细胞微丝结构分布相对均匀,相互连成网状,周围边界清晰,有少量微丝触角,细胞核椭圆形,边界清晰,染色均匀。实验组的细胞随着Gefitinib 浓度的递增,细胞骨架微丝结构分布不均匀,边缘模糊,局部可见溶解或断裂现象,细胞体积逐渐缩小,细胞浆浓缩,细胞核固缩呈均一的团块状致密物,进而断裂为大小不一的片段。以上提示Gefitinib 可诱导Caco-2 细胞核碎裂和改变骨架微丝结构及分布。
表2 Gefitinib 处理Caco-2 细胞48 h 后的Q2、Q3、Q2+Q3凋亡率 (±s,n=3,%)

表2 Gefitinib 处理Caco-2 细胞48 h 后的Q2、Q3、Q2+Q3凋亡率 (±s,n=3,%)
同一时间点,与0 μmol/L 组比较:aP<0.01;与2.5 μmol/L 组比较:bP<0.01;与7.5 μmol/L 组比较:cP<0.01;与15 μmol/L组比较:dP<0.01

图2 AnnexinV-FITC/PI 双染法检测Gefitinib 对Caco-2 细胞凋亡的影响
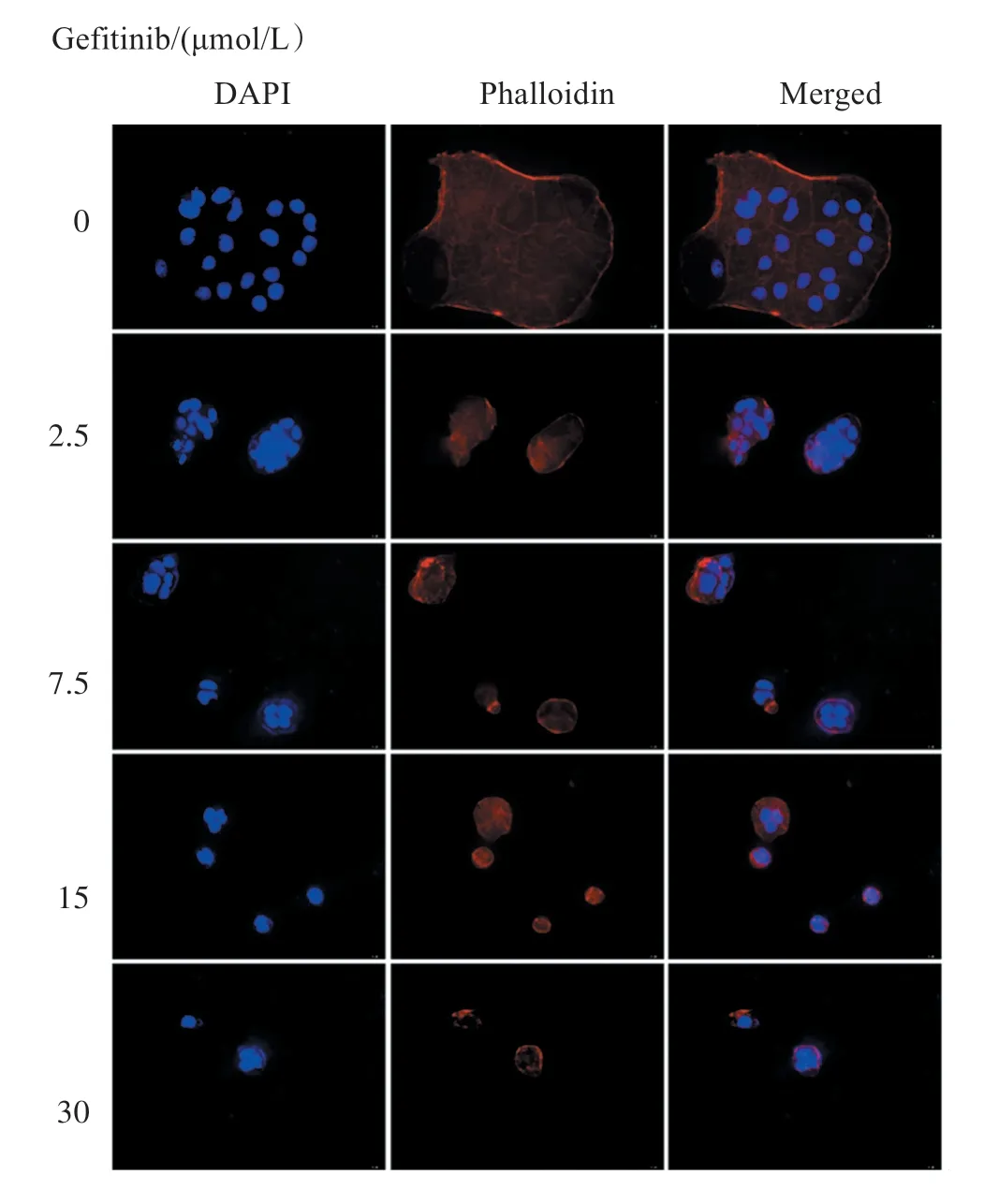
图3 免疫荧光染色观察Gefitinib 处理Caco-2 细胞核与细胞骨架微丝结构变化(×400)
2.4 免疫荧光染色观察Gefitinib 对Caco-2 细胞线粒体膜电位的影响
细胞线粒体膜电位的下降是细胞凋亡早期的标志性事件。在线粒体膜电位较高时,JC-1 聚集在线粒体的基质中,形成聚合物(aggregate),可产生红色荧光;在线粒体膜电位较低时,JC-1 不能聚集在线粒体的基质中,此时JC-1 为单体(monomer),可产生绿色荧光。以不同浓度(0、2.5、7.5、15、30 μmol/L)Gefitinib处理Caco-2 细胞48 h 后,JC-1 染色荧光显微镜下观察线粒体膜电位。图4 结果显示,实验组的细胞随着Gefitinib 浓度的递增,红色荧光逐渐减弱,绿色逐渐增强,提示Gefitinib 可通过降低Caco-2 细胞线粒体膜电位从而诱导凋亡。
2.5 Western-blot 检测细胞MAPK 通路相关蛋白表达
以不同浓度(0、2.5、7.5、15、30 μmol/L)的Gefitinib处理Caco-2 细胞48 h 后,Western-blot 检测MAPK 信号通路及凋亡相关蛋白表达。结果显示,Gefitinib 浓度依赖性显著上调p-p38、p-JNK MAPK 通路相关磷酸化蛋白和Cleaved-PARP 蛋白(89 kDa) 表达。同时随Gefitinib 浓度的增加,磷酸化p-ERK 和凋亡相关蛋白Caspase-3(35 kDa)表达量逐渐下调。见图5、6。
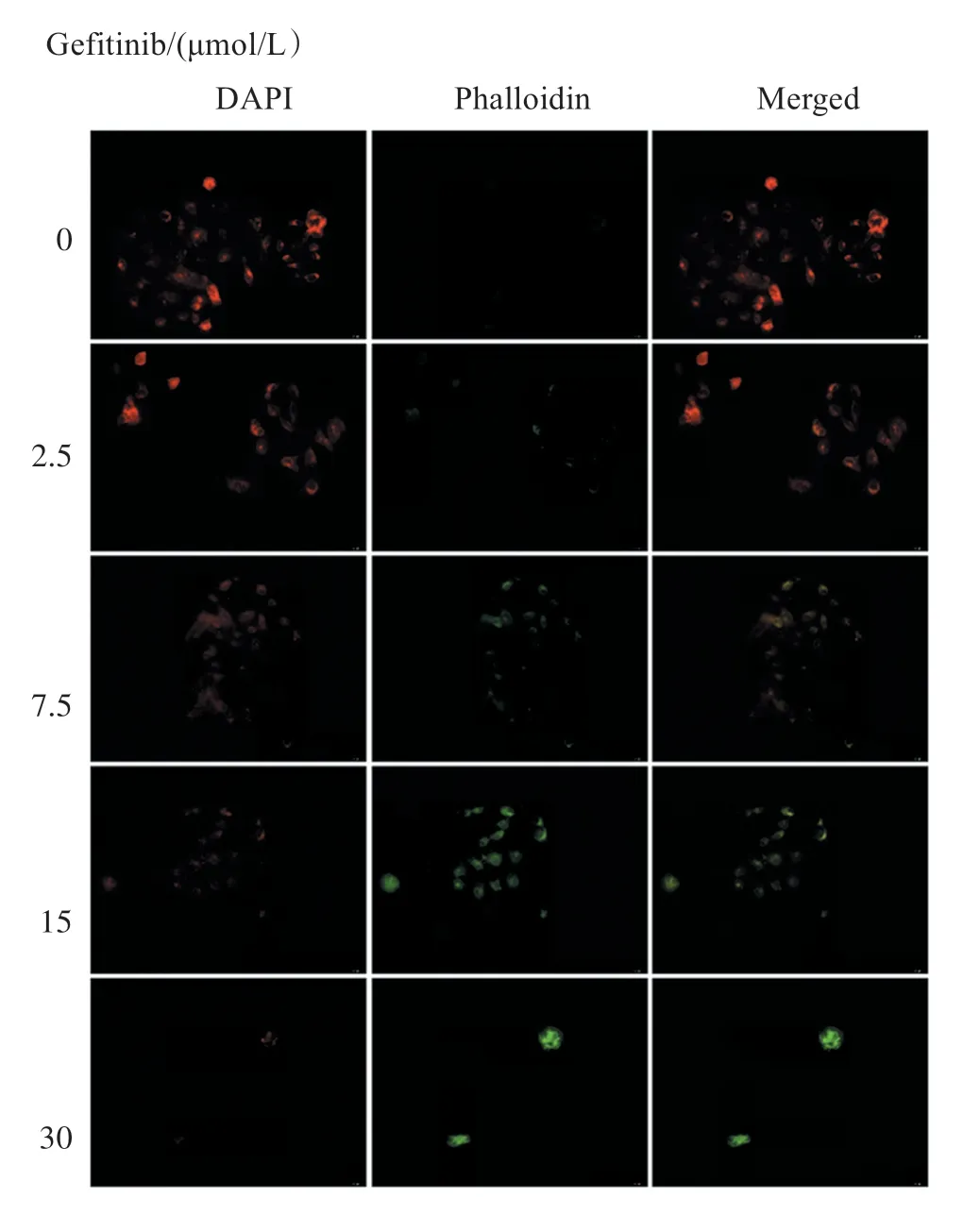
图4 免疫荧光染色观察Gefitinib 处理Caco-2 细胞后膜电位变化(×200)

图5 Gefitinib 处理Caco-2 细胞中Western-blot 检测MAPK 通路及凋亡相关蛋白表达水平
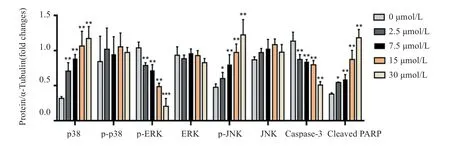
图6 Gefitinib 处理Caco-2 细胞中检测MAPK 通路及凋亡相关蛋白相对表达水平
3 讨论
直肠癌是常见的恶性肿瘤,发病率及病死率在国内外有逐年上升的趋势,目前临床治疗以根治性手术结合化疗为主,但传统的放化疗效果差,毒性不良反应明显,且细胞存在耐药性,患者5 年生存率并不理想[5]。分子靶向治疗是近年肿瘤治疗的热点领域,在对抗肿瘤方面具有较强的针对性,且对正常细胞的毒性不良反应相对较小[6]。
有研究表明EGFR 在结直肠癌等多种实体瘤中存在过表达或异常表达的情况,是目前最为主要的靶点之一[7]。Gefitinib 作为EGFR 通路抑制剂,可竞争性结合受体,抑制MAPK 活化,从而抑制肿瘤组织血管生成,并诱导肿瘤细胞凋亡[3,8]。
细胞凋亡是指为了维持内环境稳定,由基因控制细胞的自主有序的死亡,这是一个主动的过程,涉及细胞形态学变化及一系列基因的激活、表达、调控等作用[9]。MTS 以及AnnexinV-FITC/PI 双染检测细胞凋亡结果提示,在0~30 μmol/L 的浓度范围和24~72 h 的时间范围内,Gefitinib 对Caco-2 细胞增殖的抑制呈浓度-时间依赖性,并且使细胞早期和晚期凋亡率逐步升高。在细胞形态学方面,本研究的荧光双标记结果提示,随着Gefitinib 浓度的递增,细胞核固缩破裂,染色质皱缩浓集,骨架微丝溶解断裂,进一步验证Gefitinib 能促进Caco-2 细胞凋亡。
细胞信号通路是细胞凋亡的重要调控机制。由于细胞凋亡启动阶段的差异,可分为:(1)线粒体通路,受到内源性刺激使线粒体膜电位降低,释放凋亡酶激活因子激活caspase 级联反应;(2)死亡受体通路,由于外界凋亡信号启动,TNFR 及其配体介导进而激活cspase8 及随后的级联反应;(3)内质网通路,由内质网失常引起,从而破坏Ca2+平衡和蛋白合成,引起凋亡[10]。
有丝分裂原活化蛋白激酶(MAPK)是一种可被多种信号激活的丝/苏氨酸激酶,经磷酸化后可参与多种生物活性,如调节基因转录、细胞周期、诱导凋亡等[11-12]。现已发现MAPK 有p38、ERK、ERK5、JNK4个亚族,其中p38、ERK、JNK3 条通路与肿瘤细胞凋亡尤为密切。有研究发现Gefitinib 能通过JNK 通路影响Bax/Bcl-2 比例从而促进线粒体释放细胞色素c,进而诱导小细胞肺癌和前列腺癌细胞发生凋亡[13-14]。本文结果发现,不同浓度Gefitinib 处理细胞后,p-p38、p-JNK 和Cleaved-PARP 蛋白发生不同程度的浓度依赖性上调,而p-ERK 和凋亡关键蛋白Caspase-3 表达逐渐下降。此外JC-1 免疫荧光染色观察显示随着Gefitinib 浓度升高,红色/绿色荧光逐渐降低。这些结果提示Gefitinib 可能通过MAPK 通路介导线粒体膜电位减低,从而诱导人结肠癌Caco-2发生凋亡。
综上所述,本研究在细胞层面证明了Gefitinib 对Caco-2 增殖有明显抑制作用,可促进细胞凋亡。其机制可能为Gefitinib 通过调节Caco-2 细胞中p-p38、p-ERK、p-JNK 磷酸化蛋白的表达介导线粒体膜电位的降低,释放出凋亡酶激活因子激活caspase 级联反应,使Caspase-3 活化进而使PARP 蛋白在内的多种关键细胞底物发生裂解,最终诱导细胞发生凋亡。但本实验仅限于体外实验,Gefitinib 对Caco-2 细胞周期的影响,以及在动物体内的抗肿瘤活性尚不明确,相关机制还有待进一步研究。
