浅低温对心肌缺血-再灌注损伤合并脓毒症大鼠模型的心肌保护作用
2021-05-02秦竹韵申世轩曲开勇曹芳芳张海涛
秦竹韵,申世轩,曲开勇,曹芳芳,张海涛
急性心肌梗死(AMI)与脓毒症均是造成全球主要疾病负担的原因[1-2]。AMI患者进行血管再通治疗后合并脓毒症在心脏重症监护室常见。一项前瞻性研究表明,AMI合并脓毒症的患者死亡风险较单纯AMI患者显著增加[3]。
AMI是由于冠状动脉长时间闭塞所导致,而血流的恢复也会对心肌造成损伤。部分AMI患者因病情较重而导致住院时间延长,易发生院内感染和发展为脓毒症。脓毒症是宿主机体感染后所致的一系列综合征,可导致包括心脏在内的多器官功能障碍[4]。心肌缺血-再灌注(I/R)损伤合并脓毒症可造成心肌的氧化应激损伤、炎症和凋亡。烟酰胺腺嘌呤二核苷酸磷酸氧化酶2(NOX2)是在心肌梗死以及脓毒症中均可产生的一种主要的活性氧物质[5-6]。肿瘤坏死因子-α(TNF-α)可反映心肌I/R损伤合并脓毒症中心肌炎症情况[7]。此外,胱天蛋白酶-3(caspase-3)的表达增加可反映凋亡的发展[8]。因疾病机制复杂,心肌I/R损伤合并脓毒症目前的临床治疗效果欠佳,目前尚少见有关其治疗的文献报道。
浅低温(32℃~35℃)能降低机体代谢,促进损伤恢复。在动物模型中,浅低温分别被证实可改善心肌I/R损伤和脓毒症的症状[9-10]。因此,浅低温对心肌I/R损伤合并脓毒症可能也有保护作用。本研究通过建立SD大鼠的心肌I/R损伤合并脓毒症疾病模型,从心功能、心肌梗死面积、心肌损伤、氧化应激、炎症和凋亡方面探究浅低温对心肌的保护作用。
1 材料与方法
1.1 实验动物及分组
选用健康雄性SD大鼠15只,体重400~600 g,所有动物购于北京维通利华实验动物技术有限公司。实验前予以大鼠清洁饮食,观察7 d,无异常反应。大鼠随机分为3组:心肌I/R损伤合并脓毒症浅低温(MHT)组,心肌I/R损伤合并脓毒症常温(NT)组,假手术常温组作为对照组,每组大鼠选用5只。
1.2 心肌I/R损伤合并脓毒症模型制作
心肌I/R损伤模型按常规方法建立[11]。首先结扎前降支约30 min后抽出尼龙线使血管再通建立缺血再灌注损伤模型,然后抽出尼龙线同时将内毒素(LPS,O111B4,Sigma公司,美国)15 mg/kg腹腔注射至大鼠体内建立脓毒症模型,对照组注射等量生理盐水(NS)。大鼠基础左心室收缩压95~115 mmHg(1 mmHg=0.133 kPa),约15 min后下降至基础值60%~70%左右(约60~80 mmHg)并维持1 h以上表示脓毒症模型建立成功[12]。
1.3 温度控制
实验中大鼠的正常体温在(37.0±0.5)℃,核心体温通过检测肛温实现。注入LPS或生理盐水同时,将MHT组大鼠置于冰床上降温,每隔5 min检测一次肛温,15 min降至目标温度(33.0±0.5)℃,然后维持2 h。NT组及对照组实验全程用加热手术台及红外线灯照射维持在常温,防止大鼠因麻醉所导致的体温丢失。
1.4 观察指标
目标温度维持2 h后,抽取静脉血并处死大鼠取心脏。检测大鼠心肌损伤标志物、心肌病理变化、心肌梗死面积、氧化应激、凋亡和炎症的情况。
1.4.1血流动力学指标 :实验全程用Powerlab系统记录心率、左心室最大收缩压、左心室舒张末期压力(LVEDp)、收缩期压力最大变化速率(+max dp/dt)及舒张期压力最小变化速率(-min dp/dt)等血流动力学指标的变化。
1.4.2心肌损伤标志物:经颈静脉抽血用酶联免疫吸附测定法检测乳酸脱氢酶(LDH)、肌酸激酶同工酶(CK-MB)含量。将血样离心取上清,加样,封板后置 37℃孵育 60 min,再洗涤、拍干,然后加入显色剂于37℃暗处反应 20 min,终止反应后测定吸光度。
1.4.3心肌病理学变化:将大鼠结扎部位以下心肌组织放置在4%多聚甲醛溶液中固定。经乙醇梯度脱水,石蜡包埋,切片,进行苏木精-伊红(HE)染色,然后用光学显微镜观察心肌组织病理形态学变化。
1.4.4心肌梗死面积测定:目标温度维持2 h后,将1 ml 1%氯化三苯基四氮唑(TTC)及2 ml 1%伊文思蓝注入大鼠颈静脉将心脏染色,然后取材。粉红色区域为梗死区,蓝色为非缺血心肌区域。将心脏快速冻至-80℃ 20 min后取出,切成5个约2 mm薄片。图片用Image Pro Plus 6.0软件测量心肌梗死范围,心肌梗死程度用梗死面积占总面积比例表示。
1.4.5免疫印迹法检测NOX2表达:取 20 mg大鼠心脏组织加入裂解液提取总蛋白,BCA试剂盒进行蛋白定量。聚丙烯酰胺凝胶电泳后,转至聚偏氟乙烯膜,用5%脱脂奶的 TBST液封闭 1 h,洗涤 3次,然后用兔抗鼠 NOX2抗体及兔抗鼠 β-肌动蛋白(β-actin)单克隆抗体(1∶2 000稀释)孵育,4℃过夜,加入辣根过氧化物酶标记的羊抗兔 IgG(1∶2 000稀释),化学发光法进行成像。β-actin作为内参蛋白。用 Image J软件分析条带灰度值,计算NOX2和β-actin比值作为NOX2的相对表达量。
1.4.6免疫组化检测caspase-3和TNF-α 表达:基于HE染色结果,包含心肌梗死区域的心肌组织用石蜡包埋、封闭后,用抗TNF-α 和caspase-3抗体孵育于4℃,过夜。在室温下用二抗孵育1 h。将3,3’-二氨基联苯胺/过氧化氢加到切片表面,室温染色10 min,然后成像。计算caspase-3或TNF-α 阳性细胞背景与总细胞背景的比值作为caspase-3或TNF-α 相对表达量。
1.5 统计学方法
实验结果采用SPSS 26.0软件进行处理,计量资料用均数±标准差()表示。两组间均数比较使用独立样本t检验,多组间比较使用重复测量的方差分析,两两比较用LSD法(方差齐时)或用Dunnett T3法(方差不齐时),非正态分布资料比较用 Kruska-Wallis检验。P<0.05为差异有统计学意义。
2 结果
2.1 浅低温对血流动力学的影响(表1)
MHT组再灌注2 h心率较NT组降低[(396.63±39.93)次/min vs.(457.74±32.77)次/min,P<0.05];左心室最大收缩压升高[(129.14±34.05)mmHg vs.(85.63±14.74)mmHg,P<0.05],差异均有统计学意义;MHT组+max dp/dt再灌注2 h较NT组及对照组升高,但差异无统计学意义;LVEDp和-min dp/dt再灌注2 h绝对值也较NT组及对照组均有所增加,但差异均无统计学意义(P均>0.05)。
2.2 浅低温对心肌损伤的影响(表2、图1)
NT组LDH及CK-MB显著高于对照组,差异均有统计学意义(P均<0.05)。MHT组LDH及CK-MB均高于对照组,但差异均无统计学意义(P均>0.05)。MHT组LDH及CK-MB均显著低于NT组,差异均有统计学意义(P均<0.05)。HE染色光镜下MHT组心肌细胞相对完整,心肌坏死呈点状或灶状,心肌间质淤血程度轻且炎细胞浸润较少。NT组的心肌出现水肿、灶状或片状坏死,心肌间质区淤血程度重及存在大量炎细胞浸润。对照组心肌细胞排列整齐,结构完整。
2.3 浅低温对心肌梗死面积的影响
对照组心肌无明显缺血区,MHT组及NT组出现心肌梗死。MHT组与NT组相比,心肌梗死面积比率明显减少[(11.23±2.82)% vs.(19.25±4.45)%,P<0.05],差异有统计学意义。
2.4 浅低温对心肌氧化应激的影响(表3、图2)
免疫印迹法检查结果显示,NT组及MHT组NOX2表达少量增加。NT组NOX2的相对表达量较对照组增加,差异有统计学意义(P<0.05)。MHT组NOX2的相对表达量较对照组增加,差异无统计学意义(P>0.05)。MHT组较NT组相对表达量减少,但差异亦无统计学意义(P>0.05)。
表1 各组大鼠不同时间段的血流动力学数据变化(n=5,)
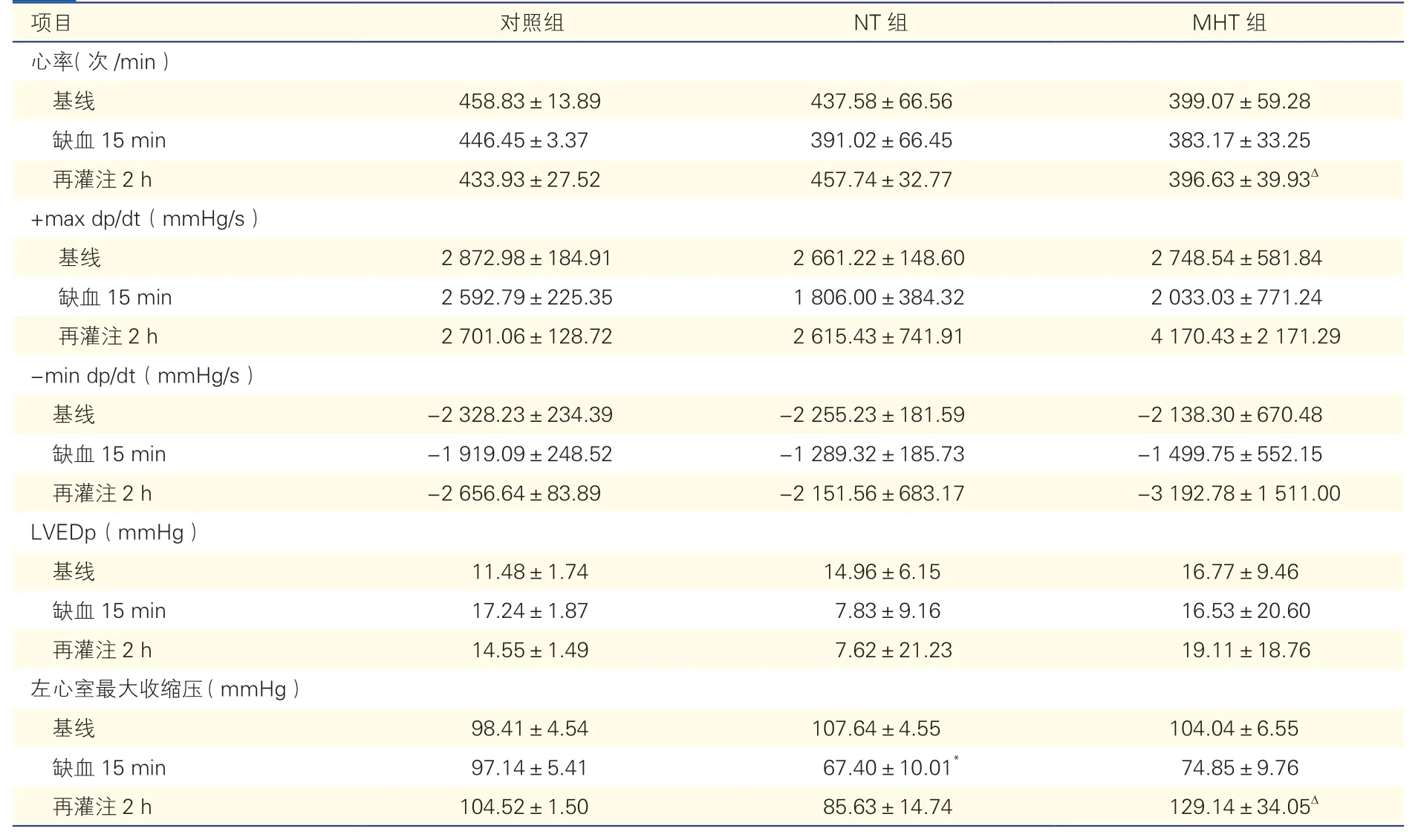
表1 各组大鼠不同时间段的血流动力学数据变化(n=5,)
注:NT:常温;MHT:浅低温;+max dp/dt:收缩期压力最大变化速率;-min dp/dt:舒张期压力最小变化速率;LVEDp:左心室舒张末期压力。与对照组比较*P<0.05;与NT组比较Δ P<0.05。1 mmHg=0.133 kPa
表2 浅低温维持2 h后各组大鼠LDH和CK-MB水平比较(U/L,n=5,)

表2 浅低温维持2 h后各组大鼠LDH和CK-MB水平比较(U/L,n=5,)
注:NT:常温;MHT:浅低温;LDH:乳酸脱氢酶;CK-MB:肌酸激酶同工酶。与对照组比较*P<0.05;与NT组比较△P<0.05
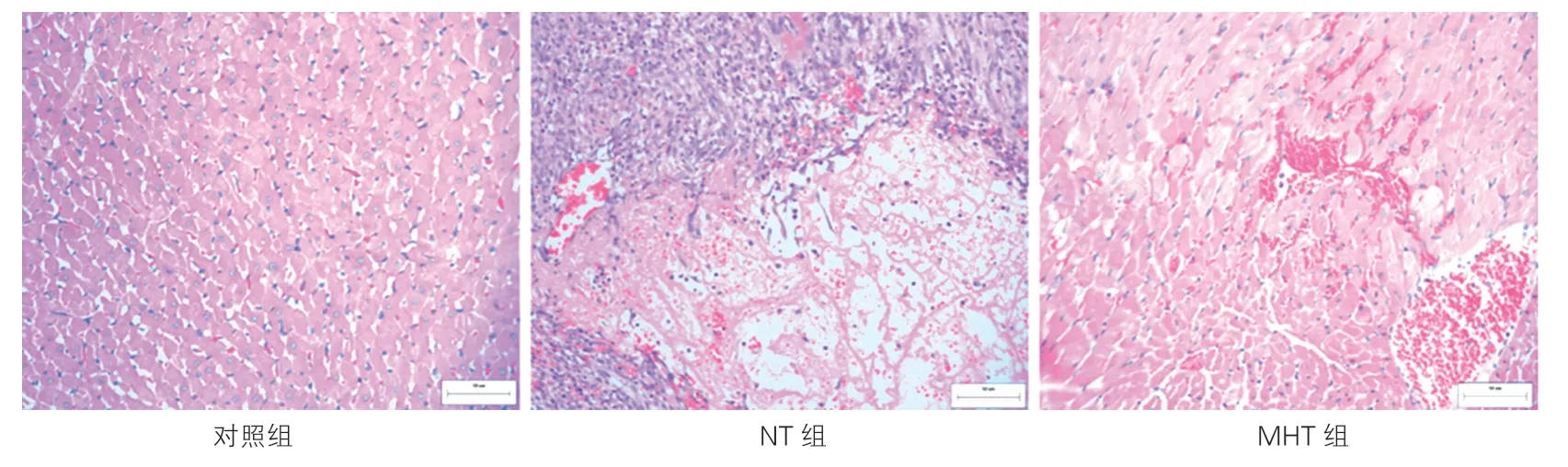
图1 浅低温维持2 h后光镜下各组大鼠心肌组织病理学变化(×200)
表3 浅低温维持2 h后各组大鼠NOX2、caspase-3及TNF-a相对表达量(%,n=5,)

表3 浅低温维持2 h后各组大鼠NOX2、caspase-3及TNF-a相对表达量(%,n=5,)
注:NT:常温;MHT:浅低温;NOX2:烟酰胺腺嘌呤二核苷酸磷酸氧化酶2;caspase-3:胱天蛋白酶-3;TNF-α:肿瘤坏死因子-α。与对照组比较*P<0.05;与NT组比较△P<0.05
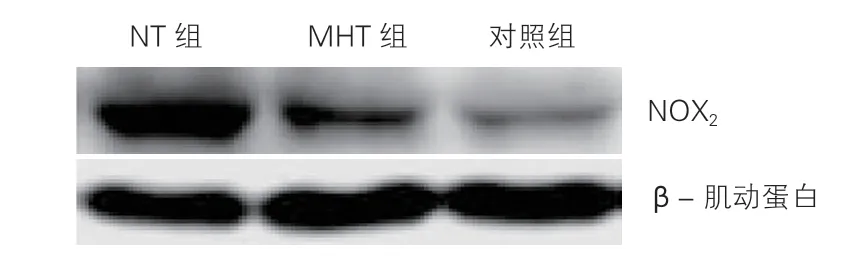
图2 浅低温维持2 h后各组大鼠免疫印迹法NOX2表达情况
2.5 浅低温对心肌凋亡及炎症的影响(表3、图3)
免疫组化检测NT组caspase-3及TNF-a的相对表达量较对照组显著增高,差异均有统计学意义(P均<0.05)。MHT组caspase-3及TNF-a的相对表达量均较对照组升高,但差异均无统计学意义(P均>0.05)。MHT组caspase-3及TNF-a的相对表达量较NT组降低,差异均有统计学意义(P均<0.05)。
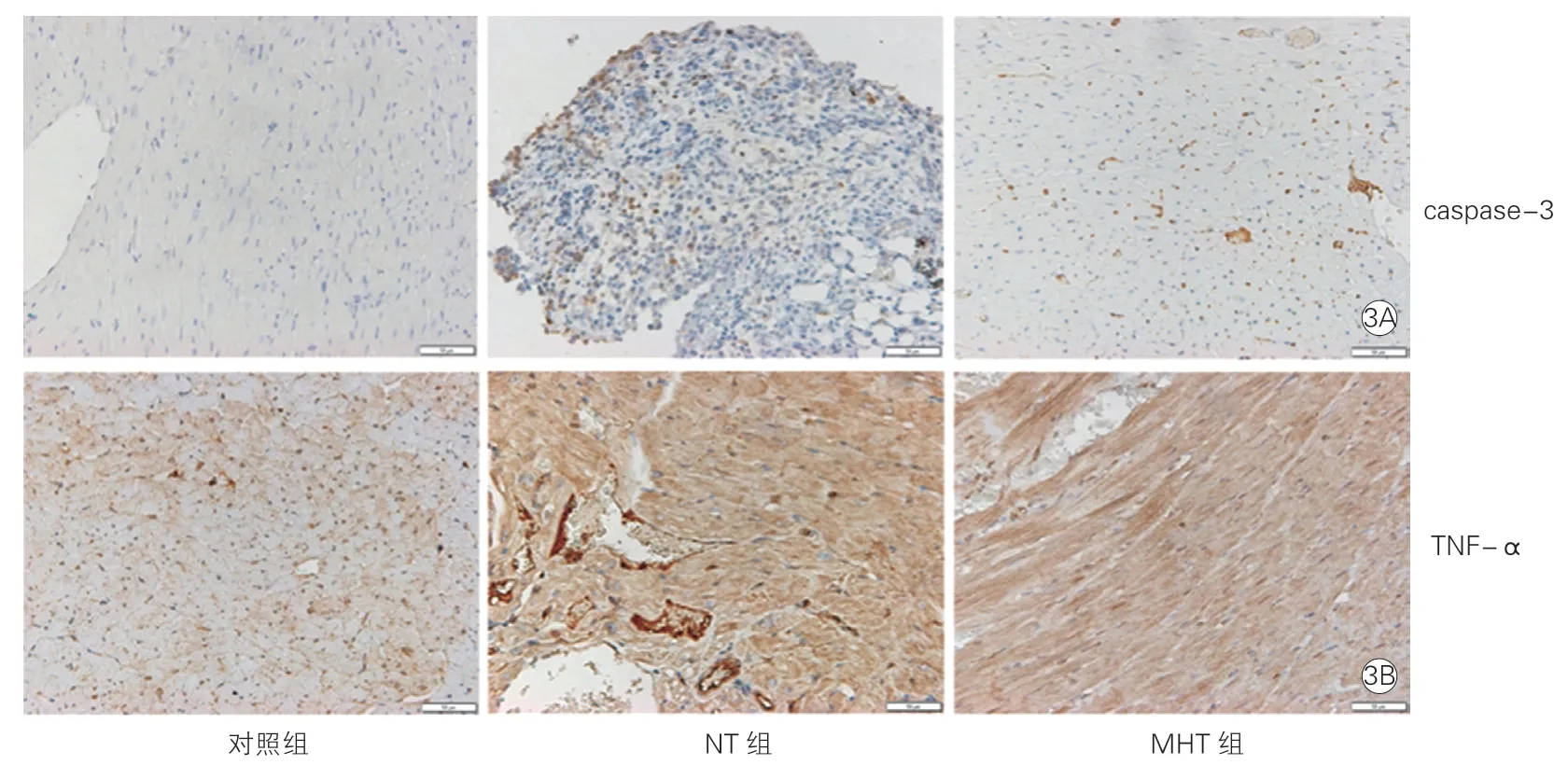
图3 浅低温维持2 h后光镜下各组大鼠免疫组化分析中caspase-3(3A)及TNF-α(3B)的表达(×200)
3 讨论
本研究成功建立SD大鼠心肌I/R损伤合并脓毒症模型,并通过在模型中应用浅低温证实其可改善心肌的收缩和舒张功能,减少心肌梗死面积,减轻心肌损伤,也有抗心肌氧化应激、凋亡和炎症反应的作用。
浅低温在其他动物实验中已被证实有正性肌力的作用,可以改善心脏收缩及舒张功能。Huang等[13]在一项将心跳骤停的动物实验中应用浅低温,发现+max dp/dt、-min dp/dt和心输出量增加,提示心脏收缩及舒张功能均有改善,本研究结果与此类似。本研究中的MHT组中,心率较前降低,但LVEDp、左心室最大收缩压、+max dp/dt及-min dp/dt均有上升,提示大鼠的心输出量增加。而NT组中虽然心率增加,但心脏的舒缩压及速率均较基线减少,提示大鼠心功能受损。这证实在心肌I/R损伤合并脓毒症中存在心功能损害,浅低温有改善心脏收缩及舒张功能的作用。然而,MHT组及浅低温维持2 h后+max dp/dt、LVEDp和-min dp/dt结果较NT组及对照组差异均无统计学意义,究其原因可能是因为大鼠样本较少,或低温时间需延长等。
既往动物实验表明,浅低温可减少心肌I/R损伤的梗死面积,但对于降温时机存在争议。Dash等[14]的一项在猪心肌I/R损伤模型研究中,降温时机选在再灌注前30 min,结果示心肌梗死面积明显减少。Kanemoto等[15]研究显示,在开始再灌注时降温,可最大限度减少心肌梗死面积。Marek-Iannucci等[16]在心肌I/R损伤猪模型中选择再灌注后30 min降温,心肌梗死面积也有所减少。然而,Hale等[17]在兔心肌I/R损伤模型中将降温时机应用在再灌注后30 min,结果显示虽然浅低温可改善无复流现象,但心肌梗死面积并未减少。在本研究中,降温时机在再灌注同时,MHT组的心肌梗死面积较NT组心肌梗死面积显著减少,这与Kanemoto等[15]研究结果一致,提示即使在心肌I/R损伤合并脓毒症的情况下,在再灌注治疗同时降温也可减少心肌梗死面积。
本研究显示,浅低温减少心肌梗死面积是通过减轻心肌损伤实现的。心肌损伤时,包括LDH和CK-MB在内的心肌损伤标志物释放入循环中,LDH和CK-MB的升高可协助AMI的诊断,其升高程度可代表心肌受损程度[18]。本实验中,MHT组中的LDH和CK-MB较NT组减低,且MHT组和对照组升高程度相比差异无统计学意义,证明浅低温可以缓解心肌损伤。此外,在病理学层面上,HE染色直接显示MHT组心肌受损程度较NT组明显减轻,心肌坏死较NT组少,且炎细胞浸润较少。
NOX2是AMI和脓毒症中均可产生的氧化应激相关物质[5-6]。本研究显示NOX2在MHT组较NT组表达减少,但差异无统计学意义,可能与样本量较少有关。此外,在本实验中,心肌I/R损伤合并脓毒症导致提示炎症反应的炎症标志物TNF-α 及提示心肌细胞凋亡的caspase-3升高,而浅低温有改善心肌炎症及抗心肌细胞凋亡的作用。
综上所述,本研究从心功能、心肌梗死面积、心肌损伤程度、氧化应激、炎症及凋亡几方面证实了浅低温在心肌I/R损伤合并脓毒症的心肌保护作用,为临床心肌I/R损伤合并脓毒症的危重患者的治疗提供了动物研究基础。然而,本实验通过注射LPS建立的脓毒症模型与临床上病原微生物导致的脓毒症有区别,且大鼠与人之间物种之间的差别可导致结果不一致,故浅低温对为临床心肌I/R损伤合并脓毒症患者的有效性有待进一步研究。
利益冲突:所有作者均声明不存在利益冲突
