肥厚型心肌病患者的心肺功能评估和相关因素研究
2021-05-02胡小莹乔树宾孙兴国胡奉环杨伟宪贾玉和袁建松高晓津罗晓亮刘方翟文轩杨洁张也
胡小莹,乔树宾,孙兴国,胡奉环,杨伟宪,贾玉和,袁建松,高晓津,罗晓亮,刘方,翟文轩,杨洁,张也
肥厚型心肌病(HCM)是最常见的一种遗传性心脏病,中国HCM患病率为80/10万,粗略估算中国成人HCM患者超过100万[1]。HCM患者可无症状或症状轻微,但多数HCM患者存在劳力性呼吸困难等心功能不全症状,部分患者可出现胸痛、心悸、晕厥,甚至猝死[2]。在Tufts-HCM队列中,有50%的HCM患者NYHA心功能分级Ⅱ~Ⅳ级[3]。
目前临床工作中评估HCM患者心功能的指标主要包括NYHA心功能分级和N末端B型利钠肽原(NT-proBNP)。NYHA心功能分级易于获得,但多为患者主观感受,界限模糊且变异性大,多用来初步评估患者心功能情况。NT-proBNP是B型利钠肽(BNP)的前体,是评估心力衰竭程度的常用指标,但其受循环负荷变化、肾功能不全等情况的影响,检测结果波动较大。
心肺运动试验(CPET)是基于外呼吸与细胞呼吸正常耦联原理,在运动状态下综合性评估患者心脏、肺部以及骨骼肌功能的无创检查方法[4]。峰值摄氧量(peak VO2)是CPET的核心指标,指人体在极量运动时最大摄氧能力,也代表人体供氧能力的极限水平。国外研究发现,peak VO2可用于HCM的鉴别诊断、心肺功能评估监测及预后判断[5]。Sharma等[6]的研究显示,peak VO2>50 ml/(min·kg)可鉴别运动员心脏肥厚和HCM患者。Coats等[7]的研究发现,peak VO2是HCM患者死亡或心脏移植的独立危险因素,peak VO2每下降1 ml/(min·kg),死亡或心脏移植的风险升高21%(11%~26%)。但在我国的临床实践中,CPET多用于评估心脏移植[8]的指征及肺动脉高压[9-10]、心力衰竭[11]、冠心病[12]等心血管疾病的病情及预后,目前尚未广泛用于HCM患者的临床诊治。本研究旨在利用CPET、NYHA心功能分级及NT-proBNP评估HCM患者的心肺运动功能情况,分析peak VO2与NYHA心功能分级及NT-proBNP的相关性,并探究peak VO2减低的相关因素。
1 资料与方法
1.1 研究对象
连续入选2018年4月至2019年8月期间在中国医学科学院阜外医院功能检测中心行CPET的HCM患者129例为HCM组。入选标准:(1)符合2017年《中国成人肥厚型心肌病诊断与治疗指南》[1]制定的HCM诊断标准,即二维超声心动图测量的室间隔或左心室室壁厚度≥15 mm,或者有明确家族史者左心室室壁厚度≥13 mm,但需排除负荷增加如高血压、主动脉瓣狭窄和先天性主动脉瓣下隔膜等引起的左心室室壁增厚者。(2)年龄18~70岁。排除标准:NYHA心功能Ⅳ级;静息血压≥180/100 mmHg(1 mmHg=0.133 kPa),药物控制不佳;合并急性心肌梗死者;任何不能耐受运动的情况;已行外科左心室流出道疏通术或室间隔酒精消融术的患者。另选择113例与HCM组性别、年龄、体重匹配及无基础心肺疾病的健康体检者作为正常对照组。
1.2 患者的临床资料收集
一般情况:包括性别、年龄、体重指数(BMI)、NYHA心功能分级、既往史、个人史及家族史(包括合并冠心病、冠状动脉肌桥、高血压病、2型糖尿病病史、吸烟、HCM家族史、猝死家族史)以及NT-proBNP。
心电图及24 h动态心电图(Holter)相关指标:包括静息心电图前壁导联ST段压低≥0.1 mV、前壁导联T波倒置、左心室高电压、频发室性早搏(24 h≥1 000次)、短阵室性心动过速、心房颤动/心房扑动。
超声心动图检查指标:静息时侧卧位行二维超声、M型超声及多普勒超声测量左心房前后径、左心室舒张末期内径、左心室射血分数、最大左心室室壁厚度、左心室后壁厚度、二尖瓣收缩期前向运动现象、二尖瓣反流情况(分为无、轻度及中、重度)、左心室流出道峰值压差(LVOTG)、肺动脉收缩压;静息LVOTG ≥30 mmHg确定为肥厚型梗阻性心肌病,静息时LVOTG<30 mmHg,行运动激发试验,若激发后LVOTG ≥30 mmHg确定为隐匿性肥厚型梗阻性心肌病。静息时肺动脉收缩压≥30 mmHg定义为肺动脉高压。
1.3 心肺运动试验检查
HCM组及正常对照组均签署知情同意书后行CPET检查。在医生的全程监督下,应用Quark PFT4 ergo心肺运动系统(COSMED公司,意大利)进行标准递增功率的症状限制性踏车运动试验,过程包括3 min静息,3 min无负荷、60 r/min速度踏车热身,继之速度不变、以10~15 W/min递增负荷功率直至最大运动耐力,之后进入恢复期观察5 min以上[5]。全程监护并记录患者的心率、袖带血压、心电监测及血氧饱和度,记录每次呼吸的通气量、摄氧量及二氧化碳排出量等指标,计算得出分钟通气量、摄氧量、二氧化碳排出量和其他运动指标,逐秒切割,每隔10 s取平均值[13]。通过计算峰值运动时最大连续30 s的平均摄氧量得出peak VO2。运动试验结束后计算出无氧域、二氧化碳通气当量(VE/VCO2)斜率、氧脉搏等指标。
出现下列任意一种情况则终止CPET:患者出现胸痛、呼吸困难、头晕、心悸、下肢疼痛、站立不稳或感到疲劳要求终止;出现室性心动过速、多源性室性早搏、二度Ⅱ型以上房室阻滞或窦性停搏等严重心律失常。
1.4 统计学方法
应用SPSS 23.0软件进行统计分析。正态分布连续变量用均值±标准差表示,比较采用方差分析,偏态分布的连续变量用中位数(P25,P75)表示,比较采用非参数检验;分类变量用例数(百分比)表示,比较采用卡方检验。对正态分布的连续变量应用Pearson相关分析,对非正态分布的连续变量及分类等级资料做Spearman相关分析。应用线性多元回归分析对连续变量进行多元回归分析,将单因素分析中有统计学意义的指标纳入多元回归方程。P<0.05为差异有统计学意义。
2 结果
2.1 HCM组129例患者的一般情况及各项检查结果(表1)
HCM组患者平均年龄(47.1±12.5)岁,男性占73.6%。NYHA心功能Ⅰ级者占31.8%,Ⅱ级者占55.8%,Ⅲ级者占12.4%;NT-proBNP呈偏态分布,中位数为647.4(287.8,1 401.0)pg/ml;最大左心室室壁厚度为(22.4±5.1)mm。

表1 HCM组患者一般情况及各项检查结果[例(%)]
2.2 HCM组与正常对照组的一般情况及CPET指标比较(表2)
两组受试者均完成了CPET检查,无恶性心律失常、晕厥、猝死等严重不良事件发生。两组的性别、年龄、体重、静息收缩压及舒张压差异均无统计学意义(P均>0.05)。HCM组的peak VO2、无氧阈及氧脉搏均较正常对照组减低(P均<0.05),而HCM组的VE/VCO2斜率较正常对照组升高(P均<0.05)。HCM组的峰值收缩压、峰值舒张压以及静息心率、峰值心率均较正常对照组降低(P均<0.05)。
表2 HCM组与正常对照组的一般情况及CPET指标()
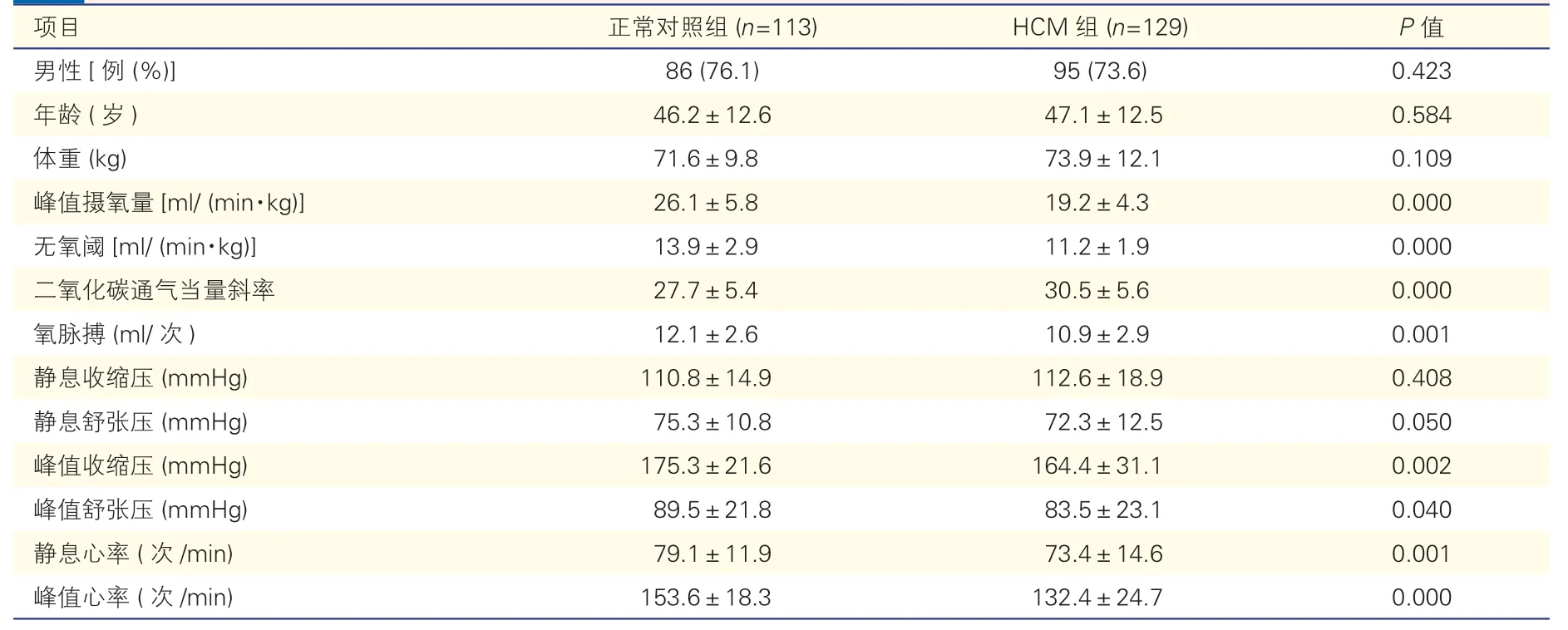
表2 HCM组与正常对照组的一般情况及CPET指标()
注:HCM:肥厚型心肌病;CPET:心肺运动试验。1 mmHg=0.133 kPa
2.3 HCM组NYHA心功能Ⅰ级者与正常对照组的一般情况及CPET指标比较(表3)
为进一步分析NYHA心功能Ⅰ级HCM患者的心肺功能情况,本研究将HCM组41例NYHA心功能Ⅰ级者与正常对照组进行比较。结果显示,与正常对照组相比,NYHA心功能Ⅰ级HCM患者的年龄、体重、静息和峰值收缩压及舒张压、静息心率以及VE/VCO2斜率差异均无统计学意义(P均>0.05)。但心功能Ⅰ级HCM患者的peak VO2斜率、无氧阈及氧脉搏以及峰值心率均较正常对照组减低(P均<0.05)。
表3 HCM组NYHA心功能I级者与正常对照组的一般情况及CPET指标比较()
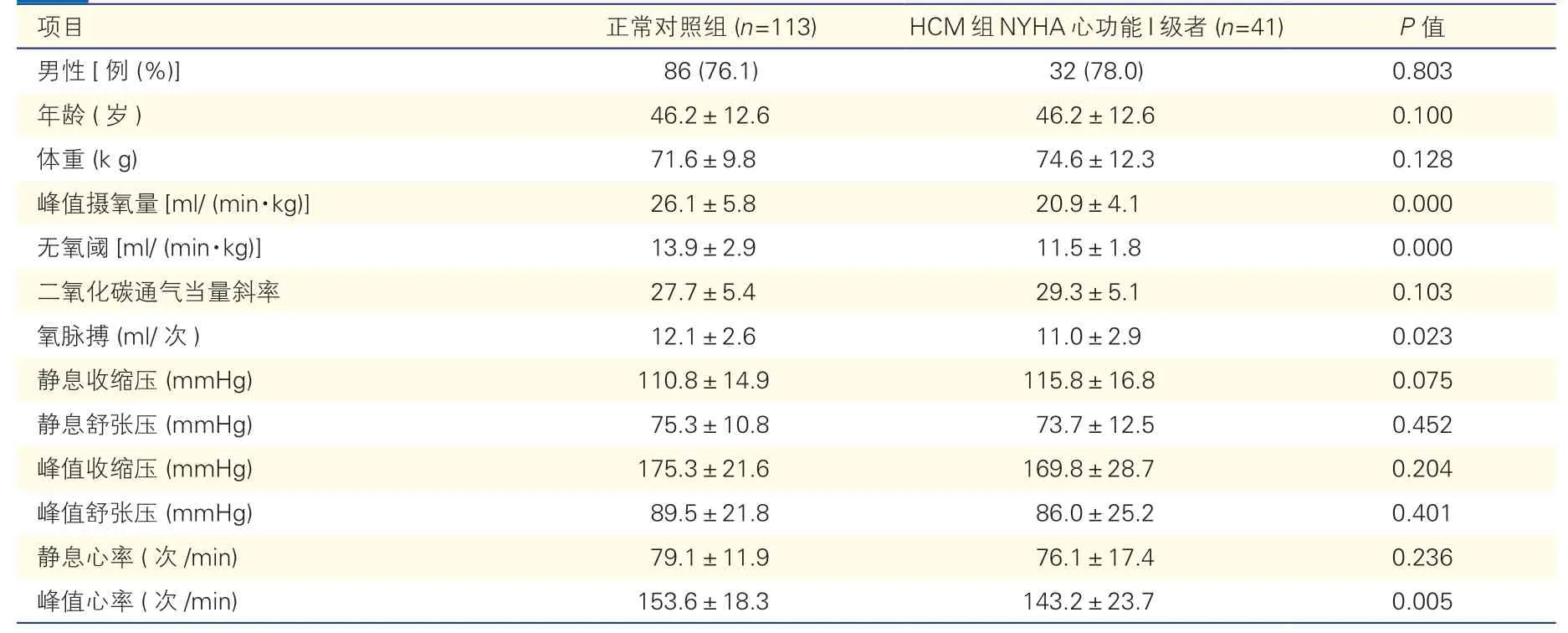
表3 HCM组NYHA心功能I级者与正常对照组的一般情况及CPET指标比较()
注:HCM:肥厚型心肌病;CPET:心肺运动试验。1 mmHg=0.133 kPa
2.4 HCM患者peak VO2与NYHA心功能分级的相关性分析(图1)
HCM组中NYHA心功能分级Ⅰ级、Ⅱ级及Ⅲ级的peak VO2分别为(20.9±4.1)ml/(min·kg)、(20.9±4.1)ml/(min·kg)及(17.2±3.2)ml/(min·kg),peak VO2与NYHA心功能分级的相关性有统计学意义(R=-0.310,P=0.004)。
2.5 HCM患者peak VO2与NT-proBNP水平的相关性(图2)
将NT-proBNP水平按四分位数分成4个亚组,NT-proBNP<287.8 pg/ml、287.8~647.3 pg/ml、647.4~1 401.0 pg/ml、≥1 401.1 pg/ml者peak VO2分别为(20.5±3.8)ml/(min·kg)、(19.9±3.9)ml/(min·kg)、(19.3±3.7)ml/(min·kg)及(17.3±5.1)ml/(min·kg),peak VO2与不同NT-proBNP水平间的相关性有统计学意义(R=-0.297,P=0.015)。
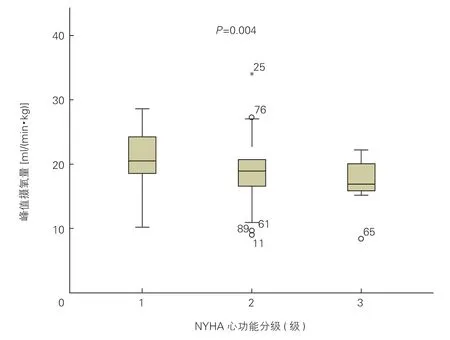
图1 肥厚型心肌病患者峰值摄氧量与NYHA心功能分级的相关性
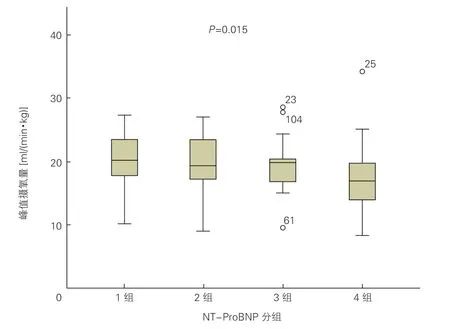
图2 肥厚型心肌病患者峰值摄氧量与NT-proBNP水平的相关性
2.6 HCM患者peak VO2的相关因素分析
单因素分析显示,HCM患者的peak VO2实际值与年龄、女性、合并冠心病、合并心房颤动/心房扑动、左心室高电压、左心房前后径、最大左心室室壁厚度、左心室后壁厚度、合并肺动脉高压的相关性有统计学意义(P均<0.05)。而peak VO2实际值与HCM梗阻类型无显著相关性(P=0.213)。
线性多元回归分析显示(表4),年龄、女性、左心室高电压、最大左心室室壁厚度及合并肺动脉高压是peak VO2的独立相关因素。
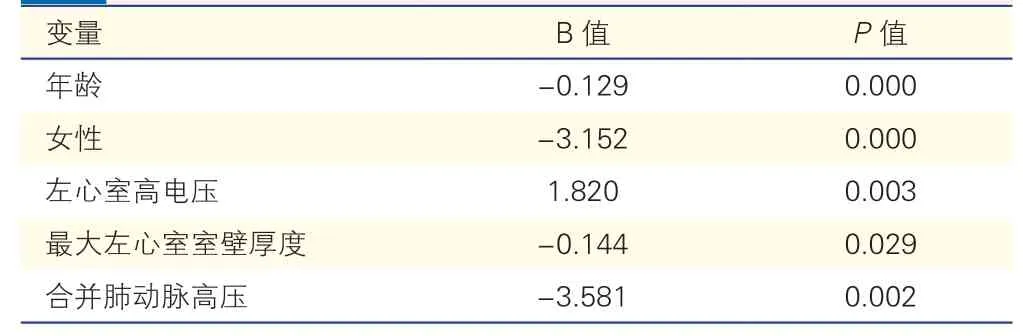
表4 峰值摄氧量实际值的独立相关因素
3 讨论
HCM是最常见的遗传性心脏病,多数患者会出现不同程度的心功能减低。本研究通过CPET、NYHA心功能分级及NT-proBNP评估HCM患者的心肺功能,并分析了CPET核心指标峰值摄氧量的相关因素。与正常对照组相比,HCM组的有氧代谢指标如peak VO2、无氧阈及氧脉搏均较正常对照组显著减低,而HCM组的通气指标VE/VCO2斜率较正常对照组显著升高。HCM组的峰值收缩压、峰值舒张压以及静息心率、峰值心率均较正常对照组显著降低。值得注意的是,即使是平时日常运动不受限的NYHA心功能I级HCM患者,其peak VO2、无氧阈及氧脉搏以及峰值心率也均较正常对照组显著减低,但VE/VCO2斜率及峰值血压与正常对照组比较差异无统计学意义。Peak VO2为心输出量与动静脉氧含量差的乘积,既往研究显示HCM的peak VO2下降与左心室舒张功能不全所致的每搏输出量下降有关[14]。本研究结果提示,在HCM早期无明显临床症状阶段就已经开始出现每搏输出量下降及心脏变时性异常,而随着病情发展,后期逐渐出现峰值血压下降及VE/VCO2斜率升高。VE/VCO2斜率升高在心力衰竭患者中常见,其发生机制可能与心输出量下降及肺血管床微血管功能不全导致的通气死腔增加及肺通气灌注不匹配有关[15-16]。
本研究入组的HCM患者NT-proBNP呈典型偏态分布,由于NT-proBNP的平均值标准差很大,因此实际NT-proBNP测量值并不能精准地反映HCM患者的心功能情况。Peak VO2是CPET的核心指标,指人体在极量运动时最大摄氧能力,反映了人体最大的有氧代谢能力和运动耐力,是评估心肺功能最重要的指标。本研究中,HCM患者的peak VO2为(19.2±4.3)ml/(min·kg),呈正态分布,平均值标准差小,并且peak VO2与NYHA心功能分级(P=0.004)及NT-proBNP(P=0.015)的相关性均有统计学意义,显示出HCM患者的peak VO2与传统心功能指标有良好的一致性,且可以更客观、准确地反映HCM患者的心肺功能情况。
HCM患者运动功能减低的原因尚不完全明确。既往研究显示HCM患者运动功能减低的病理生理机制可能包括左心室舒张功能减低、左心室流出道梗阻、心脏变时性机能异常以及周围肌肉功能变化[17]等。本研究也对HCM组患者peak VO2减低原因进行了探索。经单因素分析及线性多元回归分析,peak VO2的独立相关因素有年龄、女性、最大左心室室壁厚度、肺动脉高压、左心室高电压。Peak VO2本身就与年龄及性别相关,随着年龄增长而逐渐降低,而女性的peak VO2也较男性低,约为男性的77%。本研究发现,HCM患者的心肺运动功能减低主要与最大左心室室壁厚度呈独立负相关,提示HCM患者最大左心室室壁厚度越厚,心肺运动能力越低。左心室肥厚是HCM的核心形态学表现,左心室肥厚导致心肺功能减低可能与心肌微循环缺血及左心室舒张功能受限有关。心肌肥厚使毛细血管密度相对减少,加之微小动脉中膜增厚、血管内皮功能紊乱,造成心肌微循环缺血,进而导致心肌能量供应不足,左心室主动舒张功能减低[18]。另外,合并肺动脉高压的HCM患者的peak VO2显著低于不合并肺动脉高压者。HCM患者合并肺动脉高压与长期左心室舒张功能不全、二尖瓣反流等导致左心房、肺静脉压力升高有关,合并肺动脉高压者的HCM患者病情重、预后不良[19]。本研究还发现,心电图表现为左心室高电压者心肺运动功能显著优于无左心室高电压者,这在既往研究中均未提及。既往研究显示,左心室电压与左心室心肌纤维化及左心室质量相关[20]。Konno等[20]的研究还发现,HCM患者的左心室电压与左心室射血分数呈正相关。但左心室高电压与心肺运动功能间的相互关系及具体机制还需进一步研究。
综上所述,CPET可客观、准确地评估HCM患者的心肺运动功能。性别、年龄、最大左心室室壁厚度、左心室高电压及肺动脉高压是HCM患者peak VO2的独立相关因素。
利益冲突:所有作者均声明不存在利益冲突
