RSI-MO工艺对沼气脱硫的影响及微生物种群分析
2021-04-29阮仁俊李家乐欧坤轩赵昌爽孙俊伟操家顺
阮仁俊,李家乐,欧坤轩,赵昌爽,,孙俊伟,操家顺
RSI-MO工艺对沼气脱硫的影响及微生物种群分析
阮仁俊1,2*,李家乐1,欧坤轩1,赵昌爽1,2,孙俊伟1,操家顺2
(1.安徽工程大学建筑工程学院,安徽 芜湖 241000;2.河海大学环境学院,江苏 南京 210098)
为实现剩余污泥厌氧消化沼气原位深度脱硫,采用向反应器中嵌入最佳剂量(20g/L)废铁屑并引入微氧条件,构建废铁屑-微氧(RSI-MO)消化工艺,探索其对原位脱硫的影响.研究分7阶段,P1阶段对照组,P2阶段加入RSI,P3~P7阶段逐步提高O2剂量.结果表明,MO效应激发硫氧化菌(SOB)生物脱硫,促发RSI化学腐蚀而生成铁硫沉淀物.P1~P7阶段,RSI与MO交互作用可促进水解酸化,但O2剂量过高会抑制产甲烷微生物活性,造成VFAs积累.为研究RSI与MO交互作用对微生物群落多样性和丰度的影响,取P1、P2和P6阶段污泥样品进行高通量测序发现,RSI投加有益于产氢型微生物()、产乙酸型微生物()、产甲烷微生物()的生长.MO效应可激活SOB的活性,强化生物脱硫作用.
废铁屑;微氧效应;生物脱硫;化学除硫;微生物种群
如何有效处理并稳定市政污泥是我国当前面临的重要问题.厌氧消化工艺再生利用生物质废弃物,产生再生能源CH4,是解决能源和环境危机的有效途径[1].原始沼气除CH4和CO2外,还含有一定浓度的H2S,体积分数0.5%~1.0%.H2S易通过细胞膜扩散至细胞质中,抑制产甲烷菌活性,特别是营乙酸型产甲烷菌[2],造成厌氧消化产气效率偏低.研究发现当沼气H2S浓度从50mg/L升至1000mg/L时,CH4产率降低50%[3].此外,硫酸盐还原菌(SRB)将硫酸盐还原为H2S,厌氧发酵期间SRB与产甲烷菌之间竞争氢、乙酸等底物[4].因此,去除H2S是提高CH4产量的必要条件.
为了控制H2S的抑制作用,可采取稀释、联合消化和驯化等措施[5].近几年,很多含铁试剂(纳米零价铁粉、普通零价铁粉、FeCl3、磁铁矿等)受到广大研究人员的青睐,通过投加含铁试剂提升剩余污泥厌氧消化效率,同时控制H2S浓度[6-9].虽然以上含铁试剂能够有效控制沼气H2S浓度,但价格十分昂贵,增加运行成本.废铁屑(RSI)作为价格低廉的含铁材质,能否控制厌氧消化H2S含量且脱硫效率如何,鲜有文献报道.此外,也有学者通过微氧(MO)效应,即提供适量O2降低沼气H2S含量[10].MO原位脱硫的前提是不破坏厌氧反应器还原性氛围,向厌氧反应器中通入一定量的O2或空气(0.3~1mg/L)[11],在SOB作用下,利用O2作为电子受体,将反应器内的硫化物氧化为单质硫或硫酸盐(O2过量)等[12]. SOB在环境中普遍存在,且对O2的利用效率比较高,不需刻意接种.可联合兼性厌氧菌及时将溶解氧消耗掉,保证反应器的还原性氛围,减弱或消除O2对产甲烷菌的抑制.
厌氧消化在多种微生物菌群的协同作用下形成复杂的生态系统,主要以产CH4和非产CH4两大类微生物菌群为主.非产甲烷菌群为产甲烷菌群提供生长繁殖所需的物质基础并创造适宜生存的还原性环境,产甲烷菌可为非产甲烷菌消除氢、酸积累引发的抑制性作用.二者既相互联系又相互制约,借助分子生物学技术了解厌氧消化全过程产甲烷菌群和非产甲烷菌群动态变化很有必要.
本研究整合RSI-MO消化工艺,探索RSI与MO交互作用对系统水解酸化的影响,并浅析RSI与MO交互作用脱硫机制.通过Miseq高通量测序技术检测微生物种群落结构组成和丰度,分析微生物群落结构对RSI与MO交互作用的响应,为厌氧发酵系统稳定而高效运行提供生物学调控依据.
1 材料与方法
1.1 试验材料
剩余污泥取自南京江宁经济开发区污水处理厂二沉池,-20℃储藏待用.剩余污泥使用之前进行碱预处理[15],污泥碱预处理后VS=20.3g/L、TS= 32.9g/L.厌氧接种污泥取自洋河酒厂污水站污泥膨胀床(EGSB),种泥VS=24.1g/L、TS=34.7g/L,接种之前种泥处于饥饿状态一周.RSI购于南京某机械加工车间,表面覆盖一层铁锈(铁氧化物聚集物,主要成分为Fe(OH)3、FeCO3、Fe2O3、FeOOH和Fe3O4),外形为10mm×10mm×0.3mm,使用之前用0.1mol/L氢氧化钠溶液浸泡24h去除表面油渍.
1.2 半连续厌氧/微氧试验设计

图1 实验装置示意

表1 试验7个周期相关参数设置与结果
注: O2/biogas为标准状态下所提供的氧气与消化所产沼气的体积比,即标准状态下氧气(L)/标准状态下沼气(m3).
前期研究已获知不同剂量RSI(0,1,5,10,20和30g/L)对剩余污泥厌氧消化的影响,以及对沼气H2S含量的初步影响,并确定RSI的最佳投加剂量为20g/L[16].本文在此基础上开展半连续厌氧/微氧消化研究,将RSI最佳剂量嵌入反应器中.半连续消化试验于有效体积4L、顶空体积0.5L的有机玻璃反应器中进行,温度控制在35℃.试验共分7个阶段进行,每个阶段持续30d,共210d.每天进料排料各一次,每次200mL.为了提高厌氧消化沼气H2S浓度,进料污泥中添加Na2SO4且浓度为2g/L.为了使微量O2能够充分地被SOB利用,借助小型压缩机(1L/min)进行沼气循环.氧气罐连接一个气体流量计(SIERRA 820Top-Trak)控制O2量,直接加入反应器顶空,跟随沼气循环,被反应器内SOB利用,装置如图1所示.第一阶段(P1)作为对照组,RSI和O2均不提供;第二阶段(P2)只提供RSI(20g/L);第三至第七阶段(P3~P7)提供RSI(20g/L),并逐步提升O2剂量(分别为1,5,10,15和20mL).相关试验设置如表1所示.反应器每天取样一次,并保存于4℃环境下,产生的沼气收集于5L集气袋中(CEL Scientific, Santa Fe Springs, CA, USA).鉴于沼气产量的原因,经计算,沼气停留时间超过7h,足以完成沼气生物脱硫[17].
1.3 测试方法
1.3.1 挥发性脂肪酸VFAs的检测 VFAs采用安捷伦气相色谱仪(GC7890)进行测定.样品在测定前需要进行一定的预处理:先离心(5000r/min, 10min)再过滤(0.45mm),收集滤液,最后滤液中加入事先配制好的磷酸溶液将滤液的pH值降至3以下,再进行检测.气相色谱法的检测参数:检测器为火焰离子化检测器,温度控制在250℃,氢气、空气和尾吹流量分别为30、400和30mL/min.以高纯N2作为载气,同时温度控制在200℃;再以10℃/min的升温方式将柱温箱的温度由80℃升至180℃,于此温度下保持1min,再以上述升温方式将柱温箱温度升至220℃,于此温度下保持5min.
1.3.2 微生物高通量测序 利用Miseq高通量测序技术对7阶段中的3种不同运行状态(P1、P2和P6)的厌氧污泥样品进行测序分析.P1阶段,厌氧消化系统既没有提供O2也没有提供RSI;第2阶段提供RSI而没有提供O2;P3~P7阶段在投加RSI的基础上逐步提高O2剂量,鉴于P6阶段反应器综合性能最佳(图2),故选取P6阶段污泥样品作为此运行状态的代表.将取好的污泥样品冷冻并送至凌恩生物科技有限公司进行检测,Illumina PE250测序实验流程:基因组DNA提取→设计并合成引物→PCR扩增和产物纯化→PCR产物定量和均一化→Miseq高通量测序.
基因组DNA提取:完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因DNA.
PCR扩增:按指定测序区域,合成带有barcode的特异引物.为保证后续数据分析的准确性及可靠性,需满足两个条件:①尽可能使用低循环数扩增;②保证每个样本扩增的循环数一致.随机选取具有代表性的样本进行预实验,确保在最低循环数中使绝大多数样本能够扩增出浓度合适的产物.PCR采用TransGen AP221- 02:TransStart Fastpfu DNA Polymerase;PCR仪: AB1GeneAmp ®9700型.全部样本按照正式实验条件进行,每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用 AxyPrepDNA 凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris_HCl洗脱;2%琼脂糖电泳检测.
荧光定量:参照电泳初步定量结果,将PCR产物用QuantiFluor™-ST蓝色荧光定量系统(Promega公司)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合.
所得微生物测试结果经过去除接头序列、低复杂度序列和低质量序列后得到有效序列,通过对有效序列作图对比分析.按照 97%相似性,对非重复的有效序列进行OTU聚类分析及物种多样性分析.在纲和属水平上统计各污泥样品微生物群落组成,获取微生物菌群组成和丰度.
2 结果与讨论
2.1 RSI与MO交互作用对VFAs的影响
P1~P7阶段,剩余污泥厌氧/微氧消化液中VFAs (甲酸、乙酸、丙酸、丁酸和戊酸)各组分浓度变化如图2所示.7阶段的平均VFAs值可分成3个波动等级,最低P1阶段为927.0mgCOD/L;中等P2~P6阶段分别为1527.8,1523.8,1550.8,1540.5, 1526.9mgCOD/ L;最高P7阶段为1816.5mgCOD/L. RSI于P2阶段加入反应器,VFAs浓度显著提高,可知RSI投加促进剩余污泥水解酸化,与前期批式试验成果一致[16].P7阶段反应器平均VFAs浓度最高,除RSI存在外,可能原因:①P7阶段O2剂量最高,激发好氧和兼性厌氧酸化菌群的活性[18],提升产酸速率;②根据前期研究成果可知高剂量O2破坏反应器还原性氛围,再结合P7阶段甲酸、乙酸(产甲烷微生物可直接利用的基质)残余浓度最高,推测产甲烷微生物活性受到抑制,造成VFAs积累.此外,P7阶段丙酸浓度为118.3mgCOD/L,较P1~P6阶段高,归因于丙酸型发酵更易在氧化还原电位(ORP)值高于-278mV的环境下发生[19],由前期研究成果可知,P7阶段ORP处于−200~−230mV之间,促进丙酸型发酵的发生. P1~P7阶段,丁酸和戊酸浓度分别为152.8, 365.9, 373.4, 368.3, 378.9, 370.3, 272.4mgCOD/L和170.5, 486.6, 471.4, 487.8, 466.5, 459.2, 379.4mgCOD/L.P2~P7阶段丁酸和戊酸浓度都明显高于P1阶段,归功于投加RSI可促进水解酸化效率.而P7阶段的丁酸和戊酸浓度较P2~P6阶段稍有回落,归因于P7阶段氧气剂量最高,促进相关酸化细菌活性,将丁酸和戊酸进一步降解成小分子的VFAs.

图2 不同运行阶段VFAs浓度变化曲线
2.2 RSI与MO交互作用控制沼气H2S的潜在机理
RSI与MO交互作用有助于系统实现沼气原位脱硫,通过前面研究结果可对其脱硫机理进行阐述.如图3所示,通过强化反应体系生物和化学作用实现沼气原位深度脱硫.首先,反应器进料污泥经破胞作用,释放胞内有机质.一方面,在酸化细菌作用下有机质被降解并产生电子,另一方面含硫有机物被转变成硫酸盐,硫酸盐在SRB的作用下转化成硫化物(S2-、HS-和H2S)溶于液相.厌氧环境下RSI释放Fe2+和Fe3+,结合硫化物生成铁硫化合物沉淀.其中,Fe3+在铁还原菌(IRB)异养代谢作用下还原成Fe2+,Fe2+与硫化物结合生成FeS(亚稳态),并逐步转化成FeS2(稳态),有益于液相硫化物浓度的控制[20].其次,MO效应可同时强化化学除硫作用和生物原位脱硫作用.归因于提供的O2:①可促进RSI释放Fe2+和Fe3+,促进铁硫化合物沉淀的生成,有效降低液相硫化物浓度;②可作为电子受体强化SOB脱硫活性,促使硫化物氧化为单质或硫酸盐(O2过量).通过系统排泥将固化的含硫化合物(单质S和FeS2)排除,降低液相硫化物浓度.通过耦合化学和生物脱硫作用,液相硫化物浓度得到有效地控制.根据亨利定律,液相硫化物浓度的降低,可有效减少气相硫化物的释放,故可控制沼气H2S浓度[21].最后,由于SOB生存在氧气浓度比较高的区域,大部分聚集在反应器气液交界面附近,即使有部分H2S已释放到气相中,在交界面附近的气态H2S会被在交界面附近的SOB氧化,可直接起到降低沼气H2S浓度的作用.
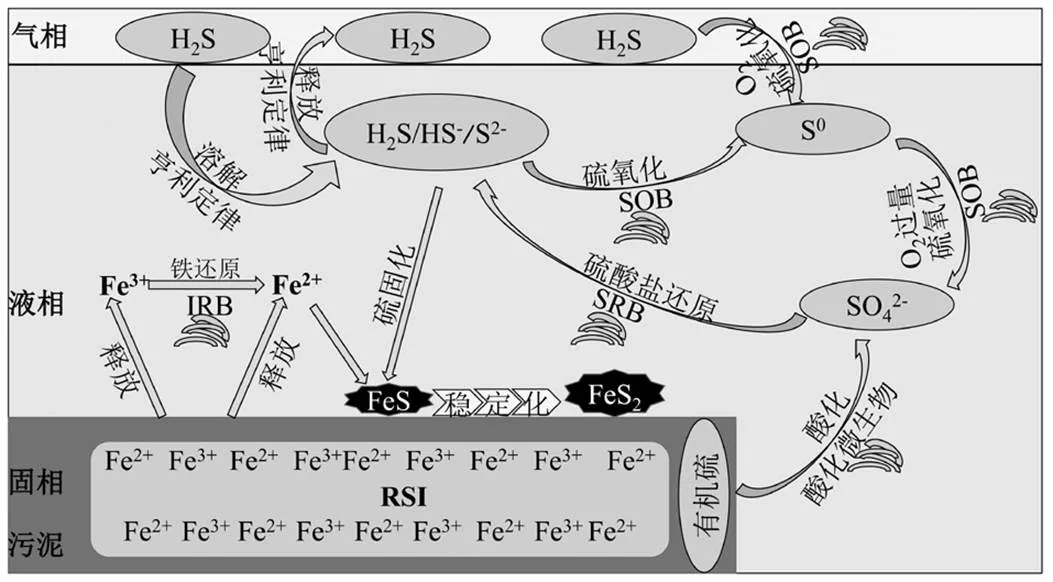
图3 RSI与MO交互作用的潜在脱硫机理
2.3 RSI与MO交互作用对系统微生物群落的影响

图4 P1、P2、P6阶段稳定运行期厌氧污泥样品稀释性曲线
相似水平0.97
2.3.1 系统微生物多样性分析 图4是3种不同运行阶段稳定期污泥样品的稀释性曲线,由图可知,随着序列数量的增加,稀释性曲线逐渐趋于平缓,说明所取污泥样品微生物丰度较高[22].根据3种不同运行阶段稳定期污泥样品的测序量在不同测序深度时的微生物多样性指数构建Shannon曲线(图5),且所取样品的Shannon曲线随着测序数量的增加亦逐渐趋向平缓,说明所选污泥样品的微生物多样性较高[23].通过Rarefaction曲线和Shannon曲线说明试验所选微生物测序的污泥样品较为合理,污泥样品中的绝大部分微生物种类和丰度可被反映出来.
图5 P1、P2、P6阶段稳定运行期厌氧污泥样品Shannon指数变化曲线
相似水平0.97
通过对反应器稳定运行期厌氧污泥样品多样性分析,可反映样品微生物群落的多样性和丰度,表2是污泥样本微生物群落多样性指数汇总表.由3组污泥样品覆盖度数值均大于99.9%可知,本次检测结果较为理想,能真实反应污泥微生物群落结构特征.首先,由OTU聚类分析可知,污泥样品P1、P2、P6阶段OUT值分别为886、957和1147.根据污泥样品序列丰度,对样品OTU丰富度指数(ACE、Chao)以及多样性指数(Shannon、Simpson)进行评价.3个阶段污泥样品序列的丰富度指数与多样性指数存在一定差异.P6阶段稳定运行期微生物丰富度指数ACE和Chao分别为1312和1377,多样性指数Shannon和Simpson分别为6.46和0.021,与P1、P2阶段相比,P6阶段微生物菌群丰度及多样性均相对较高.图6体现了不同阶段污泥样品间的OUT重合情况,3个污泥样品共有的OUT数量达767,P2阶段OTU数较P1阶段(对照组)多91个,P6阶段OUT数最多,达1147个.由检测结果可知,厌氧体系微生物群落丰度与多样性因RSI与MO的交互作用得以提高.

表2 P1、P2、P6阶段稳定运行期污泥样品微生物α多样性指数

图6 P1、P2、P6阶段稳定运行期厌氧污泥样品的OUT比较Venn图
2.3.2 微生物群落结构与丰度变化分析 反应器在P1、P2、P6稳定运行期的微生物群落结构和丰度,因RSI与MO交互作用而存在较大差异(图7).古细菌在纲的分类水平上相对丰度较高的菌群主要包括甲烷微菌纲(Methanomicrobia,37.71%、44.45%、40.30%)和甲烷球菌纲(Methanococci, 3.96%、6.31%、5.89%),且甲烷微菌纲为古菌优势菌群.古细菌在属水平上主要包含10种菌群,其中、、、、和是营氢型产甲烷菌,、、和为营乙酸型产甲烷菌.从P2阶段开始,随着RSI投加,产甲烷菌群(尤其营氢型产甲烷菌)群落结构得到丰富,比如、和都属于营氢型产甲烷菌[24],在P1阶段丰度小于0.5%,而在P2和P6阶段丰度皆超过0.5%,可见RSI投加可丰富产甲烷微生物菌群结构.此外,从高通测序结果来看,营乙酸型产甲烷菌群和两种微生物丰度因RSI投加而显著增加.P1阶段,二者丰度值分别为2.45%和3.96%,进入到P2和P6阶段,丰度分别提升至4.13%、5.09%和6.31%、5.89%.因此,产甲烷菌群结构和丰度都因RSI投加而增加,有助于提升反应器消化效率.将P6阶段古细菌群落结构与P1、P2阶段相比较发现,MO并未减少体系中产甲烷菌群的结构和丰度,即对厌氧消化体系未产生负面影响.
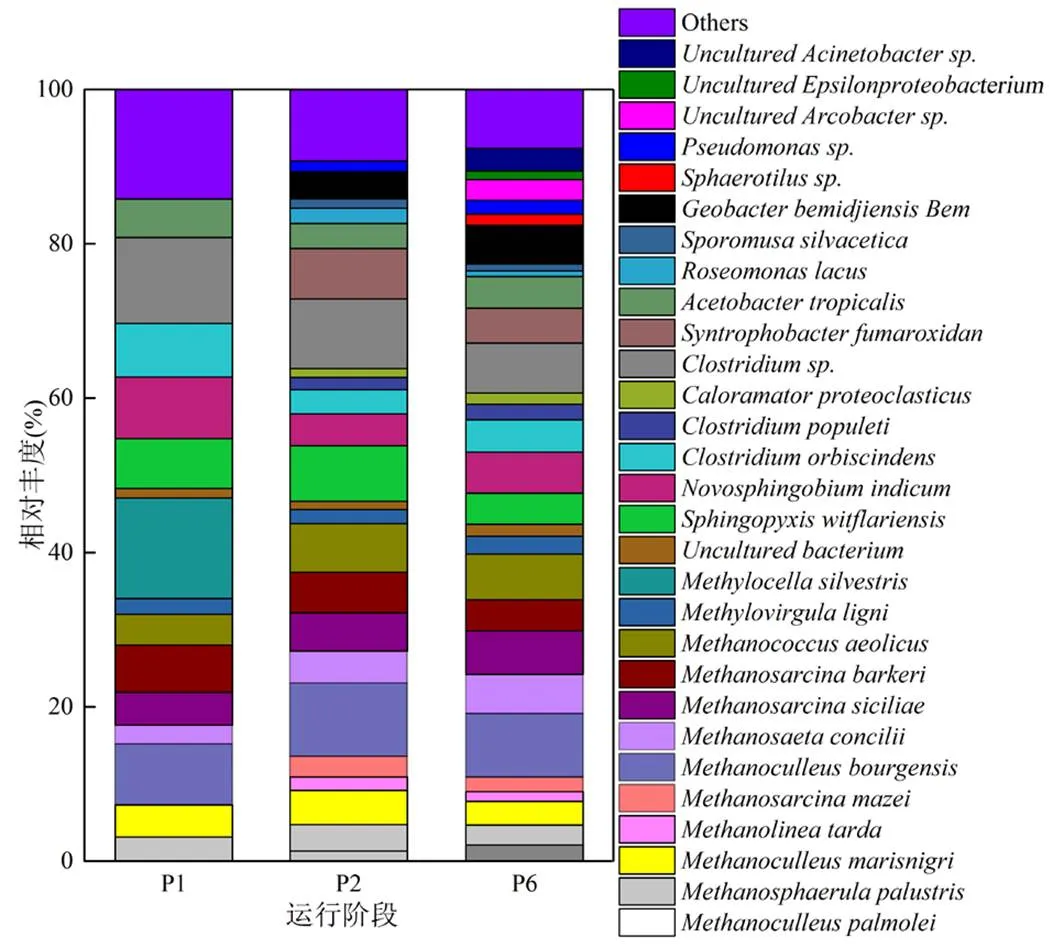
图7 第1、2、6阶段稳定运行期微生物群落在属分类水平上的分布
为使视图效果最佳,作图时将丰度低于0.5%的部分合并为others在图中显示
细菌在纲分类水平上相对丰度较高的菌群主要包括变形菌纲(Alphaproteobacteria,29.29%、13.46%、14.97%)、梭菌纲(Clostridia,18.09%、15.89%、13.61%)、Δ-变形菌纲(Deltaproteobacteria, 0、10.03%、9.56)、酸微菌亚纲(Acidimicrobidae,0、1.37%、3.24%)、ε-变形菌纲(Epsilonproteobacteria, 0、0、3.80%)和丙型变形菌纲(Gammaproteobacteria, 0、0、2.92%),且变形菌纲和梭菌纲为优势菌群.细菌在属的水平上主要包含19种菌群,其中和以CH4为基质,其存在必会降低系统CH4产量.通过高通量测序发现二者皆存在于P1阶段,而P2阶段RSI投加,使得丰度减小(<0.5%),可见RSI投加可遏制其生长,间接提高系统CH4产量,与Dunfieid等[25]研究结果一致.Uncultured、、、、和属于产酸发酵微生物类群,可将大分子难降解复杂有机物代谢为有机酸.其中,是一类具有降解纤维素能力的厌氧菌群,具有蛋白质或氨基酸降解属性[26],此两类菌群仅出现于P2和P6阶段,并且二者在P6阶段的丰度较P2阶段都有所提高,说明RSI和微氧效应皆有益于纤维素、蛋白质等消化基质的降解.在厌氧体系中,氢气和乙酸是产甲烷菌群直接利用的基质[27],对提升系统厌氧消化效率至关重要.sp.属于产氢型微生物,存在于反应器的所有阶段.亦属于产氢型微生物,可将丙酸氧化成甲酸,但它只出现于RSI投加之后(P2和P6),可见RSI投加有益于系统产氢型微生物类群的生长,为后续产甲烷提供有效基质.图2显示,P2~P6阶段丙酸浓度较P1低,而甲酸浓度较P1高,可证实这一点.、和属于产乙酸微生物类群,亦可为产甲烷提供有效基质.其中,出现于厌氧/微氧消化的整个历程之中,而、仅出现于P2和P6阶段,说明RSI投加可丰富产乙酸微生物类群,提高厌氧消化的乙酸产量,间接有益于甲烷产量的提高.属于IRB,可将乙酸和多碳有机质氧化为CO2.此种微生物只存在RSI投加之后(P2和P6),能够将消化基质中难生物降解的大分子有机质转化成小分子有机酸[28].说明RSI投加能够刺激IRB的生长,对厌氧消化污泥减量化和甲烷产量具有潜在的促进作用.而sp.和sp.微生物类群属于铁氧化菌(IOB),将Fe(II)氧化为Fe(III)[29].sp.出现于P2和P6阶段,而sp.只出现于P6阶段,归因于P6阶段的MO效应,加速了Fe(II)的释放速率,进而提高IOB的种类.本研究所取的3个厌氧污泥样品,SOB只存在于P6阶段,分别为Unculturedsp.、Uncultured和Unculturedsp.,此类微生物能够将硫化物氧化成单质硫、硫代硫酸盐或硫酸盐等,是系统实现生物脱硫的主功能微生物类群.其中, Unculturedsp.出现于前人研究的污泥微氧消化反应器的顶空之中[30];Uncultured正如Kryachko等[31]的发现,为化能自养型SOB,微氧效应能激发其生物脱硫潜力;Unculturedsp.出现于Potivichayanon等[32]设计的生物过滤器之中,通过生物脱硫去除H2S气体.
3 结论
3.1 RSI与MO交互作用可促进水解酸化效率,显著提升酸化产物VFAs浓度,P1~P7阶段VFAs浓度分别为927.0,1527.8,1523.8,1550.8,1540.5,1526.9和1816.5mgCOD/L,为后续产甲烷过程提供基质.
3.2 通过RSI和MO的交互作用可实现沼气原位深度脱硫,潜在机制为MO效应可强化RSI的化学除硫作用和SOB的生物脱硫作用,实现双重作用的耦合.
3.3 因RSI与MO的交互作用,厌氧体系微生物群落丰度与多样性得以提高,并且P1、P2、P6之间存在较大差异.对于古细菌,RSI投加不仅增加体系产甲烷菌群的种类(、和),而且提高了相关产甲烷菌群的丰度(于P1、P2、P6阶段丰度分别为2.45%、4.13%、6.31%和于P1、P2、P6阶段丰度分别为3.96%、5.09%、5.89%),而MO效应没有对产甲烷菌群产生负面影响;对于细菌,RSI投加有益于系统产氢型()和产乙酸型微生物(、)类群的生长,为产甲烷提供有效基质,而MO效应可激活SOB活性,实现微生物脱硫.
[1] Wei Y F, Yuan H R, Wachemo A C, et al. Anaerobic co-digestion of cattle manure and liquid fraction of digestate (LFD) pretreated corn stover: Pretreatment process optimization and evolution of microbial community structure [J]. Bioresource Technology, 2020,296:122282.
[2] Cao J J, Zhang L, Hong J Y, et al. Different ferric dosing strategies could result in different control mechanisms of sulfide and methane production in sediments of gravity sewers [J]. Water Research, 2019, 164:114914.
[3] Cecilia P, Felipe A M, Giulio M. The role of organic load and ammonia inhibition in anaerobic digestion of tannery fleshing [J]. Water Resources and Industry, 2018,19:25-34.
[4] Liu Y, Wachemo A C, Yuan H R, et al. Anaerobic digestion performance and microbial community structure of corn stover in three-stage continuously stirred tank reactors [J]. Bioresource Technology, 2019,287:121339.
[5] Ashley J B, Stephanie L, Walter M, et al. Methane and hydrogen sulfide production during co-digestion of forage radish and dairy manure [J]. Biomass and Bioenergy, 2015,80:44-51.
[6] 李小兰,周 芸,陈志燕,等.针铁矿强化剩余污泥与烟草废弃物厌氧发酵的研究 [J]. 中国环境科学, 2019,39(6):2475-2482. Li X L, Zhou Y, Chen Z Y, et al. Enhanced anaerobic fermentation of waste activated sludge and tobacco waste using Goethite [J]. China Environmental Science, 2019,39(6):2475-2482.
[7] 苏良湖,张明珠,张龙江,等.水合氧化铁对污泥厌氧消化过程的硫化氢控制 [J]. 中国环境科学, 2017,37(4):1349-1357. Su L H, Zhang M Z, Zhang L J, et al. The removal of hydrogen sulphide by ferrihydrite during anaerobic digestion of sewage sludge [J]. China Environmental Science, 2017,37(4):1349-1357.
[8] Zhu T T, Cheng H Y, Yang L H, et al. Coupled sulfur and iron(II) carbonate-driven autotrophic denitrification for significantly enhanced nitrate removal [J]. Environmental Science & Technology, 2019,53(3): 1545-1554.
[9] Ruan D N, Zhou Z, Pang H J, et al. Enhancing methane production of anaerobic sludge digestion by microaeration: Enzyme activity stimulation, semi-continuous reactor validation and microbial community analysis [J]. Bioresource Technology, 2019,289:121643.
[10] Zhou X J, Yin J G, Chen Y L, et al. Simultaneous removal of sulfur and iron by the seed precipitation of digestion solution for high-sulfur bauxite [J]. Hydrometallurgy, 2018,181:7-15.
[11] Meng J, Li J L, Li J Z, et al. Enhanced nitrogen removal from piggery wastewater with high NH4+and low COD/TN ratio in a novel upflow microaerobic biofilm reactor [J]. Bioresource Technology, 2018,249: 935-942.
[12] Tripathia N, Singhb R S, Hillsa C D. Microbial removal of sulphur from petroleum coke (petcoke) [J]. Fule, 2019,235:1501-1505.
[13] Chu L B, Yan S T, Xing X H, et al. Progress and perspectives of sludge ozonation as a powerful pretreatment method for minimization of excess sludge production [J]. Water Research, 2009,43(7):1811-1822.
[14] 阮仁俊,李运晴,项经纬,等.废铁屑对剩余污泥厌氧消化特性的影响[J]. 环境科学研究, 2020,33(9):179-185. Ruan R J, Li Y Q, Xiang J W, et al. Influence of rusty scrap iron on the anaerobic digestion performance of waste-activated sludge [J]. Research of Environmental Sciences, 2020,33(9):179-185.
[15] Ramos I, Díaz I, Fdz-Polanco M. The role of the headspace in hydrogen sulfide removal during microaerobic digestion of sludge [J]. Water Science & Technology, 2012,66:2258-2264.
[16] Li Y F, Guo J B, Li H B, et al. Effect of dissolved oxygen on simultaneous removal of ammonia, nitrate and phosphorus via biological aerated filter with sulfur and pyrite as composite fillers [J]. Bioresource Technology, 2020,296:122340.
[17] Alkaya E, Demirer G N. Anaerobic acidification of sugar-beet processing wastes: effect of operational parameters [J]. Biomass and Bioenergy, 2011,35(1):32-39.
[18] 黄绍福,叶 捷,周顺桂.赤铁矿抑制硫酸盐废水厌氧消化产甲烷过程中硫化氢形成与机制[J]. 环境科学, 2019,40(4):1857-1864. Huang S F, Ye J, Zhou S G. Effect of hematite on the inhibition of hydrogen sulfide formation and its mechanism during anaerobic digestion and methanogenesis of sulfate wastewater [J]. Environmental Science, 2019,40(4):1857-1864.
[19] Shokouhi M, Jalili A H, Zoghi A T. Experimental investigation of hydrogen sulfide solubility in aqueous sulfolane solution [J]. The Journal of Chemical Thermodynamics, 2017,106:232-242.
[20] Amato K R, Yeoman C J, Kent A, et al. Habitat degradation impacts black howler monkey (Alouatta pigra) gastrointestinal microbiomes [J]. The ISME Journal, 2013,7:1344-1353.
[21] Wang Y, Sheng H F, He Y, et al. Comparison of the levels of bacterial diversity in freshwater, intertidal wetland, and marine sediments by using millions of illumina tags [J]. Applied and Environmental Microbiology, 2012,78:8264-8271.
[22] Cadillo-Quiroz H, Yavitt J B, Zinder S H. Methanosphaerula palustris gen. nov., sp. nov., a hydrogenotrophic methanogen isolated from a minerotrophic fen peatland [J]. International Journal of Systematic and Evolutionary Microbiology, 2009,59:928-935.
[23] Dunfield P F, Khmelenina V N, Suzina N E, et al. Methylocella silvestris sp. nov., a novel methanotroph isolated from an acidic forest cambisol [J]. International Journal of Systematic and Evolutionary Microbiology, 2003,53:1231-1239.
[24] Tarlera S, Stams A J M. Degradation of proteins and amino acids by Caloramator proteoclasticus in pure culture and in coculture with Methanobacterium thermoformicicum Z245 [J]. Applied Microbiology and Biotechnology, 1999,53:133-138.
[25] Kumar A, Samadder S R. Performance evaluation of anaerobic digestion technology for energy recovery from organic fraction of municipal solid waste: A review [J]. Energy, 2020,197:117253.
[26] Ying X, Guo K, Chen W, et al. The impact of electron donors and anode potentials on the anode-respiring bacteria community [J]. Applied Microbiology & Biotechnology, 2017,101:7997-8005.
[27] Sachan R, Singh A K. Comparison of microbial influenced corrosion in presence of iron oxidizing bacteria (strains DASEWM1and DASEWM2) [J]. Construction and Building Materials, 2020,256: 119438.
[28] Díaz I, Pérez S I, Ferrero E M, et al. Effect of oxygen dosing point and mixing on the microaerobic removal of hydrogen sulphide in sludge digesters [J]. Bioresource Technology, 2010,102:3768-3775.
[29] Kryachko Y, Semler D, Vogrinetz J, et al. Hemmingsen. enrichment and identification of biosurfactant-producing oil field microbiota utilizing electron acceptors other than oxygen and nitrate [J]. Journal of Biotechnology, 2016,231:9-15.
[30] Potivichayanon S, Pokethitiyook M, Kruatrachue M. Hydrogen sulfide removal by a novel fixed-film bioscrubber system [J]. Process Biochemical, 2006,41:708-715.
致谢:本实验的现场剩余污泥采样工作由南京江宁经济开发区污水处理厂工作人员协助完成,本实验的污泥微生物高通量测序工作由凌恩生物科技有限公司相关工作人员完成取样和测序,在此表示感谢.
Influence of RSI-MO process on biogas desulfurization and analysis of microbial communities.
RUAN Ren-jun1,2*, LI Jia-le1, OU Kun-xuan1, ZHAO Chang-shuang1,2, SUN Jun-wei1, CAO Jia-shun2
(1.School of Architecture and Civil Engineering, Anhui Polytechnic University, Wuhu 241000, China;2.College of Environment, Hohai University, Nanjing 210098, China)., 2021,41(4):1909~1916
To achieve in-situ deep desulfurization of biogas derived from waste-activated sludge (WAS) anaerobic digestion, an integrated approach of optimal rusty scrap iron addition (20g/L) with micro-oxygen injection (RSI-MO) was constructed to disclose their combined influences on the performance of in-situ desulfurization. The operation of semi-continuous anaerobic/microaerobic reactor included seven stages (P1~P7). The operation of first stage (P1) was set as the control. The addition of RSI was started at the second stage (P2). The oxygen was introduced in P3 stage, and the concentrations were gradually increased from P3 to P7 stages. The results showed that MO induced the microbial sulfide oxidation by stimulating sulfur-oxidizing bacteria (SOB), and simultaneously promoted the chemical corrosion on iron to generate iron-sulfide precipitation. From P1 to P7, the synergistic effects of RSI and MO contributed to the hydrolytic-acidogenic efficiency. However, the overdose of oxygen inhibited the activities of methanogenic microorganisms, which caused the accumulation of VFAs. To demonstrated the combined effects of RSI and MO on the microbial diversity and abundance, the microbial communities in sludge samples of P1, P2 and P6 were analyzed via the high-throughput sequencing technology. The microbial analysis suggested that the RSI addition stimulated the activity of hydrogen-producing microorganisms (), acetate-producing microorganisms () and methanogenic microorganisms () while the MO stimulated the activity of SOB for biological desulphurization enhancement.
rusty scrap iron;micro-oxygen effect;biological desulfurization;chemical desulfurization;microbial communities
X172
A
1000-6923(2021)04-1909-08
阮仁俊(1988-),男,安徽马鞍山人,讲师,博士,主要从事固体废弃物处理与资源化利用.发表论文7篇.
2020-08-26
国家自然科学基金资助项目(51808001);科学与研究预研项目(Xjky110201911);大学生科研项目(2020DZ15);安徽工程大学大学生创新创业训练计划项目(202010363118, S201910363292);安徽省高等学校自然科学研究项目(KJ2020A0365)
* 责任作者, 讲师, rrjgrad@163.com
