磺胺嘧啶对鱼菜共生系统氮元素转化的影响
2021-04-29胡浩东
胡浩东,高 航,胡 振
磺胺嘧啶对鱼菜共生系统氮元素转化的影响
胡浩东,高 航,胡 振*
(山东大学环境科学与工程学院,山东省水环境污染控制与资源化重点实验室,山东 青岛 266237)
本文研究了典型抗生素磺胺嘧啶对实验室规模鲤鱼-小白菜共生系统生产性能和氮元素转化的影响.结果表明,磺胺嘧啶使系统鲤鱼体重增量提高17%,但小白菜生产性能大幅下降,使得系统氮素利用率由43.66%降至21.20%, N2O转化率由1.02%上升至1.98%.磺胺嘧啶在投加初期对系统的硝化过程表现出短期抑制效应,经过32d的适应期后,实验组氨氮浓度下降至和对照组相近水平,系统运行后期实验组氨氧化细菌丰度相较对照组提高51.43%.鱼体内残余的磺胺嘧啶为35.23μg/kg,符合国家标准,但水体中磺胺类药物抗性基因1、2及1的拷贝数分别提升至7.23倍、2.74倍和4.12倍.从生产性能及环境友好性考虑,鱼菜共生系统在设计及运行中应减少或避免抗生素的使用,并采取合理的替代措施规避其风险.
鱼菜共生;磺胺嘧啶;氮;氨氧化细菌;抗性基因
据世界粮农组织(FAO)最新统计,2016年世界水产养殖总产量(包括水生植物)达1.102亿t,近15a年均增长率约为5.8%[1].然而,由于鱼类对鱼食中氮磷等元素利用效率较低,水产养殖业的快速发展,不仅造成了巨大的资源浪费,还引发水体富营养化等污染问题,给自然环境带来了沉重的压力[2].近年来,一种新型的水产养殖模式—鱼菜共生系统,引起广泛关注.鱼菜共生系统的核心思想是将水培法应用于水产养殖中,利用鱼类排泄物中的养分培育水生蔬菜,在改善水质的同时收获作物[3].已有研究表明,鱼菜共生系统可以回收鱼食中约70%的磷和60%的氮[4-5],并通过出售作物及服务提升收入[6],实现了对资源的更高效利用,具有广阔的应用前景.氮元素的转化是鱼菜共生系统中物质循环的关键过程,目前,国内外围绕鱼菜共生系统中氮元素利用效率提升开展了广泛研究,Hu等[7]证明种植根表面积较高的植物可以取得更高的氮元素利用效率(NUE);Zou等[8]的研究表明当系统的pH值为6.0时,NUE将达到最大值.
为了降低鱼类感染病害的概率,增加产量,水产养殖业中预防性地添加抗生素已成为常规策略[9].但抗生素的使用会带来多方面的风险,譬如抗生素通过食物链积累,引发人体过敏或中毒反应;破坏微生物群落多样性,加剧水体富营养化[10].同时,有报道指出水生环境与陆地环境中细菌之间可以进行抗性基因的交换,导致部分人类病原体出现耐药性,降低医用抗生素的治愈率[11].国内外目前的研究主要着眼于抗生素与水培系统中植物间的相互作用,例如Chuang等[12]发现小分子量(<300g/mol)的抗生素可以很容易地进入莴苣的根和芽,而大分子量(>400g/mol)的抗生素则主要积累于莴苣的根中;Kong等[13]通过实验表明随着水培系统中土霉素浓度增加,苜蓿叶子的颜色变为浅绿色甚至黄色.抗生素对作物的类似毒害作用近年来已被广泛报道[14],但鱼菜共生作为一种新型的水产养殖模式,抗生素对其系统性能影响尚不明确,亟需开展相关研究.
因此,本实验选取磺胺嘧啶为代表性抗生素,重点考察抗生素对鲤鱼-小白菜共生系统生产性能和氮元素转化的影响,并通过化学计量和分子生物学手段,解析磺胺嘧啶对鱼菜共生系统氮元素转化的影响机制,为鱼菜共生系统的设计与运行提供理论参考和技术指导.
1 材料与方法
1.1 实验装置及运行
在山东大学青岛校区环境科学与工程学院植物生长间搭建鲤鱼-小白菜共生系统,如图1所示.系统中的鱼箱和菜池均使用蓝色不透光PVC材料制成.其中鱼箱有效容积为40L,养殖15条重量在35g左右的中华鲤鱼(),顶部加盖以避光并防止鲤鱼跃出;菜池有效容积为80L,水面用泡沫制漂浮筏覆盖,并种植有长势相近的48株小白菜幼苗,种植密度为1株/dm2.通过海绵固定幼苗根部,实验期间每周向菜池水体中补充小白菜生长所需的营养素[15].
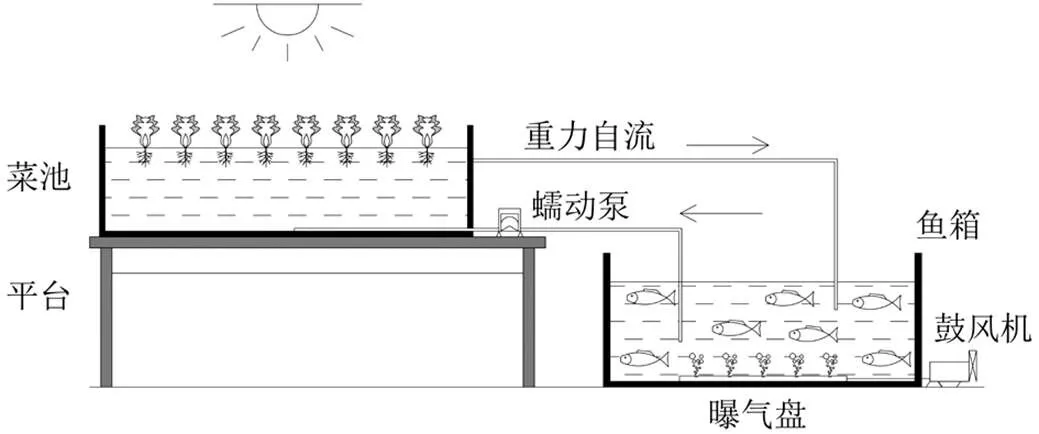
图1 鱼菜共生系统示意
实验期间持续对鱼箱进行0.1m3/h的曝气,维持溶解氧浓度大于5.0mg/L;每日对菜池昼夜(16h:8h)交替提供光照,温度维持在25℃.鱼箱及菜池中用水均为自来水,通过蠕动泵输水和重力自然回流实现系统的水循环,水力停留时间为2d[16].
共搭建2套装置,一套参考规范[17]中建议的投加量(日投鱼体重的1‰),在实验开始的前3d,在鱼食中拌饵投加共1.5g磺胺嘧啶,另外一套作为对照,不投加抗生素.
1.2 分析项目与测试方法
1.2.1 生产指标 记录每日喂食量,并采用称量法,测定实验开始前后鱼类总重,计算饲料转化率(FCR)[18].实验结束时,采用分光光度法测定叶片中叶绿素含量[19],并称量菜池中的蔬菜.
1.2.2 物化指标 实验期间每天对系统溶解氧、水温、光照强度等理化参数进行监测,保障系统持续稳定运行.同时根据标准方法对氨氮、亚硝酸盐氮、硝酸盐氮等水质指标进行测定[20].参考洪蕾洁等[21]的方法采用液相色谱法对水体中磺胺嘧啶浓度进行测定.参考邹艺娜等[22]的方法测定并计算实验期间系统内鱼箱和菜池的N2O释放通量.对鱼食及系统内各组分的样品进行预处理后,使用德国Vario Macro Cube元素分析仪测定其氮元素含量,并根据化学计量平衡分析元素分布[8].依据标准方法对鲤鱼样品进行处理后,采用液相色谱法测定其磺胺嘧啶含量[23].
1.2.3 微生物群落分析 实验结束时截取小白菜根部,在磷酸盐缓冲溶液中振荡分离根际表面附着的悬浮固体,使用离心机在5000r/min下离心5min后倒去上清液,收集底部的固体,使用德国GIAGEN公司生产的DNeasy PowerSoil Kit试剂盒提取DNA,通过实时荧光定量PCR仪对样品进行PCR扩增,进而定量氨氧化功能基因的表达情况,验证磺胺嘧啶影响系统氮循环的机理.同时,过滤收集鱼箱水体悬浮物,并采用上述方法提取其中的DNA后,对磺胺类药物抗性基因1、2、1的表达情况进行定量[24-25].
1.3 数据处理与分析
本研究中所有样品检测均进行3次平行实验,使用Microsoft Excel 2019与SPSS 22.0进行数据的统计与分析,最小显著性水平低于0.05.使用Origin 2018绘制图形,结果取3次平行实验的平均值.
2 结果与讨论
2.1 磺胺嘧啶对生产性能的影响
实验开展期间,2套装置中均未出现鱼类疾病或死亡现象;但实验组小白菜生长速度相对缓慢,并于实验中期(15d)开始出现叶片局部泛黄等现象,至实验结束时实验组中小白菜已全部死亡.
由表1可知,实验组中鲤鱼的进食量与饲料转化率均优于对照组,增重相较对照组提升约17%.这反映了适量抗生素的存在对鱼类生长起到促进作用[26].
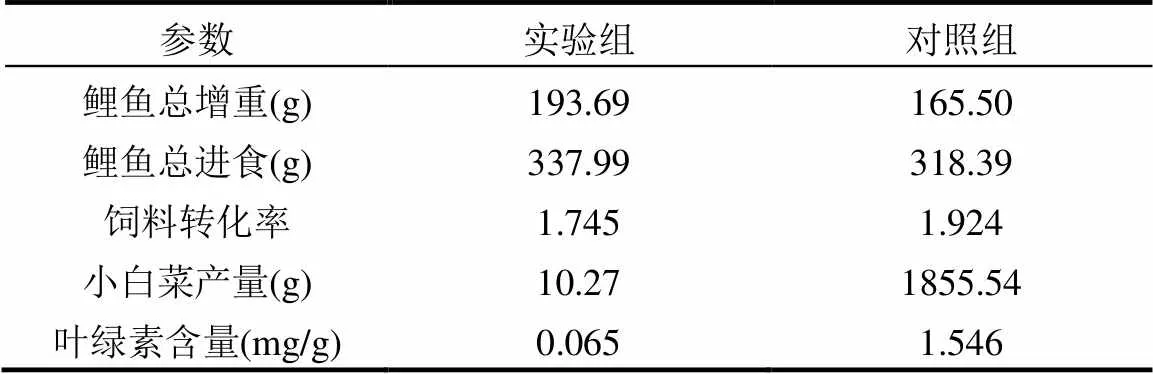
表1 系统的生产性能对比
由于磺胺嘧啶抑制了实验组小白菜叶片中叶绿素的积累,其叶绿素含量远低于对照组,这与赵保真[27]的研究相符合.叶绿素的减少将影响小白菜的光合效率,同时磺胺类药物对小白菜根和芽的生长也存在抑制作用[28],在多种因素的共同作用下,小白菜无法正常生长发育.因此在鱼菜共生系统中,磺胺嘧啶的使用将会导致蔬菜生产性能大幅下降.
图2反映了进入系统的氮元素的分布情况.化学计量分析结果表明,在对照组中,进入系统的氮元素分别被鲤鱼和小白菜摄取17.61%和26.05%,合计共43.66%的氮素作为产品回收,氮素利用效率(NUE)与文献报道结果相似[5,15].在实验组中,尽管鲤鱼回收的氮素占比为19.42%,略高于对照组,但由于小白菜产量极低,其氮素回收仅占1.78%,作为产品回收的氮元素合计占总输入量的21.20%,远低于对照组.
此外,鱼菜共生系统中存在部分氮素以N2O、NH3、N2等气体形式溢散,其中N2O是重要的温室气体,其全球升温潜能超过CO2的298倍[29].实验期间,对照组中以N2O的形式溢散的氮素占总输入氮的1.02%,与近年文献报道中的数值范围相近[20,30].但在实验组中,N2O转化率则达到了1.98%,约为对照组的1.94倍.因此,磺胺嘧啶的使用一方面降低了鱼菜共生系统对氮元素的利用效率,造成资源的浪费;另一方面增加了温室气体的排放,对环境带来不利影响.
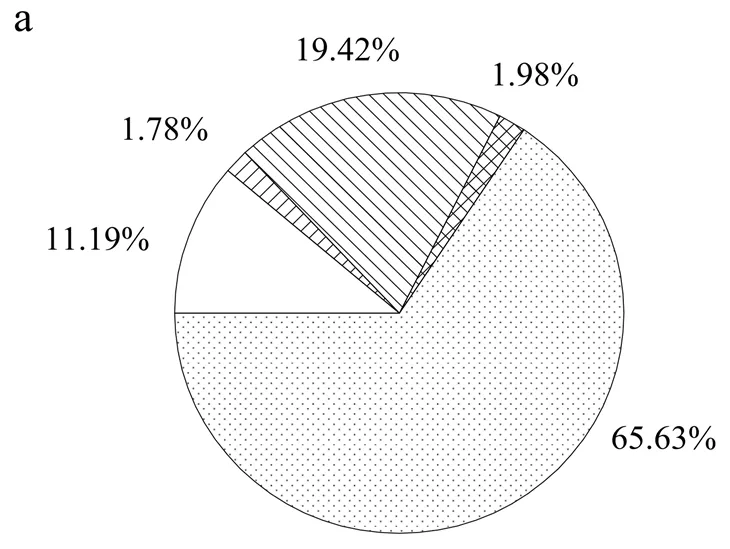
a.实验组;b.对照组

2.2 磺胺嘧啶对氮元素转化的影响
在有氧情况下,氨氧化细菌(AOB)将氨氮氧化为亚硝酸盐是鱼菜共生系统中去除氨的主要途径[31].由图3(a)可以看出,对照组中氨氮在前15d内缓慢积累,最高达到0.94mg/L,此后则下降至较低水平,基本维持在0.1~0.2mg/L之间.这一过程反映了在鱼菜共生系统的启动阶段,氨氮的净化受限于菜池内氨氧化细菌(AOB)群落的丰度,往往存在一段时间的适应期[31].而这一适应期的长短则反映了系统内AOB群落适应环境的速度.在实验组中,氨氮浓度在前20d迅速上升至3.68mg/L,直到32d时才降至与对照组相近的水平.实验组中出现的这一现象表明,磺胺嘧啶的存在使得其AOB群落的活性受到了抑制,从而降低了系统的氨氮氧化速率,这与Song等[32]的研究相符合.而随着时间的推进,AOB群落缓慢恢复活性,因此在实验末期其氨氮浓度逐渐下降至和对照组相近的水平.
在鱼菜共生系统中,亚硝酸盐主要来源于氨氮的氧化,而其去除则依赖于亚硝酸盐氧化菌(NOB)将其转化为硝酸盐.在实验的第6d前,对照组中的亚硝酸盐浓度保持上升,反映了鱼菜共生系统中NOB细菌群落的适应期[31].而在实验的第6~16d,对照组中亚硝酸盐浓度均大致保持下降趋势,造成这一现象的原因在于随着AOB群落适应期的结束,其氨氧化速率超过了NOB群落的亚硝酸盐氧化速率[33],这也恰好对应了图3(a)中氨氮的下降.此后,伴随着氨氧化过程和亚硝酸盐氧化过程的稳定,对照组中亚硝酸盐的浓度在短暂上升后逐渐下降至0.1mg/L以下,最终保持稳定.尽管有报道称磺胺类药物对水中的NOB群落存在抑制作用[34],但在实验的前16d,由于亚硝酸盐的产生受限于AOB群落的活性,实验组中亚硝酸盐的变化趋势与对照组大致相同,并未出现更快的累积.然而在16d后,实验组中亚硝酸盐氮的浓度迅速上升,最高达到21.13mg/L,这段时间AOB群落活性恢复,氨氧化速率上升,亚硝酸盐迅速积累.由于N2O的释放量与水中亚硝酸盐的浓度呈显著正相关关系[35],这也解释了2.1中实验组N2O释放量增加的现象.此后,随着实验组中NOB活性上升,水体中累积的亚硝酸盐被不断氧化,最终降到了和对照组相近的水平.
鱼菜共生系统中,植物的吸收同化是硝酸盐去除的重要途径[36].如图3(c)所示,在实验的前期,由于系统中亚硝酸盐氧化速率较低,实验组和对照组中硝酸盐浓度基本保持在0~3mg/L之间.在20d左右时,随着NOB群落的活性上升,系统中硝酸盐开始出现积累,但由于小白菜处于快速生长期,需要吸收大量硝酸盐[37],硝酸盐的产生和积累逐渐维持了动态平衡,直至小白菜成熟后,硝酸盐浓度恢复缓慢上升的趋势.然而在实验组中,由于小白菜的生长受到抑制,无法有效吸收水中的硝酸盐,因此在26d左右时,随着NOB群落活性的上升,硝酸盐在系统中持续积累.
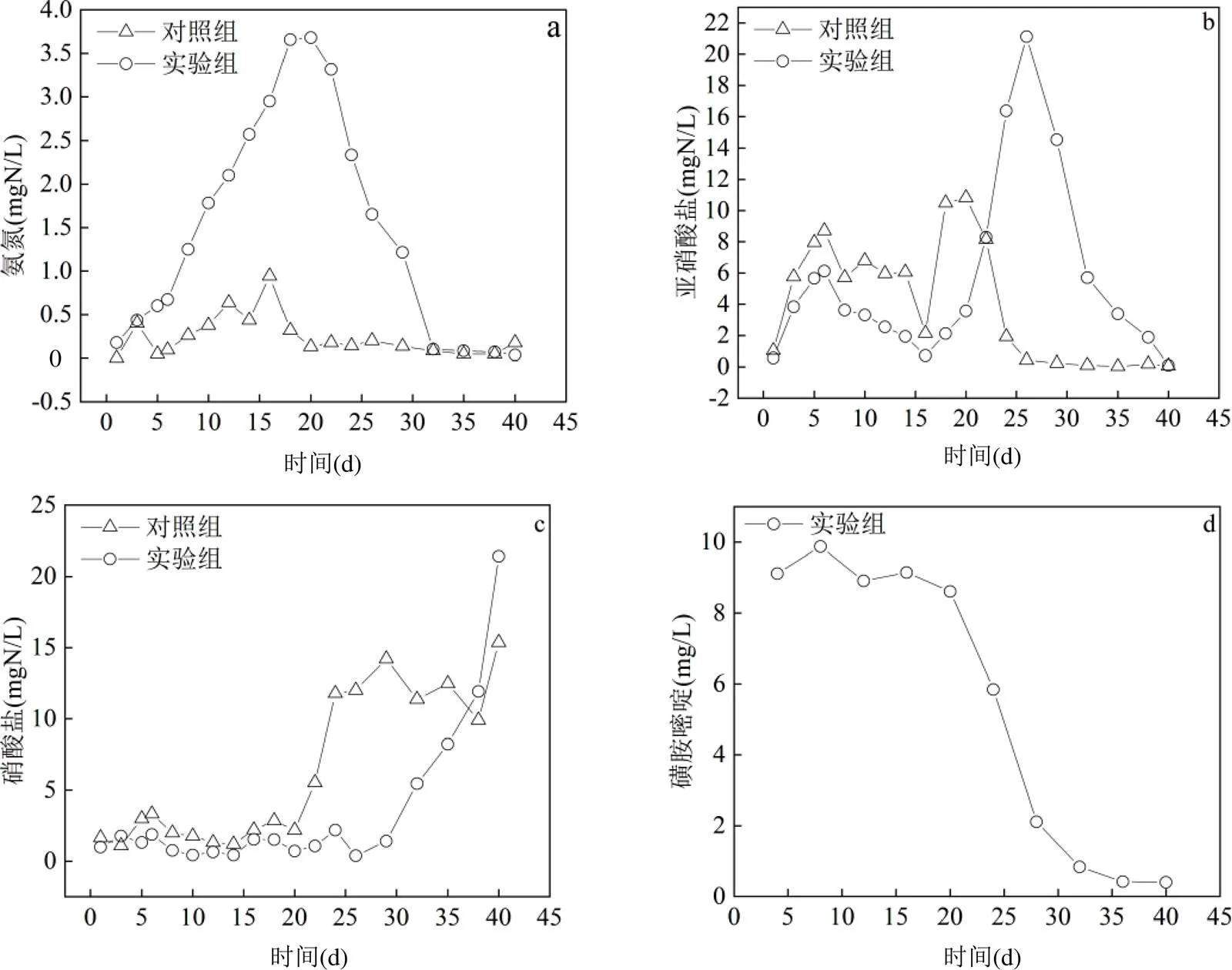
图3 系统中氨氮、亚硝酸盐、硝酸盐(以N计)及磺胺嘧啶浓度变化
图3(d)反映了实验期间实验组水体中磺胺嘧啶残余量的变化.由于水解和吸附对磺胺嘧啶的作用有限,水体中磺胺嘧啶的去除依赖于生物降解过程[38],而AOB分泌的氨单加氧酶在抗生素的生物降解中发挥着主导作用,因此磺胺嘧啶的变化可以反映系统中AOB的活性[39-40].在实验前期,实验组水体中磺胺嘧啶浓度保持在较高水平,未发生显著变化,这表明此时系统中AOB受到磺胺嘧啶的胁迫作用.而在20d后,磺胺嘧啶浓度迅速下降,表明随着AOB对磺胺嘧啶的逐渐适应,其活性的恢复使得水体中的磺胺嘧啶得到降解,这验证了对图3(a)中氨氮变化趋势的相关分析.
实验结束时实验组与对照组中氨氧化功能基因的拷贝数分别为2.65´107与1.75´107.的拷贝数反映了系统内AOB的数量.可以看出,尽管在实验初期磺胺嘧啶对系统内AOB存在抑制作用,但在实验结束时,实验组AOB的丰度未低于对照组,并相较对照组提高51.43%,说明其活性已得到恢复,这解释了实验中后期水体氨氮和磺胺嘧啶浓度的快速下降. Wang等[39]在对硝化污泥的研究中发现,暴露于磺胺嘧啶后,基因的表达水平将会上调,以克服磺胺嘧啶带来的不利影响.并且,在大部分时间里,实验组中氨氮浓度要高于对照组,这刺激了AOB的生长.两方面的作用,使得实验组的AOB丰度在实验末期超过了对照组.
2.3 磺胺嘧啶残余量及其抗性基因表达
实验期间,合计有1.5g磺胺嘧啶进入实验组.但在实验结束时,除水体中保留了47.85mg的磺胺嘧啶(占输入量的3.19%)外,绝大部分磺胺嘧啶均被降解或吸附.鱼体内的抗生素残余量平均为35.23μg/ kg,低于《无公害食品水产品中渔药残留限量》(NY 5070-2002)[41]中规定的100μg/kg,对人体健康的风险较小.对于摄取的磺胺嘧啶,鲤鱼具有排泄出体外,或通过肝脏与肌肉进行降解的能力,这降低了鲤鱼体内的磺胺嘧啶残余量[42].
图4反映了系统中磺胺嘧啶抗性基因的表达情况.在鱼箱内水体中,磺胺类药物抗性基因1、2、1均有检出,其中1、2、1在实验组中的拷贝数分别为对照组的7.23倍、2.74倍和4.12倍,这表明磺胺嘧啶促进了鱼菜共生系统内微生物抗药性的产生.当前学术界普遍认为,水生病原体和人体病原体之间通过质粒等可移动遗传单元构成的潜在桥梁,将会使得水体中细菌对抗生素的耐药性,传递到人类病原体中,进而对人体健康带来威胁[43].可见,在鱼菜共生系统中,抗生素的使用会带来抗性基因表达等环境风险.考虑到磺胺嘧啶对鱼菜共生系统多方面的负面影响,在其运行管理过程中应尽量减少或避免抗生素的使用.如有需要,可采取引入益生菌、噬菌体等作为生物防治剂[44-45],或使用药用植物及其衍生物作为免疫调剂等替代措施规避风险[46].
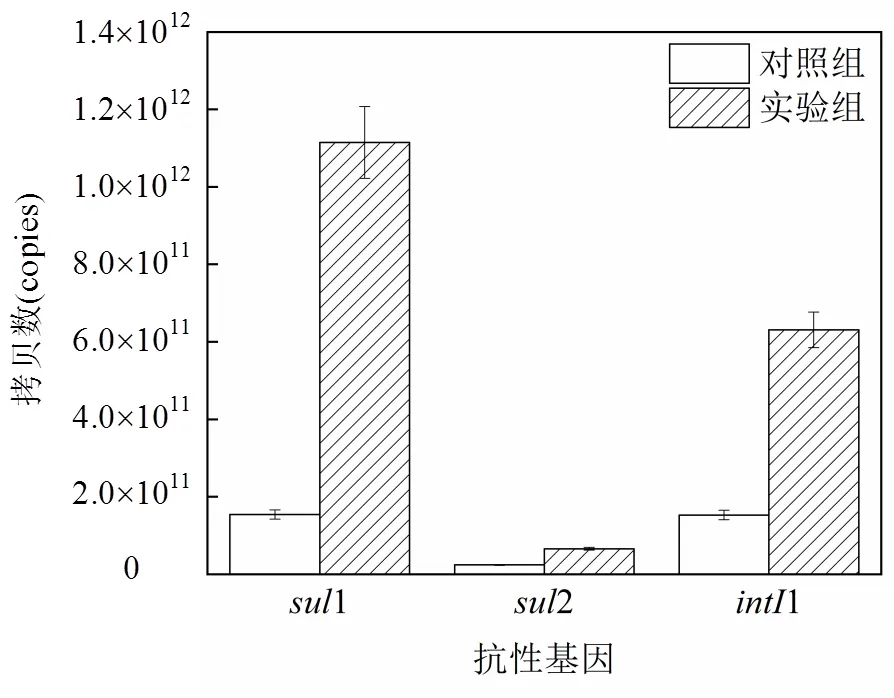
图4 系统中磺胺嘧啶抗性基因表达情况
3 结论
3.1 磺胺嘧啶的使用会提高鱼类的生产性能,但其对小白菜的毒害作用会严重影响小白菜的正常生长发育,促使其死亡,导致系统对氮元素的利用效率大大降低,N2O释放量增加.
3.2 磺胺嘧啶的使用会在投加初期抑制系统内的氨氮氧化过程和亚硝酸盐氧化过程,随着时间推进, AOB和NOB群落将逐渐恢复性能.但由于蔬菜的死亡,系统中硝酸盐得不到有效去除.
3.3 在投加量符合标准的情况下,鱼体内残余的抗生素将不会影响人体健康.但磺胺嘧啶的使用仍然会导致系统中抗性基因的表达,带来潜在的健康风险.
3.4 考虑到磺胺嘧啶对鱼菜共生系统多方面的负面影响,在其运行管理过程中应尽量减少或避免抗生素的使用,如有需要,应采取合理的替代措施规避其风险.
[1] FAO. The State of World Fisheries and Aquaculture 2018 - Meeting the sustainable development goals [M]. Rome: FAO, 2018:17-18.
[2] Naylor R L, Goldburg R J, Primavera J H, et al. Effect of aquaculture on world fish supplies [J]. Nature, 2000,405(6790):1017-1024.
[3] Graber A, Junge R. Aquaponic systems: Nutrient recycling from fish wastewater by vegetable production [J]. Desalination, 2009,246(1-3): 147-156.
[4] Cerozi, B S, Fitzsimmons K. Phosphorus dynamics modeling and mass balance in an aquaponics system [J]. Agricultural Systems, 2017,153:94-100.
[5] Zou Y, Hu Z, Zhang J, et al. Attempts to improve nitrogen utilization efficiency of aquaponics through nitrifies addition and filler gradation [J]. Environmental Science and Pollution Research, 2016,23(7):6671- 6679.
[6] Love D C, Fry J P, Li X, et al. Commercial aquaponics production and profitability: Findings from an international survey [J]. Aquaculture, 2015,35:67-74.
[7] Hu Z, Lee J W, Chandran K, et al. Effect of plant species on nitrogen recovery in aquaponics [J]. Bioresource Technology, 2015,188:92-98.
[8] Zou Y N, Hu Z, Zhang J, et al. Effects of pH on nitrogen transformations in media-based aquaponics [J]. Bioresource Technology, 2016,210:81-87.
[9] Sapkota A, Sapkota A R, Kucharski M, et al. Aquaculture practices and potential human health risks: Current knowledge and future priorities [J]. Environment International, 2008,34(8):1215-1226.
[10] Cabello F C. Heavy use of prophylactic antibiotics in aquaculture: a growing problem for human and animal health and for the environment [J]. Environmental Microbiology, 2006,8(7):1137-1144.
[11] Heuer O E, Kruse H, Grave K, et al. Human health consequences of use of antimicrobial agents in aquaculture [J]. Clinical Infectious Diseases, 2009,49(8):1248-1253.
[12] Chuang Y H, Liu C H, Sallach J B, et al. Mechanistic study on uptake and transport of pharmaceuticals in lettuce from water [J]. Environment International, 2019,131:104976.
[13] Kong W D, Zhu Y G, Liang Y C, et al. Uptake of oxytetracycline and its phytotoxicity to alfalfa (Medicago sativa L.) [J]. Environmental Pollution, 2007,147(1):187-193.
[14] Madikizela L M, Ncube S, Chimuka L. Uptake of pharmaceuticals by plants grown under hydroponic conditions and natural occurring plant species: A review [J]. Science of the Total Environment, 2018,636: 477-486
[15] Ru D Y, Liu J K, Hu Z, et al. Improvement of aquaponic performance through micro- and macro-nutrient addition [J]. Environmental Science and Pollution Research, 2017,24(19):16328-16335.
[16] Fang Y, Chen X, Hu Z, et al. Effects of hydraulic retention time on the performance of algal-bacterial-based aquaponics (AA): focusing on nitrogen and oxygen distribution [J]. Applied Microbiology and Biotechnology, 2018,102(22):9843-9855.
[17] SC/T 1084-2006 磺胺类药物水产养殖使用规范 [S]. SC/T 1084-2006 Specification for the application of sulfanilamides in aquaculture [S].
[18] Li W, Wei Q W, Luo H. Special collector and count method in a recirculating aquaculture system for calculation of feed conversion ratio in fish [J]. Aquacultural Engineering, 2014,60:63-67.
[19] NY/T 3082-2017 水果、蔬菜及其制品中叶绿素含量的测定:分光光度法 [S]. NY/T 3082-2017 Determination of chlorophyll content in fruits, vegetables and derived products-Spectrophotometry method [S].
[20] 国家环境保护总局.水和废水监测分析方法 [M]. 北京:中国环境科学出版社, 2002. General Administration of Environmental Protection of the People’s Republic of China. Standard methods for the examination of water and wastewater [M]. Beijing: China Environmental Science Press, 2002.
[21] 洪蕾洁,石 璐,张亚雷,等.固相萃取-高效液相色谱法同时测定水体中的10种磺胺类抗生素 [J]. 环境科学, 2012,33(2):652-657. Hong L J, Shi L, Zhang Y L, et al. Simultaneous determination of 10sulfonamide antibiotics in water by solid-phase extraction and high performance liquid chromatography [J]. Environmental Science, 2012, 33(2):652-657.
[22] 邹艺娜,胡 振,张 建,等.鱼菜共生系统氮素迁移转化的研究与优化 [J]. 环境工程学报, 2015,9(9):4211-4216. Zou Y N, Hu Z, Zhang J, et al. Investigation and optimization of nitrogen transformations in aquaponics [J]. Chinese Journal of Environmental Engineering, 2015,9(9):4211-4216.
[23] GB 1077-1-2008 水产品中17种磺胺类及15种喹诺酮类药物残留量的测定液相色谱-串联质谱法 [S]. GB 1077-1-2008 Simultaneou determination of 17sulfonamides and 15quinolones residues in aquatic products by LC-MS/MS method [S].
[24] Zhi W, Ji G. Quantitative response relationships between nitrogen transformati on rates and nitrogen functional genes in a tidal flow constructed wetland under C/N ratio constraints [J]. Water Research, 2014,64:32-41.
[25] 王 娜,杨晓洪,郭欣妍,等.磺胺类耐药菌中抗性基因的表达规律 [J]. 生态毒理学报, 2015,10(5):75-81. Wang N, Yang X H, Guo X Y, et al. Expression patterns ofgenes in sulfonamide-resistant bacteria [J]. Asian Journal of Ecotoxicology, 2015,10(5):75-81.
[26] Mo W Y, Chen Z T, Leung H M, et al. Application of veterinary antibiotics in China's aquaculture industry and their potential human health risks [J]. Environmental Science and Pollution Research, 2017, 24(10):8978-8989.
[27] 赵保真.Cu-磺胺嘧啶单一及复合污染的生态毒性效应研究 [D]. 新乡:河南师范大学, 2012. Zhao B Z. Study of the ecology toxic effects of single and combined pollution between Cu and sulfadiazine [D]. Xinxiang: Henan Normal University, 2012.
[28] Jin C, Chen Q, Sun R, et al. Eco-toxic effects of sulfadiazine sodium, sulfamonomethoxine sodium and enrofloxacin on wheat, Chinese cabbage and tomato [J]. Ecotoxicology, 2009,18(7):878-885.
[29] Hu Z, Lee J W, Chandran K, et al. Nitrous oxide (N2O) emission from aquaculture: A review [J]. Environmental Science & Technology, 2012,46(12):6470-6480.
[30] Wongkiew S, Popp B N, Khanal S K. Nitrogen recovery and nitrous oxide (N2O) emissions from aquaponic systems: Influence of plant species and dissolved oxygen [J]. International Biodeterioration & Biodegradation, 2018,134:117-126.
[31] Wongkiew S, Hu Z, Chandran K, et al. Nitrogen transformations in aquaponic systems: A review [J]. Aquacultural Engineering, 2017,76: 9-19.
[32] Song Z, Zhang X, Sun F, et al. Specific microbial diversity and functional gene (AOB) analysis of a sponge-based aerobic nitrifying moving bed biofilm reactor exposed to typical pharmaceuticals [J]. Science of the Total Environment, 2020,742: 140660.
[33] Wang L, Wang X, Yang F, at al. Nitrogen removal performance and ammonia- and nitrite-oxidizing bacterial community analysis of a novel industrial waste-based biofilter [J]. Chemical Engineering Journal, 2016,299:156-166.
[34] Chang B V, Chang Y T, Chao W L, et al. Effects of sulfamethoxazole and sulfamethoxazole-degrading bacteria on water quality and microbial communities in milkfish ponds [J]. Environmental Pollution, 2019,252(Pt A):305-316.
[35] Peng L, Ni B J, Ye L, et al. The combined effect of dissolved oxygen and nitrite on N2O production by ammonia oxidizing bacteria in an enriched nitrifying sludge [J]. Water Research, 2015,73:29-36.
[36] Buhmann A, Papenbrock J. Biofiltering of aquaculture effluents by halophytic plants: Basic principles, current uses and future perspectives [J]. Environmental and Experimental Botany, 2013,92:122-133.
[37] 罗 健,程东山,林东教,等.不同收获时期和控氮条件对水培小白菜硝酸盐含量的影响 [J]. 生态环境, 2005,(4):562-566. Luo J, Cheng D S, Lin D J, et al. Effects of harvesting time and controlled supply of nitrogen on nitrate content of Brassia campestris in hydroponics [J]. Ecology and Environmental Sciences, 2005,(4): 562-566.
[38] Kummerer K. Antibiotics in the aquatic environment - A review - Part I [J]. Chemosphere, 2009,75(4):417-434.
[39] Wang B, Ni B J, Yuan Z, et al. Unravelling kinetic and microbial responses of enriched nitrifying sludge under long-term exposure of cephalexin and sulfadiazine [J]. Water Research, 2020,173:115592.
[40] Dong H Y, Yuan X J, Wang W D, et al. Occurrence and removal of antibiotics in ecological and conventional wastewater treatment processes: A field study [J]. Journal of Environmental Management, 2016,178:11-19.
[41] NY 5070-2002 无公害食品水产品中渔药残留限量 [S]. NY 5070-2002 Non-polluted food: Residue limits of fishery drugs in aquatic products [S].
[42] Zhao H, Liu S, Chen J, et al. Biological uptake and depuration of sulfadiazine and sulfamethoxazole in common carp (Cyprinus carpio) [J]. Chemosphere, 2015,120:592-597.
[43] Cabello F C, Godfrey H P, Buschmann A H, et al. Aquaculture as yet another environmental gateway to the development and globalisation of antimicrobial resistance [J]. The Lancet Infectious Diseases, 2016, 16(7):e127-e133.
[44] Verschuere L, Rombaut G, Sorgeloos P, et al. Probiotic bacteria as biological control agents in aquaculture [J]. Microbiology and Molecular Biology Reviews, 2000,64(4):655-671.
[45] Sieiro C, Areal-Hermida L, Pichardo-Gallardo A, et al. A hundred years of bacteriophages: Can phages replace antibiotics in agriculture and aquaculture? [J]. Antibiotics-Basel, 2020,9(8):493.
[46] Awad E, Awaad A. Role of medicinal plants on growth performance and immune status in fish [J]. Fish & Shellfish Immunology, 2017,67: 40-54.
Effect of sulfadiazine on the nitrogen transformation of aquaponic systems.
HU Hao-dong, GAO Hang, HU Zhen*
(Shandong Province Key Laboratory of Water Pollution Control and Resource Reuse, School of Environmental Science and Engineering, Shandong University, Qingdao 266237, China)., 2021,41(4):1697~1703
In this study, impact of sulfadiazine, one of the typical antibiotics, on the performance and nitrogen transformation of lab scale aquaponic systems were reported. Results showed that sulfadiazine increased the growth of carps () by 17%, but had significant adverse effects on the growth of pakchoi (), which reduced the nitrogen utilization rate of the system from 43.66% to 21.20%, and increased its N2O conversion rate from 1.02% to 1.98%. Sulfadiazine was observed to have short-term inhibitory effects on the nitrification process of the system, however, the ammonia concentration of experimental group was decreased to the similar level as that in the control group after 32 days of adaptation. Furthermore, the abundance of ammonia oxidizing bacteria in the experimental group increased by 51.43% compared with the control group. The residual sulfadiazine in the fish was 35.23μg/kg, which was below the requirement of national standard, but the copies of sulfadiazine resistance genes1,2 and1 in the water increased by 7.23, 2.74 and 4.12 times. Taking the production performance and environmental friendliness into consideration, the use of antibiotics should be reduced or avoided during the design and operation of aquaponic systems and reasonable alternative measures need to be used to avoid antibiotics induced risks.
aquaponic;sulfadiazine;nitrogen;ammonia oxidizing bacteria;resistance genes
X703
A
1000-6923(2021)04-1697-07
胡浩东(1997-),男,山东泰安人,山东大学硕士研究生,主要从事废水处理及其资源化利用.
2020-09-08
国家自然科学基金资助项目(51878388);山东省重大科技创新工程(2019JZZY010411);山东省优秀青年基金项目(ZR2020YQ42)
* 责任作者, 教授, huzhen885@sdu.edu.cn
