lncRNA MEG3对视网膜母细胞瘤细胞增殖与迁移的作用及其机制研究△
2021-04-29赵凌军杨卫民杨潇远李季
赵凌军 杨卫民 杨潇远 李季
视网膜母细胞瘤(retinoblastoma,RB)是常见的儿童眼内恶性肿瘤,发病率及死亡率高,严重威胁着患儿视力与生命安全[1-2]。RB传统治疗方法包括放射治疗、化学治疗、激光以及眼球摘除等,但极易引起细菌感染、永久失明等,而且多数预后不良[3-5]。随着现代医疗技术的不断提高,RB的治疗目标从只能保护患儿生命转向提高患儿生存质量;不仅需要保留患儿眼球,更需要保留患儿视功能。长链非编码RNAs(long noncoding RNAs,lncRNAs)是由200多个碱基组成的一种非编码RNA,具有抑制肿瘤细胞增殖与迁移的功能[6]。母系表达基因3(maternally expressed gene 3,MEG3)定位在人类14q32.3染色体上,在人体正常组织中能够广泛表达,在一些肿瘤细胞中表达下降,且MEG3过表达能够抑制肿瘤细胞增殖与迁移[7-8]。目前,lncRNA MEG3对RB的作用机制相关研究报道较少。因此,本研究基于Wnt/β-catenin信号通路探讨lncRNA MEG3对RB细胞增殖与迁移的作用,为临床RB治疗提供一定的理论基础。
1 材料与方法
1.1 材料人RB细胞系SO-Rb50细胞购自上海邦景实业有限公司。胰蛋白酶、胎牛血清(FBS)、RPMI 1640培养基、Wnt/β-catenin信号通路激活剂氯化锂(LiCl)(美国Gibco公司);兔抗人Wnt1多克隆抗体、兔抗人β-catenin、Cyclin D1单克隆抗体、辣根过氧化物标记的山羊抗兔IgG(日本TaKaRa公司);CCK-8试剂盒、二喹啉甲酸(BCA)试剂盒(美国MedChemexpress生物科技公司);荧光定量试剂盒、反转录试剂盒(日本TaKaRa公司);脂质体Lipofectamine TM2000转染试剂盒(Invitrogen公司);CO2细胞培养箱(美国SIM公司);DFM-60C倒置荧光显微镜(上海蔡康光学仪器有限公司)。
1.2 方法
1.2.1 细胞培养取常规冻存复苏的RB细胞系SO-Rb50细胞,接种于含体积分数10% FBS、100 U·mL-1青霉素及20 mg·L-1庆大霉素的RPMI 1640培养基,置于37 ℃、含体积分数5% CO2培养箱内培养。2~3 d传代一次,选取对数生长期SO-Rb50细胞进行后续实验。
1.2.2 分组与细胞转染取对数生长期的RB细胞,按照200×103个·mL-1的密度将其接种到6孔培养板中,细胞生长密度在70%以上时按照转染试剂盒说明书将质粒与脂质体混匀,室温孵育20 min,转移至不含FBS的RPMI 1640培养基中培育5 h,换成含体积分数10% FBS的RPMI 1640培养基。48 h后在荧光显微镜下观察细胞转染效率达到80%,可以进行后续实验。将RB细胞分为对照组(不做任何处理)、NC组(含lncRNA MEG3-NC无序干扰序列的pcDNA3.1质粒)、lncRNA MEG3组(含lncRNA MEG3序列的pcDNA3.1质粒)、激活剂组(含lncRNA MEG3序列的pcDNA3.1质粒+Wnt/β-catenin通路激活剂LiCl),激活剂LiCl浓度为25 mmol·L-1。
1.2.3 RT-qPCR检测各组RB细胞中lncRNA MEG3表达取各组转染RB细胞,提取RNA,用反转录试剂盒将其反转录为cDNA进行RT-qPCR。PCR反应条件:预变性95 ℃ 5 min;变性95 ℃ 15 s;退火58 ℃ 20 s,延伸72 ℃ 20 s,共45个循环;然后72 ℃ 10 min,4 ℃终止反应。lncRNA MEG3上游引物: 5’-CTTGACTTACCGTGAGTGT-3’,下游引物: 5’-CAGATGCACTTCTCAGACA-3’。采用2-△△Ct法对lncRNA MEG3表达进行定量分析。
1.2.4 CCK-8法检测lncRNA MEG3对RB细胞增殖的影响取各组转染RB细胞,调整RB细胞密度为50×103个·mL-1,接种于24孔细胞培养板中,在37 ℃、含体积分数5% CO2培养箱中分别培养24 h、48 h、72 h后,每孔加10 μL CCK-8试剂,室温继续培养4 h,酶标仪测定490 nm的各孔吸光度(D)值,计算RB细胞增殖抑制率。细胞抑制率=(D对照孔-D处理孔)/D对照孔×100%。
1.2.5 Transwell实验检测细胞迁移取稳定转染各组RB细胞,调整细胞密度为200×103个·mL-1;在Transwell小室下室加入600 μL含体积分数10% FBS的RPMI 1640培养基,上室加100 μL细胞悬液,继续培养24 h。取出小室,吸干上室液体,移入含800 μL甲醇的孔中,固定0.5 h;取出小室,吸干上室甲醇,移入含800 μL Giemsa染液的孔中,染色0.5 h;用清水缓慢冲洗5次,取出小室,吸去上室液体,小心擦去底部膜表面的细胞;揭下膜,底面朝上晾干,中性树胶封片,显微镜下观察。随机取10个视野对RB细胞进行计数,求平均值。
1.2.6 RT-PCR检测各组细胞中Wnt1、β-catenin、Cyclin D1的mRNA表达取稳定转染各组RB细胞,用TRIzol法提取细胞总RNA,用TaKaRa逆转录试剂盒将总RNA反转录为cDNA。检测各组RB细胞中Wnt1、β-catenin、Cyclin D1 mRNA相对表达量。引物序列如下:Wnt1上游引物为5’-ACTCTCGACCGCGACTACAG-3’,下游引物为5’-GGCGACTCTCAGAGTGAACC-3’,大小为276 bp;β-catenin上游引物为5’-AAGTCTTGGCTATTACGACA-3’,下游引物为5’-AAGTCCACCTTCACGACCTT-3’ ,大小为253 bp;Cyclin D1上游引物为5’-CAGAGTCAGAGCTTAGGTCT-3’,下游引物为5’-GTAACGGAGTGTGCACAGCG-3’ ,大小为298 bp。PCR反应条件:预变性95 ℃ 5 min;变性95 ℃ 15 s;退火58 ℃ 20 s,延伸72 ℃ 25 s,40个循环;72 ℃ 5 min,4 ℃终止反应。采用2-△△Ct法对RB细胞中不同因子mRNA表达定量分析。
1.2.7 Western blot 检测各组细胞中Wnt1、β-catenin、Cyclin D1蛋白表达取各组转染RB细胞,提取总蛋白,BCA试剂盒进行蛋白定量。95 ℃水浴变性8 min,进行聚丙烯酰氨凝胶电泳,电泳结束,转膜至PVDF膜上,封闭液室温封闭2 h,分别加入Wnt1多克隆抗体、β-catenin、Cyclin D1单克隆抗体(按体积比12000 进行稀释),4 ℃孵育过夜,TBST洗膜,加入辣根过氧化物酶标记的羊抗鼠IgG(按体积比14000进行稀释),37 ℃孵育1 h。TBST清洗6次,加入ECL显色,拍照。以GAPDH作为内参,检测各组RB细胞中Wnt1、β-catenin、Cyclin D1蛋白相对表达水平。
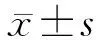
2 结果
2.1 各组RB细胞中lncRNA MEG3相对表达水平比较对照组、NC组、lncRNA MEG3组和激活剂组RB细胞中lncRNA MEG3相对表达水平分别为 0.81±0.27、0.78±0.26、3.88±0.39、3.76±0.38,组间比较差异有统计学意义(F=28.515,P<0.05)。与对照组和NC组相比,lncRNA MEG3组和激活剂组RB细胞中lncRNA MEG3相对表达水平均升高,差异均有统计学意义(与对照组相比:t=14.472、14.151,均为P<0.05;与NC组相比:t=14.789、14.472,均为P<0.05);NC组与对照组、激活剂组与lncRNA MEG3组RB细胞中lncRNA MEG3相对表达水平比较,差异均无统计学意义(t=0.179,P=0.862;t=0.493,P=0.635)。
2.2 lncRNA MEG3对各组RB细胞增殖的影响CCK-8法检测结果显示:各组RB细胞培养24 h、48 h、72 h细胞增殖抑制率组间比较,差异有统计学意义(P<0.05)。与NC组相比,lncRNA MEG3组RB细胞培养24 h、48 h、72 h细胞增殖抑制率逐渐升高,差异均有统计学意义(均为P<0.05);与lncRNA MEG3组相比,激活剂组RB细胞培养24 h、48 h、72 h细胞增殖抑制率逐渐降低,差异均有统计学意义(均为P<0.05)。激活剂组与NC组RB细胞培养24 h、48 h、72 h 细胞增殖抑制率比较,差异均无统计学意义(均为P>0.05)。NC组、lncRNA MEG3组、激活剂组RB细胞增殖抑制率均随时间延长而升高,差异均有统计学意义(均为P<0.05)(见表1)。
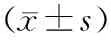
表1 lncRNA MEG3对各组RB细胞增殖的影响
2.3 lncRNA MEG3对各组RB细胞迁移的影响对照组、NC组、lncRNA MEG3组和激活剂组RB细胞迁移数分别为(78.50±8.01)个、(72.80±7.25)个、(26.60±3.03)个、(54.60±5.79)个,组间细胞迁移数比较,差异有统计学意义(F=49.581,P<0.05)。与对照组相比,lncRNA MEG3组和激活剂组细胞迁移数均减少,差异均有统计学意义(t=13.551、5.407,均为P<0.05);与NC组相比,lncRNA MEG3组和激活剂组细胞迁移数也均减少,差异也均有统计学意义(t=13.147、4.386,均为P<0.05);与lncRNA MEG3组相比,激活剂组细胞迁移数增多,差异有统计学意义(t=9.581,P<0.05);NC组与对照组细胞迁移数相比,差异无统计学意义(t=1.180,P=0.272)(见图1)。
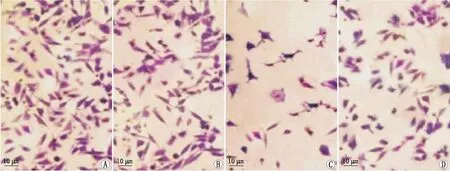
图1 各组RB细胞迁移情况(放大倍数:×200) A:对照组;B:NC组;C:lncRNA MEG3组;D:激活剂组。
2.4 各组RB细胞中Wnt1、β-catenin、Cyclin D1的mRNA相对表达水平比较qRT-PCR检测结果显示:与对照组和NC组相比,lncRNA MEG3组和激活剂组RB细胞中Wnt1、β-catenin、Cyclin D1 mRNA相对表达水平均降低,差异均有统计学意义(均为P<0.05);与lncRNA MEG3组相比,激活剂组RB细胞中Wnt1、β-catenin、Cyclin D1 mRNA相对表达水平均升高,差异均有统计学意义(均为P<0.05)。NC组与对照组RB细胞中Wnt1、β-catenin、Cyclin D1 mRNA相对表达水平相比,差异均无统计学意义(均为P>0.05)(见表2)。

表2 各组RB细胞中Wnt1、β-catenin、Cyclin D1 mRNA相对表达水平比较
2.5 各组RB细胞中Wnt1、β-catenin、Cyclin D1蛋白相对表达水平比较Western blot检测结果显示,与对照组和NC组相比,lncRNA MEG3组和激活剂组RB细胞中Wnt1、β-catenin、Cyclin D1蛋白相对表达水平均降低(均为P<0.05);与lncRNA MEG3组相比,激活剂组RB细胞中Wnt1、β-catenin、Cyclin D1蛋白相对表达水平均升高(均为P<0.05);NC组与对照组RB细胞中Wnt1、β-catenin、Cyclin D1蛋白相对表达水平相比,差异均无统计学意义(均为P>0.05)(见表3、图2)。

表3 各组RB细胞中Wnt1、β-catenin、Cyclin D1蛋白相对表达水平比较

图2 各组RB细胞中不同因子蛋白的表达 A:对照组;B:NC组;C:lncRNA MEG3组;D:激活剂组。
3 讨论
RB是儿童中多发的遗传性眼内恶性肿瘤,严重影响患儿外貌、视力、心理发育等,甚至威胁患儿的生命安全。lncRNAs在多种疾病中发挥重要作用,甚至包括肿瘤。研究发现lncRNAs在肿瘤的发生进展过程中具有抑癌基因的作用,影响肿瘤细胞的增殖、侵袭等过程[9]。MEG3是潜在的抑癌基因,其表达产物是第一个被发现具有肿瘤抑制功能的lncRNA。Zhang等[10]研究发现,宫颈癌组织中lncRNA MEG3呈低表达,在宫颈癌细胞中高表达lncRNA MEG3可以增加细胞凋亡及减少细胞增殖。lncRNA MEG3在RB中研究较少,且其作用机制尚未完全清楚。缪珊珊等[11]研究发现,萝卜硫素能够抑制RB细胞系 Y79细胞增殖并诱导其凋亡,可能与抑制Wnt/β-catenin信号通路活化有关。因此,本研究分析了lncRNA MEG3对RB细胞增殖、迁移的作用,并探讨是否与Wnt/β-catenin信号通路活化有关。
细胞增殖和凋亡在正常情况下维持着动态平衡,增殖失控或凋亡受阻导致平衡被打破,进而肿瘤发生。有研究发现lncRNA MEG3通过调控Notch信号通路有效抑制子宫内膜癌细胞增殖[12]。Lu等[13]在非小细胞肺癌的细胞系中过表达lncRNA MEG3后检测细胞功能变化,结果显示,细胞增殖明显减少,细胞凋亡增加,提示lncRNA MEG3在非小细胞肺癌中发挥抑癌作用。另外,lncRNA MEG3在肺癌及肝癌细胞的增殖与凋亡中也起关键作用[14-15]。本研究结果也显示,lncRNA MEG3组较对照组RB细胞增殖抑制率升高,细胞迁移数减少;且RB细胞增殖抑制率随作用时间延长而升高,表明过表达lncRNA MEG3能够抑制RB细胞增殖及迁移能力。
Wnt/β-catenin信号通路广泛存在于多细胞生物体内,由Wnt基因调控,在胚胎发育、细胞增殖与分化等生命过程中发挥重要作用,并参与调控肿瘤细胞增殖、迁移与凋亡过程[16-17]。在正常分化的细胞中,细胞膜上的β-catenin蛋白被磷酸化,通过泛素化降解,导致细胞质中游离β-catenin蛋白减少,不能激活Wnt/β-catenin信号通路下游效应因子的表达。当Wnt/β-catenin信号通路被异常激活时,β-catenin和Wnt蛋白表达异常,激活下游Cyclin D1蛋白,使Cyclin D1蛋白异常表达,促进细胞增殖和迁移,参与肿瘤发生发展[18]。研究表明,Wnt/β-catenin信号通路是人类多种疾病发生的关键,其被异常激活会促进肿瘤的发生发展[19-20]。邓荣华等[21]研究发现,过表达lncRNA MEG3可通过调控Wnt/β-catenin信号通路抑制肝癌细胞增殖,促进细胞凋亡。Liu等[22]通过对口腔鳞状细胞癌进行研究,发现lncRNA MEG3能够通过Wnt/β-catenin信号通路参与疾病的发生发展。本研究结果也发现,与对照组和NC组相比,lncRNA MEG3组RB细胞Wnt1、β-catenin、Cyclin D1 mRNA和蛋白相对表达水平均降低;添加Wnt/β-catenin信号通路激活剂后,与lncRNA MEG3组相比,激活剂组RB细胞Wnt1、β-catenin、Cyclin D1 mRNA和蛋白相对表达水平均升高,表明lncRNA MEG3抑制RB细胞增殖及迁移,可能是通过增强Wnt1、β-catenin蛋白的磷酸化,加速泛素化降解,抑制Cyclin D1等靶基因的转录从而阻断Wnt/β-catenin信号通路,抑制RB细胞的增殖及迁移。
综上所述,lncRNA MEG3能够抑制人RB细胞的增殖和迁移,其机制可能是通过阻断Wnt/β-catenin信号通路来发挥作用的。本研究结果可为RB的临床治疗提供一定的理论依据。
