长链非编码RNA-心肌梗死相关转录本对过氧化氢诱导的人晶状体上皮细胞凋亡和氧化应激的调控作用△
2021-04-29卞龙艳庄敏李姝戴颖
卞龙艳 庄敏 李姝 戴颖
白内障是以晶状体上皮细胞损伤引起晶状体混浊为主要特征的眼科疾病[1],晶状体上皮细胞凋亡是其发生的主要病理基础。Bai等[2]研究证实,活性氧簇(ROS)大量蓄积引起的氧化应激反应可以通过激活p38丝裂原活化蛋白激酶(p38 MAPK)通路诱导人晶状体上皮细胞凋亡,进而导致白内障发生。最近有研究发现,心肌梗死相关转录本(myocardial infarction-associated transcript,MIAT)可能是白内障疾病中一个很有前途的功能性长链非编码RNA(lncRNA)[3],可以作为内源竞争性RNA与各种编码蛋白质的信使RNA竞争性结合或共享微小RNA(miRNA),从而抑制 miRNA对靶基因的调控[4]。目前关于lncRNA-MIAT在白内障中的作用和调控作用尚未明确。因此,本研究通过过氧化氢(H2O2)诱导人晶状体上皮细胞氧化应激损伤模型,探讨lncRNA-MIAT对人晶状体上皮细胞凋亡和氧化应激的调控作用及其机制,以期为白内障的发病机制研究及临床治疗提供新的思路。
1 材料与方法
1.1 材料人晶状体上皮细胞株 HLE-B3购自美国典型菌种保藏中心(ATCC)。DMEM培养基(美国Gibco公司);Annexin V-FITC/PI 流式细胞检测试剂盒(美国BD公司);CCK-8、ROS、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒(上海碧云天有限公司);SYBR Premix Ex Taq 试剂盒(日本TaKaRa公司);TaqManTMMicroRNA逆转录试剂盒和Taqman 2× universal PCR Master Mix试剂盒(美国Applied Biosystems公司);双荧光素酶报告试剂盒(美国Promega公司);pcDNA3.1载体质粒和lipofectamineTM2000转染试剂(美国Invitrogen公司);miR-22 inhibitor、lncRNA-MIAT inhibitor及其相应的阴性对照品均由上海吉玛基因公司合成;免疫印迹一抗B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(BAX)、p-p38 MAPK、 p38 MAPK、c-Jun氨基末端激酶(JNK)、p-JNK(美国Abcam公司)。
1.2 方法
1.2.1 细胞培养及转染人晶状体上皮细胞株 HLE-B3用含体积分数10%胎牛血清、100×103U·L-1青霉素和100 mg·L-1链霉素的DMEM完全培养基于37 ℃、体积分数5%CO2饱和湿度的环境中培养。取生长状态良好的对数生长期细胞用于转染。合成三个针对第5个外显子区域上不同位置的不同lncRNA-MIAT siRNA,包括M1(靶位点6488-6508)、M2(靶位点7222-7242)和M3(靶位点9735-9755)。对照细胞接受阴性对照siRNA。siRNA非特异性阴性序列:5’-UUCUCCGAACGUGUCACGUTT-3’;lncRNA-MIAT siRNA M1:5’-GGUGUUAAGACUUGGUUUCTT-3’;lncRNA-MIAT siRNA M2:5’-ACUUCUUCGUAUGUUCGGCTT-3’;lncRNA-MIAT siRNA M3:5’-CAGCAGTTGAGGGTTTGCTGTGTAT-3’。将si-MIAT连接到pcDNA3.1质粒中,构建稳定敲除lncRNA-MIAT的载体。在脂质体3000试剂的协助下,将pcDNA3.1空载体或si-MIAT转染到HLE-B3细胞中。加入含0.5 g·L-1G418(遗传霉素)培养基中筛选培养4周后,获得稳定沉默lncRNA-MIAT表达的细胞系。另外用LipofectamineTM2000试剂转染miR-22 inhibitor或NC-inhibitor。随后实验中,收集转染后48 h细胞用于检测。
1.2.2 细胞分组及处理将生长良好的HLE-B3细胞分为:空白对照组、H2O2组、阴性对照组、si-MIAT组、si-MIAT+miR-22 inhibitor组。空白对照组:细胞不做特殊处理;阴性对照组:细胞转染空质粒;si-MIAT组:细胞转染pcDNA3.1-si-MIAT沉默lncRNA-MIAT表达;si-MIAT+miR-22 inhibitor组:获得稳定沉默lncRNA-MIAT表达的细胞系(转染步骤同si-MIAT组)后,脂质体转染miR-22 inhibitor。除空白对照组细胞外,其余各组细胞处理完成后用适宜浓度H2O2(根据H2O2诱导实验结果,100 μmol·L-1时,HLE-B3细胞凋亡率约50%)培养12 h。
1.2.3 RT-qPCR检测各组细胞中lncRNA-MIAT和miR-22表达采用TRIzol试剂盒提取总RNA。下游分析使用260 nm处光密度(D)值和280 nm处D值比值为1.80~2.20的RNA。使用逆转录试剂盒将每个样本中的1 μg RNA反向转录为cDNA。逆转录的热循环程序为16 ℃ 30 min、42 ℃ 30 min和85 ℃ 5 min。随后,用PCR扩增试剂盒和特异性引物配制PCR反应体系,在cFX384 Touch实时PCR检测系统中对mRNA表达水平进行扩增量化,PCR扩增热循环条件为95 ℃ 1个循环10 min,然后再95 ℃ 40个循环15 s和60 ℃ 1 min。使用GAPDH或小分子U6作为内部控制。使用2-ΔΔCt法分析表达水平。lncRNA-MIAT的正向引物为5’-ACGGGGATAGAAGCTGTCCT-3’,反向引物为5’-CTAACGCCCTCTAGCTCCG-3’,大小436 bp;GAPDH 正向引物为 5’-GCAACTAGGATGGTGTGGCT-3’,反向引物为5’-TCCCATTCCCCAGCTCTCATA-3’,大小582 bp。miR-22的正向引物为5’-GGCAGAGGGCAACAGTTCTT-3’,反向引物为5’-GCTGAGCCGCAGTAGTTCTT-3’,大小84 bp;U6正向引物为5’-GCAGACCGTTCGTCAACCTA-3’,反向引物为5’-AATTCTGTTTGCGGTGCGTC-3’,大小149 bp。
1.2.4 细胞增殖活性检测分别使用0 μmol·L-1、25 μmol·L-1、50 μmol·L-1、75 μmol·L-1、100 μmol·L-1、150 μmol·L-1、200 μmol·L-1、300 μmol·L-1H2O2处理HLE-B3细胞构建H2O2诱导细胞模型,培养48 h后采用CCK-8法检测细胞存活率,以确定后续实验中最佳H2O2浓度。各组HLE-B3细胞按每孔103个接种于96 孔板上,分别于细胞转染后0 h、24 h、48 h、72 h、96 h 时加入10 μL CCK-8试剂,37 ℃孵育2 h后,于490 nm波长下测D值。
1.2.5 细胞凋亡情况检测取各组HLE-B3细胞(0.2×106个),1000 r·min-1离心5 min后再悬浮于100 μL结合缓冲液中。依次用5 μL Annexin V-FITC和10 μL PI孵育。流式细胞仪检测细胞凋亡。
1.2.6 氧化应激指标检测收集各组HLE-B3细胞(0.2×106个),用细胞裂解液裂解后取上清,按照试剂盒说明书检测MDA、SOD 和 GSH-Px的含量。用2’,7’-二氯荧光素二乙酸酯(DCFH-DA)探针检测HLE-B3细胞内源性ROS荧光强度。将各组HLE-B3细胞(5×103个·mL-1)接种于96孔板中,培养48 h后,加入10 μmol·L-1荧光探针DCFH-DA。在37 ℃培养箱中孵育20 min,洗涤后用流式细胞仪检测细胞的荧光强度值(MFI代表细胞内ROS的水平,激发波长488 nm,发射波长525 nm)。
1.2.7 双荧光素酶报告基因检测为了进一步研究lncRNA-MIAT的下游靶点和调控通路,利用靶区预测算法(LncBase Predicted v2.0和miRWalk 3.0)来预测lncRNA-MIAT与miRNA的相互作用。发现lncRNA-MIAT包含miR-22的潜在结合位点。为了进一步确定两个lncRNA的表达相关性,进行了荧光素酶报告分析。用PCR扩增lncRNA-MIAT的3’UTR片段。将PCR产物克隆至紧靠荧光素酶基因序列下游的psiCHECK-2载体中。构建含有miR-22突变种子序列的lncRNA-MIAT 3’UTR的psiCHECK-2。所有结构均经DNA测序验证。将HLE-B3细胞接种至96孔板中,然后与100 ng构建物共转染48 h,使用双荧光素酶报告系统检测荧光素酶活性。同样的方法验证miR-22与p38的靶向结合关系。
1.2.8 RNA结合蛋白免疫共沉淀实验RNA结合蛋白免疫共沉淀(RNA immunoprecipitation,RIP)实验使用美国Millipore公司的Magna RIPTMRNA结合蛋白IP试剂盒,分别在转染有野生型MS2-lncRNA-MIAT或突变型MS2-lncRNA-MIAT的HLE-B3细胞中加入裂解液(含有蛋白酶抑制剂和RNase抑制剂)进行裂解。磁珠与AgO2/IgG抗体在室温下孵育30~60 min。在4 ℃温度下用磁珠进行免疫沉淀过夜。从磁珠中洗脱RNA蛋白复合物。用RT-qPCR分析lncRNA-MIAT和miR-22的表达。
1.2.9 Western blot检测蛋白表达用RIPA裂解液裂解细胞并提取细胞总蛋白,按 BCA 试剂盒说明书进行蛋白定量。在100 g·L-1NuPAGE Bis-Tris预制凝胶中按每孔40 μg加入蛋白样品,进行电泳分离。然后将蛋白质转移到聚偏氟乙烯(PVDF)膜上。在室温下用50 g·L-1脱脂牛奶封闭1 h,然后用不同的一抗(Bcl-2、BAX、p-p38 MAPK、 p38 MAPK、JNK、p-JNK)在4 ℃孵育过夜。然后加入辣根过氧化物酶(HRP)结合的山羊抗兔IgG(H+L)二级抗体。电化学发光法(ECL)显影,对蛋白质条带进行半定量分析。
1.3 统计学分析采用 SPSS 19.0统计学软件处理数据,数据以均数±标准差表示,组间比较采用方差分析和t检验。检验水准:α=0.05。
2 结果
2.1 H2O2浓度的确定CCK-8检测结果显示,25 μmol·L-1、50 μmol·L-1、75 μmol·L-1、100 μmol·L-1、150 μmol·L-1、200 μmol·L-1、300 μmol·L-1H2O2处理HLE-B3细胞48 h后,细胞存活率分别为(92.39±2.18)%、(86.53±2.92)%、(75.41±5.84)%、(52.33±4.92)%、(29.78±3.81)%、(16.83±2.65)%、(15.74±2.20)%。因此,考虑选择100 μmol·L-1作为H2O2最佳作用浓度。
2.2 各组细胞lncRNA-MIAT和miR-22的相对表达量H2O2诱导对HLE-B3细胞lncRNA-MIAT和miR-22相对表达量的影响:与空白对照组(lncRNA-MIAT:1.00±0.08;miR-22:1.00±0.06)相比,H2O2组细胞lncRNA-MIAT相对表达量(1.58±0.09)升高,而miR-22相对表达量(0.81±0.07)降低,差异均有统计学意义(t=13.622、5.829,均为P<0.001)。 si-MIAT慢病毒转染效果验证:空白对照组、阴性对照组、si-MIAT M1组、si-MIAT M2组、si-MIAT M3组HLE-B3细胞lncRNA-MIAT相对表达量分别为1.00±0.08、0.98±0.10、0.67±0.06、0.61±0.05、0.40±0.05,各组整体比较差异有统计学意义(F=104.876,P<0.001);与空白对照组和阴性对照组相比,si-MIAT M1组、si-MIAT M2组、si-MIAT M3组细胞lncRNA-MIAT相对表达量均显著降低,其中si-MIAT M3组细胞lncRNA-MIAT相对表达量均低于si-MIAT M1组和si-MIAT M2组,差异均有统计学意义(均为P<0.05),因此,选择si-MIAT M3序列构建慢病毒转染质粒进行细胞转染,并用于后续实验。miR-22 inhibitor质粒转染效果验证:空白对照组、阴性对照组、si-MIAT组、si-MIAT+miR-22 inhibitor组细胞miR-22相对表达量分别为1.00±0.06、1.01±0.12、1.25±0.09、0.43±0.05,各组整体比较差异有统计学意义(F=114.583,P<0.001)。与空白对照组和阴性对照组相比,si-MIAT组细胞miR-22相对表达量显著升高,而与si-MIAT组相比,si-MIAT+miR-22 inhibitor组细胞miR-22相对表达量则明显降低,差异均有统计学意义(均为P<0.05)。
2.3 lncRNA-MIAT低表达对H2O2诱导的人晶状体上皮细胞存活影响CCK-8法和流式细胞术检测结果显示,各组细胞存活率和凋亡率整体比较,差异均有统计学意义(F=83.175、83.371,均为P<0.001);与空白对照组相比,H2O2组细胞存活率显著降低,细胞凋亡率显著增加;与H2O2组和阴性对照+H2O2组相比,si-MIAT+H2O2组细胞存活率均升高,细胞凋亡率均降低;而si-MIAT+miR-22 inhibitor+H2O2组细胞存活率则较si-MIAT+H2O2组显著降低,细胞凋亡率较si-MIAT+H2O2组显著增加;以上各组间比较,差异均有统计学意义(均为P<0.05)(见表1)。
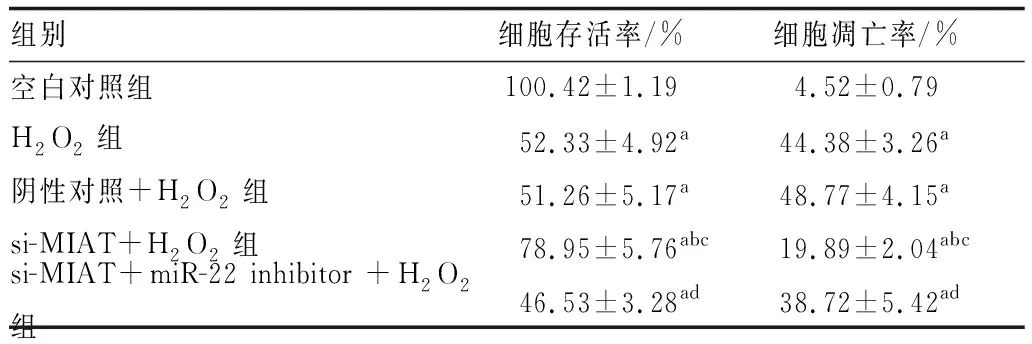
表1 CCK-8法和流式细胞术分别检测各组细胞增殖、凋亡情况
2.4 lncRNA-MIAT低表达对H2O2诱导的人晶状体上皮细胞氧化应激相关因子的影响各组细胞中MDA、ROS、SOD、GSH-Px含量整体比较,差异均有统计学意义(F=68.509、99.491、121.395、63.199,均为P<0.001)。与空白对照组相比,H2O2组细胞中MDA和ROS含量均显著升高,SOD、GSH-Px含量显著降低;与H2O2组相比,si-MIAT+H2O2组细胞中MDA和ROS含量显著降低,SOD、GSH-Px含量则显著升高;si-MIAT+miR-22 inhibitor+H2O2组细胞中MDA和ROS含量则较si-MIAT+H2O2组显著升高,SOD、GSH-Px含量则较si-MIAT+H2O2组显著降低;以上各组间比较,差异均有统计学意义(均为P<0.05)(见表2)。
2.5 lncRNA-MIAT对miR-22的海绵吸附作用
2.5.1 生物信息学预测双荧光素酶报告实验结果显示,miR-22的过度表达可显著降低HLE-B3细胞中psiCHECK-2-MIAT-3’UTR的荧光素酶活性(图1)。为了进一步研究lncRNA-MIAT作为miRNA海绵基因的作用机制,利用在线预测软件(TargetScan v7.2)对miR-22的潜在靶基因进行了分析发现,miR-22存在与p38 mRNA互补序列。通过荧光素酶报告基因分析,荧光素酶活性随着miR-22的过度表达而降低(图1)。
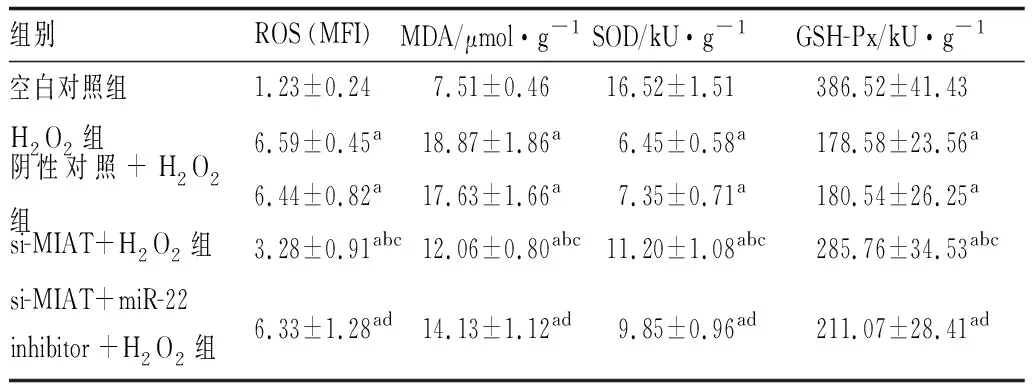
表2 lncRNA-MIAT低表达对H2O2诱导的人晶状体上皮细胞中ROS、MDA、SOD、GSH-Px含量的影响

图1 生物信息学预测HLE-B3细胞中lncRNA-MIAT/miR-22/p38 MAPK的靶向关系 A:lncRNA-MIAT和miR-22靶向结合的双荧光素酶报告实验;B:miR-22和p38α靶向结合的双荧光素酶报告实验。
2.5.2 RIP实验miRNAs以miRNA核糖核蛋白复合物(miRNPs)的形式存在,其中含有RNA诱导沉默复合物的核心成分AgO2。首先证实H2O2对AgO2蛋白表达没有影响(图2A),可以用AgO2抗体对HLE-B3细胞进行RIP实验。RIP实验检测结果表明,lncRNA-MIAT和miR-22相对于IgG免疫沉淀物优先富集在含有AgO2蛋白的miRNPs中(图2B)。此外,在基础条件和H2O2暴露条件下进行了RIP实验,lncRNA-MIAT在H2O2条件下能与AgO2结合更多(图2C)。
2.6 lncRNA-MIAT低表达抑制p38 MAPK途径的活化各组细胞BAX蛋白、Bcl-2蛋白、p-p38 MAPK/p38 MAPK比值、p-JNK/JNK比值整体比较,差异均有统计学意义(F=416.598、146.193、3497.353、163.989,均为P<0.05)。与空白对照组相比,H2O2组中BAX蛋白、p-p38 MAPK/p38 MAPK比值、p-JNK/JNK比值显著升高,Bcl-2蛋白表达降低;与H2O2组和阴性对照+H2O2组相比,si-MIAT+H2O2组BAX蛋白、p-p38 MAPK/p38 MAPK比值、p-JNK/JNK比值显著降低,Bcl-2蛋白表达则相应升高;与si-MIAT+H2O2组相比,si-MIAT+miR-22 inhibitor+H2O2组较BAX蛋白、p-p38 MAPK/p38 MAPK比值、p-JNK/JNK比值均升高,Bcl-2蛋白表达则相应降低;以上各组间比较,差异均有统计学意义(均为P<0.05)(见表3和图3)。

图2 RIP实验检测HLE-B3细胞中AgO2蛋白和IgG蛋白中lncRNA-MIAT和miR-22表达 A:空白对照组和H2O2组AgO2蛋白表达;B:RIP实验检测lncRNA-MIAT和miR-22表达结果;C:空白对照组和H2O2组RIP实验检测结果对比。
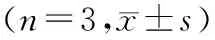
表3 Western blot检测各组细胞中Bcl-2蛋白、BAX蛋白、p-p38 MAPK/p38 MAPK比值、p-JNK/JNK比值差异

图3 lncRNA-MIAT低表达对凋亡相关蛋白和p38 MAPK途径相关蛋白表达的影响 A:空白对照组;B:H2O2组;C:阴性对照+H2O2组;D:si-MIAT+H2O2组;E:si-MIAT+miR-22 inhibitor+H2O2组。
3 讨论
以往的研究表明,氧化应激是导致晶状体上皮细胞凋亡的主要分子机制,被认为是非先天性白内障形成的起始因素[5]。本研究确定了lncRNA-MIAT在H2O2诱导HLE-B3细胞凋亡中的作用。经体外细胞实验结果表明,敲低lncRNA-MIAT基因表达后,能够通过抑制BAX蛋白表达,上调Bcl-2蛋白表达进而抑制HLE-B3细胞内源性凋亡途径,从而明显减轻H2O2诱导的细胞损伤。
白内障是50岁以上人群中常见的眼部疾病,以晶状体上皮细胞损伤引起的晶状体混浊为主要特征。深入了解白内障的发病机制并寻找有效的治疗靶点具有重要的意义。lncRNA-MIAT已被证明可以作为内源性竞争RNA与各种miRNA竞争性结合,从而抑制 miRNA对靶基因的调控[6]。Li等[7]研究证实,lncRNA-MIAT过表达可通过miR-211/GDNF轴减少Neuro2A细胞凋亡,减轻新生大鼠脑组织缺氧缺血性损伤。此外,lncRNA-MIAT属于miRNA海绵,Ye等[8]研究发现,lncRNA-MIAT可通过海绵miR-149-5p来积极调节抗吞噬分子CD47的表达,沉默lncRNA-MIAT表达,可延缓动脉粥样硬化的进展,减少易损斑块的大小和提高斑块的稳定性,并且促进巨噬细胞在体内外对凋亡细胞的清除。
然而,目前关于lncRNA-MIAT在眼科疾病尤其是白内障发生中的研究尚少。白内障的发病机制包含氧化损伤、细胞凋亡、免疫代谢损伤和晶状体蛋白变性等[9]。其中,晶状体上皮细胞的氧化损伤和细胞凋亡机制是这一领域的研究热点。晶状体上皮细胞的结构和功能对于维持晶状体的透明度至关重要,细胞凋亡是一个重要的病理生理过程,它导致细胞膜的破坏和染色体的凝聚。BAX和Bcl-2在细胞凋亡中起关键作用。本研究中,我们发现HLE-B3细胞经H2O2损伤后ROS含量显著上升,同时细胞凋亡率和BAX蛋白表达显著增加,Bcl-2蛋白表达降低,进而导致HLE-B3细胞存活率降低,说明H2O2可诱导晶状体上皮细胞损伤。汪静[10]研究表明晶状体上皮细胞的凋亡是白内障发生的病理基础。细胞在代谢过程中产生ROS导致氧化应激,进而对晶状体上皮细胞造成结构改变及凋亡等一系列损伤,最终导致白内障的发生。
此外,我们还发现,经H2O2诱导后HLE-B3细胞中lncRNA-MIAT相对表达量升高,说明lncRNA-MIAT在H2O2诱导晶状体上皮细胞氧化应激损伤过程中发挥着重要作用。而且我们通过稳定转染抑制了lncRNA-MIAT基因在HLE-B3细胞中的表达后,细胞凋亡率显著降低,同时增殖活性增强,说明敲低lncRNA-MIAT表达可以明显减轻H2O2诱导的HLE-B3细胞损伤。目前人们普遍认为,很多lncRNAs扮演着海绵miRNAs的角色,进一步从翻译抑制和(或)降解中释放miRNAs的下游靶标[11]。同样lncRNA-MIAT的ceRNA活性也可能使它能够吸收许多miRNAs,进而进一步作用于下游多个基因。Zhang等[12]研究发现,lncRNA-MIAT在体外可通过海绵 miR-128-3p上调VEGF表达进而促进骨肉瘤进展。Huang等[13]研究也发现,lncRNA-MIAT可以通过海绵miR-214促进肝癌细胞的增殖和侵袭,从而为肝癌的治疗和预后提供了新的靶点。本研究中,我们发现lncRNA-MIAT通过吸收miR-22激活p38 MAPK/JNK通路,进而影响H2O2诱导HLE-B3细胞凋亡和氧化应激过程。说明lncRNA-MIAT对H2O2诱导的HLE-B3细胞损伤的作用机制与对癌细胞的影响并不完全一致。lncRNA-MIAT对miR-22有一定的吸附作用,而miR-22则又是p38 MAKP信号通路的上游靶标。双荧光素酶报告实验也证实 miR-22同时与lncRNA-MIAT和p38ɑ结合,特别是敲低lncRNA-MIAT表达后可以挽救miR-22和p38ɑ之间的相互作用。所有的真核细胞都能表达MAPK,MAPK是信号从细胞表面转导到细胞核内部的重要传递者[14]。p38 MAPK是一个相对保守的丝氨酸/苏氨酸丝裂原活化蛋白激酶,在各种细胞外刺激下能够被激活,促使底物和腺嘌呤核苷三磷酸结合,从而参与炎症反应、细胞生长和分化、细胞周期和细胞死亡等众多生物学功能[15]。上述实验结果说明lncRNA-MIAT和p38ɑ与miR-22具有相同的miRNA反应元件,这可能是lncRNA-MIAT影响H2O2诱导HLE-B3细胞凋亡和氧化应激反应的重要机制。
综上,H2O2诱导HLE-B3细胞氧化应激损伤的同时也导致lncRNA-MIAT表达上调,lncRNA-MIAT可海绵吸附miR-22,因此,敲低lncRNA-MIAT表达后,通过上调miR-22表达进而抑制p38 MAPK/JNK通路活化,从而抑制H2O2诱导的晶状体上皮细胞凋亡。
