角膜缘松解切开术治疗白内障患者术后角膜散光
2021-04-29何涛艾明
何涛 艾明
白内障是我国最主要的致盲性眼病之一。白内障摘除联合人工晶状体植入术是白内障最主要的治疗方式。近年来,随着科技的进步和患者需求的提高,白内障手术已从单纯复明性手术转化为提高视觉质量的屈光性手术,提高晶状体测算准确度及术后视觉质量已成为关注的焦点。但在部分经济欠发达地区,复明性质的白内障手术仍占有一定比例。在复明性质的白内障手术中常使用聚甲基丙烯酸甲酯(PMMA)材质硬质人工晶状体,该人工晶状体的特点是不能折叠,需要约6.0 mm切口才能植入眼内[1]。
白内障手术会引起角膜散光,与切口长度、相对视轴的距离及切口形状有关。既往有研究显示,超过3.0 mm的白内障切口术后患眼散光可超过1.50 D,直接影响术后视觉质量[2-4],进而影响患者对手术的满意度[5]。有研究显示,超过0.30 D的散光将影响视敏度,超过0.50 D的散光应积极加以矫正[6]。因而,复明性质的白内障手术后散光矫正成为基层眼科医师所面临的一大问题。
角膜缘松解切开术(limbal relaxing incisions,LRIs)是一种矫正散光的手术,其手术原理是在角膜陡峭轴所在的角膜周围行对称的弧形切开,进而降低散光。LRIs已广泛应用于联合屈光及白内障手术的散光矫正中[7]。本研究将对复明性质的白内障术后伴有明显角膜散光者行LRIs,依照患者LRIs术前角膜散光大小分成2组,对比术后疗效,现将结果报告如下。
1 资料与方法
1.1 一般资料本研究是按照知情同意条例和《赫尔辛基宣言》的原则进行的前瞻性队列研究。本研究获得康泽眼科医院集团医学伦理委员会批准,研究纳入2018年1月至2020年11月于京山康泽眼科医院及沙洋康泽眼科医院随访的复明性质的白内障术后患者。纳入标准:既往行6.0 mm切口白内障手术,术后时间≥3个月,综合验光及角膜地形图证实存在需要矫正的角膜散光(顺规散光及斜规散光>0.50 D,逆规散光>0.90 D),且有意愿进行视力增效手术者。将角膜散光≤1.50 D设定为A组,角膜散光>1.50 D设定为B组。
排除标准:合并角膜外伤、瘢痕等致角膜形态异常者;既往白内障手术出现术中及术后并发症者,如出现角膜后弹力层脱离、晶状体前囊撕裂、人工晶状体脱位、囊袋收缩综合征、后囊破裂或后发性白内障等;合并青光眼;合并严重玻璃体混浊或影响视力的眼底疾病者;其他眼表及系统疾病不适宜进行常规眼科手术者。
1.2 手术方法及围术期管理所有患眼均行LRIs治疗。记录患者年龄、散光陡峭轴曲率(K2)及所在径线方位、散光平坦轴曲率(K1)、角膜10 mm环周位置最薄点厚度,输入LRIs在线计算网站(https://www.lricalculator.com/,美国强生视觉公司),选择NAPA模式(NAPA Nomogram),使用网站程序计算手术切割位置、切割深度及长度。
所有手术均由同一位经验丰富的医师完成。术前常规5 g·L-1左氧氟沙星眼液滴眼,每天4次,连续3 d。手术步骤:常规消毒铺巾,妥布霉素溶液(40 mg5 mL)冲洗结膜囊,4 g·L-1盐酸奥布卡因滴眼液表面麻醉2~3次;使用医用记号笔及角膜散光定位环定位并标记切割位置及长度,使用LRIs矫正散光用定深刀(AE-8194,瑞士ASICO公司)调整切割深度(切割圆周最薄厚度的90%),深度调整完成后,完成散光切开;无菌生理盐水冲洗,确认切口层间无异物残留,结膜囊内注入妥布霉素地塞米松眼膏,无菌敷料包眼,结束手术。术后使用5 g·L-1左氧氟沙星眼液滴眼,每天4次,共用1周;3 g·L-1玻璃酸钠眼液滴眼,每天4次,共用1个月。
1.3 检查项目术前常规测量裸眼远视力(uncorrected distance visual acuity,UDVA)、眼压,裂隙灯显微镜观察眼前节、散瞳检查晶状体前囊及后囊情况、90 D间接检眼镜检查眼底;UDVA使用Snellen视力表记录,综合验光仪检查矫正远视力(corrected distance visual acuity,CDVA),UDVA和CDVA均换算为logMAR视力进行分析;应用A超角膜测厚仪(AL-3000,日本Tomey公司)测量最薄点角膜厚度及8~10 mm周边角膜厚度;角膜地形图仪(TMS-4N,日本Tomey公司)测量角膜地形图,其中角膜地形图所测得的K1、K2及散光轴位需经人工晶状体生物测量仪(IOL Master500,德国Zeiss公司)复测核验。
术后1 d、1周、2周、1个月完成裂隙灯显微镜观察及荧光素染色等检查,判断角膜切口愈合情况、炎症反应及其他术后早期并发症。术后3个月、6个月随访增加检查UDVA、综合验光、角膜地形图及主观满意度问卷调查。其中,主观满意度问卷调查设计为10分制,按照分值归类为满意(评分≥8分)、尚可(评分5~8分)、不满意(评分<5分),并按反馈性意见归类分析。
散光采用Alpins散光矢量分析法进行分析[8],分别获得目标诱导散光向量(target induced astigmatism vector, TIA;本研究中等于术前角膜散光度)和手术诱导散光向量(surgically induced astigmatism vector, SIA),同时计算以下指标:差异向量(difference vector,DV),即TIA与SIA的差异,因为目标散光值通常为0,所以DV大小等于术后角膜散光大小;矫正指数,即SIA与TIA的比值,>1为过矫,<1为欠矫;错位角α,即SIA与TIA之间的轴向差异,规定逆时针为正,顺时针为负;变平指数,即SIA在TIA轴向上所引起的散光减少量与TIA的比值,计算公式为:变平指数=(SIA×cosα)/TIA,理想值为1;成功指数,即DV与TIA的比值,理想值为0;成功率即为1-成功指数。
1.4 统计学方法采用Graphpad prism 8.30进行数据分析。患者手术前后的计量资料用均数±标准差表示。使用Kolmogorov-Smirnov检验分析其是否符合正态分布,符合正态分布者,组内数据比较采用配对t检验,组间比较使用非配对t检验;等级资料及不符合正态分布数据的组间比较采用Mann WhitneyU检验;对完成连续随访至术后6个月的患者资料,采用配对重复测量方差分析,同时各时间点之间两两比较采用Dunns多重比较检验。检验水准:α=0.05。
2 结果
2.1 患者基线资料本研究共纳入61例患者的71眼,完成3个月及以上有效随访者49眼(40例),有效随访率69.01%,完成6个月及以上有效随访者21眼。本研究即基于对40例患者49眼的数据进行分析。40例患者年龄为(58.02±5.82)岁;49眼白内障术后时间为(5.51±1.99)个月,眼压为(14.83±2.25)mmHg(1 kPa=7.5 mmHg),最薄点角膜厚度为(512.30±18.33)μm ,UDVA为(0.47±0.24) logMAR,CDVA为(0.17±0.16)logMAR,K1为(42.29±0.79)D,K2为(43.89±0.91)D,LRIs术前角膜散光度为(1.61±0.37)D,散光轴位为41.94°±16.84°。因3例患者双眼分别属于不同组,故40例49眼中,A组18例(20眼),B组25例(29眼)。A、B两组患者年龄分别为(57.45±6.38)岁和(58.41±5.49)岁,两组患者年龄相比差异无统计学意义(P=0.57)。A组和B组患眼术前基线资料见表1。由表1知,A组与B组间K2及角膜散光度相比差异均有统计学意义(均为P<0.01),两组间白内障术后时间、眼压、最薄点角膜厚度、UDVA、CDVA、K1和散光轴位相比,差异均无统计学意义(均为P>0.05)。
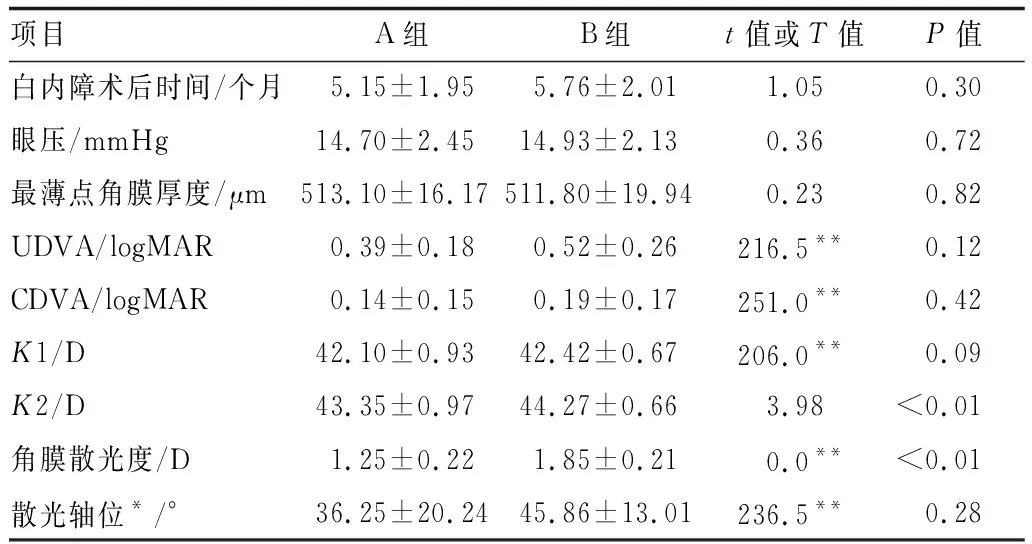
表1 A组和B组患眼术前基线资料
2.2 有效性A组、B组患眼术后3个月UDVA分别为(0.28±0.09)logMAR、(0.32±0.08)logMAR,均显著优于术前,差异均有统计学意义(均为P<0.01)。
A组患眼术后3个月CDVA 为(0.13±0.13)logMAR,与术前相比差异无统计学意义(P=0.50);B组患眼术后3个月CDVA为(0.12±0.11)logMAR,与术前相比差异有统计学意义(P<0.01)。两组患眼间UDVA变化值(术后-术前)比较差异无统计学意义(P=0.19),两组患眼间CDVA变化值(术后-术前)比较差异有统计学意义(P=0.03)。
2.3 可预测性术前49眼角膜散光的预期矫正目标值均为0 D。术后3个月,49眼的TIA为0.9~2.5(1.61±0.37)D, SIA为0.5~3.0(1.46±0.55)D, DV为(-0.15±0.45)D,矫正指数为0.91±0.29,错位角α为3.57°±12.46°,变平指数为 0.89±0.29,成功指数为0.28±0.09,成功率约为72%。A组、B组患眼术后3个月Alpins散光矢量分析结果见表2。由表2知,术后3个月,两组患眼间TIA、SIA差异均具有统计学意义(均为P<0.05),两组患眼间DV、矫正指数、错位角α、变平指数、成功指数相比,差异均无统计学意义(均为P>0.05)。
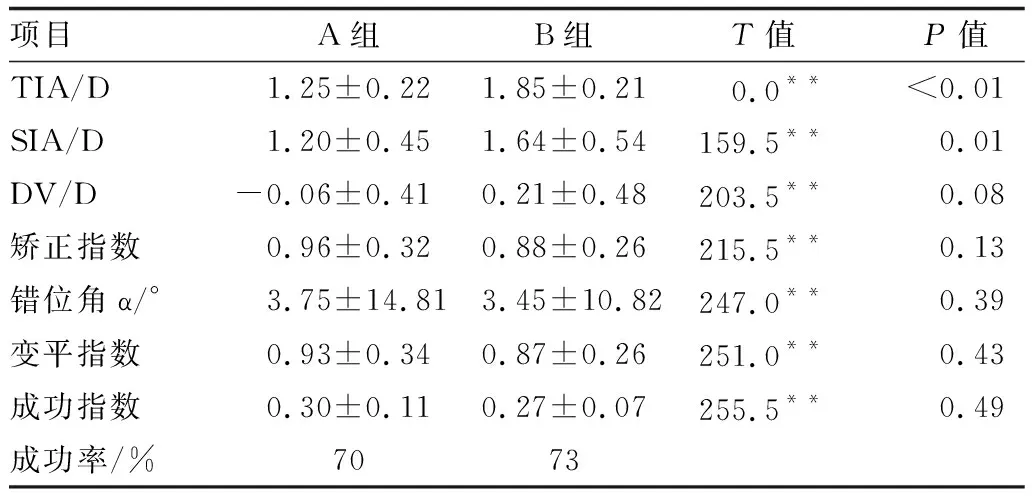
表2 A组和B组患眼术后3个月Alpins散光矢量分析结果
2.4 稳定性共21眼完成超过6个月随访,21眼术前角膜散光度为(1.56±0.36)D,术后3个月为(0.44±0.15)D,术后6个月为(0.40±0.16)D。重复测量方差分析结果显示,组内差异有统计学意义(F=34.38,P<0.01);两两比较结果显示,术前与术后3个月、6个月患眼角膜散光度相比差异均有统计学意义(均为P<0.01),术后3个月与术后6个月患眼角膜散光度相比差异无统计学意义(P>0.05)。可见,LRIs术后3个月角膜散光度已趋于稳定。
2.5 安全性及并发症所有患眼术中均未出现切口穿透、切口实际轨迹与设计明显偏离(主要包括切口角度偏离和长度扩大)等并发症,术后切口闭合良好,随访期内未出现切口破裂、切口感染、继发性角膜扩张等安全性并发症,10眼术后随访期内有干眼症状,其中主诉异物感5眼,干涩感5眼,所有患眼均将继续观察手术的长期安全性及并发症。
2.6 患者术后主观满意度问卷调查患者主观满意度调查结果显示,术后3个月患者满意度评分为(5.35±3.59)分,其中,满意者20眼(40.82%),平均9.05分;尚可者19眼(38.77%),平均5.68分;不满意者10眼(20.41%),平均1.70分。未达到满意的29眼(59.18%)原因(可有多重原因)为:费用高(17眼)、视力提升未达预期(22眼)、术后眼部异物感(5眼)和干涩感(5眼)。
3 讨论
白内障手术对散光的控制主要通过减少角膜原有散光和避免术源性散光实现。但在部分基层医院,由于条件有限,散光管理在白内障围术期并未得到重视,白内障术后散光问题在一定时期内仍将继续存在。本研究纳入的6.0 mm切口复明性质的白内障患者术后,LRIs术前角膜散光度为(1.61±0.37)D。由此可见,白内障术后可产生角膜散光,围术期应重视散光管理,尽量在1期手术时控制散光度大小,此外,还应当对部分术后散光进行积极矫正[1]。
LRIs是一种成熟的矫正散光的手术方式,主要依靠约90%切割深度的对称松解切口降低散光,依靠切口长度、与光学区的距离来调整手术矫正量[9-10]。依据手术方式不同分为手工LRIs和飞秒辅助LRIs,目前主要应用于联合白内障手术的散光矫正中。在Roberts等[11]的白内障手术联合手工LRIs的观察中,术前TIA为1.38 D,SIA为1.23 D,20%患者经LRIs后散光可降至0.50 D以下。一项比较Toric人工晶状体与LRIs在白内障手术中矫正散光的研究显示,LRIs显示出与Toric人工晶状体相近的有效降低散光的效力[7]。除辅助白内障手术外,LRIs在联合有晶状体眼后房型人工晶状体植入术中也展示了优异的效果。Li等[12]研究显示,在有晶状体眼后房型人工晶状体植入术中联合手工LRIs,术后TIA为(1.48±0.35)D,SIA为(1.11±0.35)D。单纯矫正散光的LRIs目前少见报道。在本研究中,单纯LRIs显示出良好的散光矫正效果,49眼术后TIA为(1.61±0.37)D,SIA为(1.46±0.55)D;在不同角膜散光分组中均达到了相似的散光矫正效果及UDVA的提升效果;相较于A组,B组患眼术后3个月CDVA改善更明显,且组间差异具有统计学意义,主要与B组散光改善量较大有关。
尽管尚未见关于比较LRIs与其他散光矫正手术的投入产出效益的相关研究,但在临床中,手工LRIs具有明显的经济优越性。手工LRIs可达到与飞秒辅助LRIs散光性角膜切开术或准分子激光治疗性角膜切削术(PRK)相近的矫正效果[11],且手工LRIs对手术器械和经济支出要求均不高。在本研究中,所有患者总花费均低于2000元,占飞秒辅助LRIs散光性角膜切开术或PRK花费的1/5~1/4。相比之下,手工LRIs具有明显较高的成本效益价值。
LRIs的术中及术后短期安全性相关并发症主要包括切口穿透、切口形态欠佳、术后早期切口感染等[13-14]。本研究随访期内均未发现此类并发症。既往有研究报道显示,LRIs术后长期安全性好,未见明显并发症发生[15],但据理论推测,LRIs术后长期并发症主要为干眼及角膜扩张。术后干眼主要是由手术因素造成眼部应激状态引起的,主要与睑板腺及眼睑炎症有关,多数后期能自行恢复[16]。本研究中10眼术后有干眼相关症状,目前正在积极进行药物治疗并继续观察中。对角膜的切割可能造成角膜生物力学改变引发角膜扩张,本研究随访期内未发现角膜扩张患眼,手术长期安全性目前仍在监测中。
本研究尚存不足之处。本研究缺乏视觉质量相关检查,尽管患眼术后散光度明显下降,但未能提高所有患眼的UDVA,部分患者诉术后视力改善未达预期,可能和未矫正的高阶像差有关。白内障切口除引起散光外,还将引入高阶像差,如彗差及三叶草差等,高阶像差将明显影响视觉质量及患者满意度[17]。其发生机制为:白内障主切口可引起其单侧角膜对应区域曲率下降,因而可产生明显的彗差及三叶草差,这些高阶像差的引入主要和单侧切口及切口过大有关[18-21]。由于本研究纳入的患者均为既往行6.0 mm单侧主切口治疗白内障者,未做对侧切口处理,而LRIs不能改善高阶像差,因而可能未能达到显著的视力提升效果,进而影响患者对手术的整体满意度。
综上所述,LRIs降低白内障患者术后角膜散光效果显著,并发症发生率低且安全可控,对不同散光度的患者具有相似的矫正效果,但仍需要更长时间的随访及更多的检测手段以确定其实际临床价值。
