玉米赤霉烯酮内酯水解酶的鉴定、改造及应用
2021-04-27张振霞徐炜吴昊张文立光翠娥沐万孟
张振霞,徐炜,吴昊,张文立,光翠娥,沐万孟
(食品科学与技术国家重点实验室(江南大学),江苏 无锡,214122)
玉米赤霉烯酮(zearalenone,ZEN),又被称为F-2毒素,是一种非甾体雌激素类霉菌毒素,主要由粉红镰刀菌(Fusariumroseum)、禾谷镰刀菌(Fusariumgraminearum)、三线镰刀菌(Fusariumtricinctum)等镰刀菌属微生物在其次级代谢过程中产生[1]。研究表明,ZEN具有一个二羟基苯甲酸内酯结构,并且根据其内酯环结构中C-1和C-6处的官能团的不同,ZEN还具有5种结构衍生物:α/β-玉米赤霉烯醇(α/β-zearalenol, α/β-ZOL),α/β-玉米赤霉醇(α/β-zearalanol, α/β-ZAL)和玉米赤霉酮(zearalanone, ZAN),这些衍生物可由ZEN经代谢转化产生也可在自然界中直接产生,其中α-ZOL和α-ZAL具有比ZEN更高的毒性[2]。ZEN主要存在于发霉的玉米、小麦、大麦等谷物及其副产物中,是世界污染范围内最广泛的一种霉菌毒素[3],其具有和β-雌激素类似的酚二羟基内酯结构,因此进入人和动物体后可竞争性的与机体内的雌激素受体结合,从而引发一系列的生殖毒性[4]、基因毒性[5]、致癌毒性[5]和免疫毒性[6]。
鉴于ZEN污染造成的巨大的经济损失和健康隐患,ZEN的快速有效的脱毒方法受到越来越广泛的关注和研究。目前,ZEN的脱毒方法整体上可分为物理法、化学法和生物法3大类。而物理法和化学法往往存在脱毒不完全,造成某些小分子营养物质丢失,产生二次污染物和脱毒效率低等缺陷[2, 7-10]。生物酶法脱毒因具有反应过程不可逆、反应条件温和、无二级污染物产生、价格低廉等诸多优势,逐渐成为研究的热点。目前报道的具有降解ZEN能力的生物酶主要有3种:过氧化物酶、漆酶和内酯水解酶。其中,过氧化物酶可氧化断裂ZEN分子中的二酚羟基苯环结构实现脱毒效果。该酶目前已经在大肠杆菌、毕赤酵母和酿酒酵母中成功表达,但过氧化物酶降解ZEN的机理目前仍不明确,且脱毒过程需要过氧化氢的参与[11-13]。漆酶是一种多铜酶,可氧化ZEN分子中的双酚结构实现脱毒,但主要用于降解黄曲霉毒素,对ZEN显示了一个较低的活力[14-15]。相比之下,内酯水解酶具有脱毒机理明确,降解活力较高,反应无需介质等优势,展示了较好的应用前景。本文综述了近些年用于ZEN脱毒的内酯水解酶的性质鉴定、分子改造和应用方面的研究进展,以期为未来ZEN生物脱毒的应用研究提供参考。
1 内酯水解酶的性质鉴定
2002年,TAKAHASHI-ANDO等[16]将来自粉红粘帚菌(ClonostachysroseaIFO 7063)的内酯水解酶编码基因ZHD101克隆并成功在大肠杆菌中表达,首次报道了内酯水解酶ZHD101催化ZEN降解脱毒的机理(图1),发现内酯水解酶首先催化ZEN分子中的内酯键断裂,打开环状结构,然后自发脱羧形成完全无毒的降解产物,并释放一分子二氧化碳。此后,ZHD101在ZEN脱毒领域受到广泛关注,并且成功在大肠杆菌[16]、毕赤酵母[17]、酿酒酵母[18]和罗伊氏乳杆菌[19]等多种宿主中实现异源表达。此外,为了更好地满足工业应用的要求,一些其他微生物来源的内酯水解酶如:来源于Phialophoraamericana的ZHD607[17],Neurosporacrassa的ZENC[20],Rhinoccladiellamackenziei的zhd518[21],Cladophialophorabantiana的CbZHD[22]以及Gliocladiumroseum的ZENG也逐渐被挖掘和研究(表1)。
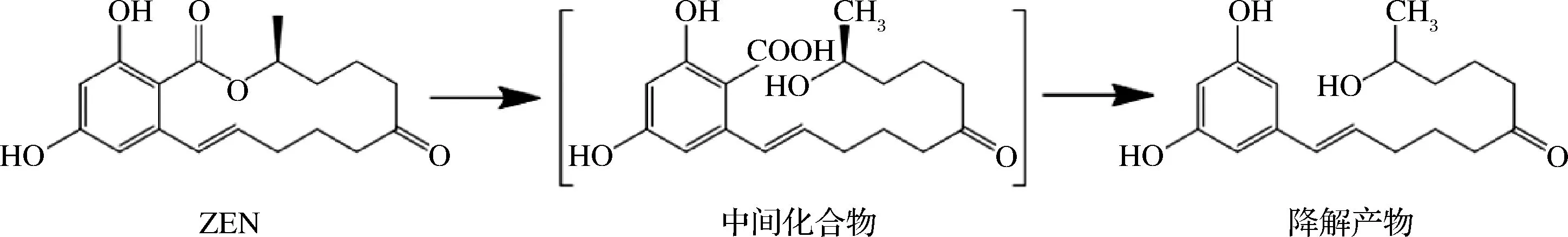
图1 内脂水解酶降解玉米赤酶烯酮的反应示意图Fig.1 Reaction mechanism of ZEN degrading by lactonase

表1 不同微生物来源的ZEN内酯水解酶性质的比较Table 1 Comparison of properties of ZEN-degrading lactonase from different microorganisms
1.1 pH对内酯水解酶的活力影响
考虑到工业应用的要求,饲用酶大多被期望具有一个中性或偏酸性的最适pH,并能够在酸性条件下保持较高的酶活力,以耐受动物体胃肠消化道中酸性环境的影响。然而,目前已报道的内酯水解酶在降解ZEN时普遍具有一个偏碱性的最适pH(8~10),且在偏酸性甚至中性条件下酶活力显著下降(如表1所示),这对于内酯水解酶的工业应用造成了极大的限制。
最早鉴定的来自粉红粘帚菌(ClonostachysroseaIFO 7063)的ZHD101最适pH为9~10,当pH下降为5.5时,残余酶活力仅为34%[18];来自R.mackenziei的RmZHD的最适pH为8.6,在pH 7.0时残余酶活力仅剩50%左右[24],这对其工业应用造成了极大的限制。值得注意的是,随着基因挖掘的深入,一些耐酸性更强的内酯水解酶也逐渐被发现和研究。如来自C.bantiana的CbZHD[22]、P.americana的ZHD607[17]以及R.mackenziei的zhd518[21]均在pH 8.0条件下展现最高酶活力,且在中性条件下的残余酶活力均在75%左右;来源于G.roseum的ZENG的最适pH为7.0,这是目前鉴定的唯一一个在中性条件下表现最高酶活力的内酯水解酶,但其在pH 6.0的条件下,残余酶活力也仅为50%左右[27]。尽管一些内酯水解酶已经被报道可在中性和弱酸性条件下保持较高酶活力,其仍然无法很好地耐受动物体胃肠消化液的复杂酸性环境。因此,在未来,继续挖掘寻找新型内酯水解酶,通过分子改造或酶固定化等手段提高酶的耐酸性将是下一阶段研究的重点。
1.2 温度对内酯水解酶的活力影响
工业酶的热稳定性是影响酶应用的重要性质之一。在工业应用中,酶的热稳定性高低会直接影响工业生产中酶的用量、酶的催化效率以及酶催化产品被微生物污染的概率[28]。此外,酶是一种生物敏感的物质,但其在饲料工业加工过程中往往需要经受高温、高压的造粒工艺等过程,严重影响酶的活性和稳定性。因此,较高的耐热性对内酯水解酶的工业应用至关重要。
目前所鉴定的内酯水解酶几乎都展示了一个较低的最适反应温度(35~45 ℃)和较弱的热稳定性(温度高于50 ℃时,酶活性会骤降甚至完全失活)。例如:最早鉴定的内酯水解酶ZHD101的最适温度仅为37~45 ℃,并且其在50 ℃保温仅6 min后,便完全失活[24]。WANG等[21]发现zhd518的最适温度为40 ℃,热稳定性相比ZHD101略有提高,但该酶在50 ℃保温10 min后的残余酶活力也仅剩10%左右。BI等[20]发现来自N.crassa的ZENC在55 ℃保温1 min后可保持较高的酶活力(90%左右),而当实验温度提高至60 ℃后ZENC会迅速失活。来自R.mackenziei的RmZHD在45 ℃展示了一个最高的酶活力,在50 ℃和55 ℃下保温10 min,6 min后仍分别具有80%和40%左右的残余酶活力,是目前报道的热稳定性最优越的内酯水解酶[24],但仍然无法满足工业造粒70 ℃左右的高温条件。可见,目前降解ZEN的内酯水解酶的最适温度以及热稳定性仍是限制其工业生产和应用的重要因素之一。
1.3 底物特异性
众所周知,ZEN在自然界具有5种结构衍生物(α/β-ZOL,α/β-ZAL,ZAN),这些衍生物既可由ZEN代谢转化而来也可在自然界中直接产生,研究发现尽管ZEN在发霉谷物中的含量最高,其衍生物α-ZOL和α-ZAL却具有比ZEN更高的毒性[29]。并且在发霉谷物中,ZEN及其衍生物往往复合存在。因此,具有一个较宽的底物谱对于实现内酯水解酶的工业应用至关重要。然而,研究发现,大部分内酯水解酶在降解ZEN时,展示了一个较强的底物特异性和较窄的底物谱,同等条件下其对毒性更高的α-ZOL的降解活力通常仅为其对ZEN降解活力的40%左右[30]。2016年,XU等[29]解析了ZHD101的晶体结构,并从从结构入手,发现相对于ZEN,α-ZOL的C6’位基团由酮基变为羟基,提高了内酯环结构的灵活性,使得底物空间位阻增大,从而导致内酯水解酶催化三联体的空间构型改变,酶活力降低。这为改变内酯水解酶的底物特异性,拓宽底物谱提供了很好的研究基础。在未来,蛋白质工程和分子改造手段,将成为拓宽内酯水解酶的底物谱,提高其工业实用性非常具有潜力的方法。
2 内酯水解酶的分子改造
尽管目前已经有大量可降解ZEN的内酯水解酶被挖掘、鉴定和研究,但它在底物特异性、热稳定性、耐酸性方面仍然无法满足工业应用的要求。鉴于此,基于内酯水解酶的氨基酸序列和晶体结构,采用蛋白质工程手段,改变其底物特异性,提高耐酸耐高温能力,逐渐吸引了越来越多研究者的注意。
2.1 内脂水解酶的晶体结构物特异性
2002年TAKAHASHI-ANDO等[16]提出内酯水解酶ZHD属于α/β水解酶。2012年PENG等[31]首次阐明了ZHD的晶体结构(如图2),发现ZHD为同源二聚体,且单体间不存在二硫键。ZHD由催化中心域和帽子域两部分组成,其中催化中心域的中央是8个平行链组成的β折叠(β1-β8),侧面环绕着7个α螺旋(α1-α4和α9-α11);帽子域位于β-折叠的C端边缘上,由4个α螺旋(α5-α8)组成,其中长而弯曲的α8螺旋,跨过了β-折叠顶部的催化中心域。ZHD的催化三联体为S102-H242-E126,并且H242与S102,E126间均以氢键连接。底物结合口袋位于中心域和帽子域深处,比邻催化三联体的位置,可与底物ZEN产生互补性的牢固结合。这种互补性的底物结合口袋,也表明内酯酶ZHD在降解ZEN时具有较高的特异性[29]。随后,来自C.batiana的CbZHD[22]和来自R.mackenziei的RmZHD[30]的晶体结构也逐渐被解析和报道,并且两者的晶体结构均和ZHD保持较高的相似性。
2.2 拓宽底物谱
研究表明发霉的谷物中除了含有大量ZEN,往往还含有比ZEN毒性更高的衍生物,如α-ZOL和α-ZAL。而目前报道的内酯水解酶都展现了一个较强的底物特异性,其降解α-ZOL的活力通常仅为其降解ZEN活力的40%左右,这极大地限制了其在工业生产中的应用。随着ZHD晶体结构的阐明,通过分子改造拓宽内酯水解酶的底物谱吸引了广泛的注意。随后,XU等[29]解析了ZHD101分别与底物ZEN和α-ZOL的复合晶体结构(PDB登录号:3 WZL和3 WZM),发现与ZEN相比,α-ZOL的内酯环位置更向催化中心域偏移,内酯环可通过疏水相互作用对亲水性的H242侧链咪唑产生排斥力将H242推远,破坏催化三联体结构,使得内酯水解酶对α-ZOL的降解活力降低,随后通过饱和突变,成功地获得了一个突变体V153H,该突变体对α-ZOL的降解活性提高了3.7倍,且其对ZEN的降解活力基本保持不变。在此基础上,ZHENG等[30]报道了RmZHD及其与不同底物复合的晶体结构(PDB,5XO7和5XO8),并采用相似的方法,利用突变体与α-ZOL内酯环间形成的氢键,将底物向外拉出,使催化三联体构象恢复,获得了突变体Y160H,使得RmZHD对α-ZOL的降解活性提高了70%左右;之后,WANG等[21]通过将zhd518与ZHD101进行序列比对和结构分析,获得突变体N156H,将zhd518对α-ZOL的降解活力提高了3.3倍。可以发现,尽管目前在改变内酯水解酶底物特异性,拓宽底物谱方面已经做了一些研究,但研究方法较为单一类似。未来,依托生物信息学通过理性设计进一步改变活性口袋大小或改变活性口袋微环境,实现酶底物特异性的精准调控,甚至通过“关键氨基酸”突变实现一酶多用将是研究的重点。

图2 ZHD101的三维空间结构及部分区域的点突变研究Fig.2 Crystal structure of lactonase from ZHD101 and relevant mutagenesis studies
2.3 增强热稳定性
目前,已鉴定的内酯水解酶,如Zhd101[16]、Zhd518[21]、ZEN-jjm[26]、Zlhy-6[25]、ZENC[27]、Rmzhd[24]和Cbzhd[22],普遍具有一个较差的热稳定性,在温度高于50 ℃条件下孵育几分钟酶活力便大幅降低甚至完全失活,远远无法满足饲料生产造粒过程中的温度要求。因此,通过分子结构改造提高酶的热稳定性十分必要。许中霞等[32]为了提高ZHD101的热稳定性,通过半理性设计和分子改造在其分子中温度因子B-factor较高,柔性变化较大的区域分别引入了7对二硫键,发现突变体D143C/P181C在50 ℃加热处理2 min后的残余活性是野生型的2倍,且室温下酶活力损失小于10%,结构分析显示突变体D143C/P181C对稳定螺旋α1、α2、α3和酶活力关键氨基酸W183的位置,减少摆动,起重要的作用。ZHANG等[27]通过以结构为基础的序列分析,在ZENG的帽子域和核心催化域间的Loop环上,获得了3个突变体H134F/S136F,H134I/S136I和H134L/S136L,其中H134L/S136L在53 ℃保温5 min后的残余酶活力比野生型提高40%左右,且室温下突变体酶活力损失较小。以上研究基于晶体结构和序列信息为内酯水解酶的热稳定性改造提供了一定的思路。目前随着新型研究技术和策略的快速发展,研究者也应瞄准生物信息学,数据库和计算模拟等新技术(如:Rosetta,RMSF,FireProt等),以期获得热稳定性更优越的突变体,更好服务内酯水解酶的工业应用。
3 内酯水解酶的应用研究
ZEN广泛存在于发霉的玉米,大麦,小麦等谷物及其副产物中,是公认的世界污染范围内最严重的的霉菌毒素之一。近年来,研究者们在利用微生物所产游离酶直接脱毒,固定化酶提高脱毒稳定性以及构造转基因植物从源头预防ZEN的产生等方面进行了一定的探索与研究(图3)。

图3 ZEN降解酶的应用流程Fig.3 Industrial application of ZEN lactonase in different processes
3.1 微生物产酶直接用于发霉谷物中ZEN的降解
作为饲用酶,内酯水解酶不仅要在实验室单一反应体系中还要在发霉饲料、谷物等复杂反应体系中,以及动物胃肠道中实现较好的脱毒效果,才能满足工业应用要求。为了脱除啤酒中的ZEN,XIANG等[23]将重组酶ZHD用于麦芽汁的脱毒,发现在麦芽汁发酵前添加ZHD,可以在12 min内脱除90%的ZEN,而在麦芽汁发酵过程中由于酿酒酵母的存在和发酵温度条件的变化,ZHD的脱毒效果大大降低。王壬丰等[33]将ZHD101在食品级宿主马克斯克鲁维酵母发酵,并将发酵液直接用于霉变玉米脱毒,反应12 h后,ZEN基本完全消失。BI等[20]将ZENG发酵粗酶液直接用于被ZEN污染的酒糟可溶物(DDGS),玉米副产物和玉米糠的脱毒,结果发现:充分反应24 h后DDGS的脱毒率可达到71%;相同条件下充分反应48 h后,玉米副产物中ZEN的降解率达到了89%;而对于玉米糠,反应仅3 h,ZEN降解率即可达到88%,反应6 h降解率可达到94.7%。可见,尽管游离酶可以直接用于ZEN脱毒,但其活性仍受到发酵,反应体系和物料种类等因素的制约。2010年,诺唯赞公司对来自Streptomycescoelicolor的漆酶进行了专利申请,并已实现商业化酶制剂生产。该酶主要用于降解黄曲霉毒素,对ZEN也显示出一定的降解活力,但目前专门针对ZEN降解的内酯水解酶的商业化酶制剂还未见推出。
3.2 利用固定化技术提高酶的稳定性
生物酶在胞外储存的不稳定性和对环境较差的耐受性极大的限制了其在工业的应用。而固定化酶相比于游离酶具有更高的利用率,更好的稳定性以及对环境的耐受性,在一定程度上克服了这些限制。同一种酶的固定化效果根据固定化方法和载体的选择的不同也会有所差异。HE等[34]以稻壳为载体对来自AspergillusnigerFS10的ZEN降解酶ZDE进行固定化,发现在90 ℃条件下,固定化酶相比于游离酶仍能保持70%的残余酶活力,在4和25 ℃条件下保存1个月后,固定化酶的活性仍能分别保持在90%和70%左右,并且,其在人工猪胃肠消化液中的模拟实验中也展现了较好的脱毒效果。王浩宇等[35]采用乳化凝胶化法对ZEN降解酶ZLHY6进行微胶囊包埋处理,包埋后的ZLHY6的最适温度和pH范围都略有提高,且在50 ℃条件下保温4 h,酶活力基本没有变化,猪胃肠液的体外模拟实验显示,该包埋酶在4 h胃液消化和2.5 h肠液消化后,仍具有61%的残余酶活力。通过不断优化固定化方法和载体的选择,固定化技术在提高游离内酯水解酶的耐热性和耐酸性等方面显示出来很好的应用前景。
3.3 利用转基因植物预防ZEN的产生
1999年,利用转基因植物灭活霉菌毒素的策略首次被提出。2004年,TAKAHASHI-ANDO等[18]首次将绿色荧光蛋白(EGFP)与ZHD101融合得到egfp-zhd101,并用荧光强度表征酶量,为探求经济有效降解ZEN的方法,其将融合蛋白转入水稻叶子中,发现即使在较低的pH下,水稻悬浮细胞仍表现出对ZEN较高的降解能力。近年来,愈来愈多的研究者们关注到ZEN对于植物中的危害以及寻求更加新型高效的降解方式[36-37]。如HIGA-NISHIYAMA等[38]评估了该水稻模型子代对真菌毒素进行脱毒的可行性,发现一代叶子中提取的粗酶液和二代水稻种子均具有显著的ZEN降解能力。之后,IGAWA等[39]将融合蛋白egfp-zhd101转入玉米中,构建转基因玉米脱毒模型,发现玉米种子在不同的生长阶段、储存环境、水分活度和温度条件下,对ZEN的脱毒活性几乎不变,且种子通过在28 ℃的ZEN溶液中浸泡48 h后的霉菌毒素总量不到野生型的10%。尽管转基因植物均显示出较好的ZEN脱毒效果,ZEN降解产物对人体的潜在毒性以及转基因作物潜在的负面影响,如对营养特性的影响和存在过敏原的风险,仍需要进行系统深入的实验和评估。
4 总结和展望
近年来,ZEN对世界农作物的污染程度不减反增,内酯水解酶因其较高的ZEN降解活力,明确的脱毒机理,阐明的晶体结构受到广泛的关注和研究。依托生物信息学和数据库的迅速发展,ZEN内酯水解酶的发现也从费时费力的微生物直接筛选向基因挖掘转变,大量内酯水解酶被不断挖掘和鉴定,并尝试在不同工程菌宿主中进行异源发酵表达。为满足内酯水解酶工业应用的要求,采用蛋白质工程手段,通过理性设计进行分子改造,改变内酯水解酶的底物特异性,拓宽底物谱,提高热稳定性等方面的研究也不断被探索。此外,化学修饰方法,非理性设计与高通量筛选手段结合,以及快速发展的计算机模拟技术(如:Rosetta, RMSF等)等手段也将为内酯水解酶的分子改造提供一些新的思路。在应用方面,采用不同方法和载体的固定化酶很大程度上克服了游离酶在应用过程对环境耐受性差的缺陷,为工业应用可行性打下了一定的基础。转基因植物脱毒模型在ZEN降解方面也展示了一定的潜力,但考虑到转基因作物潜在的负面影响,其应用还需长期和深入的评估和研究。未来,持续挖掘性质更优越的内酯水解酶,通过分子改造,定向进化,不断拓宽内酯水解酶底物谱,提高其热稳定性,寻找最优的固定化方法和载体,更好的满足工业应用的要求,仍是该领域研究的重点和趋势。