梁平柚柚皮多糖的提取、结构解析及抗氧化能力研究
2021-04-27顾欣高涛刘梦雅丛之慧张诚雅肖乐艳李迪胡景涛
顾欣,高涛,刘梦雅,丛之慧,张诚雅,肖乐艳,李迪,胡景涛
(重庆三峡学院 生物与食品工程学院,重庆,404000)
多糖在柚皮中易与其他物质以化学键的方式相结合,因此,提取多糖的前提需要破坏该化学键,使多糖游离[6]。目前常用的多糖提取方法有热水浸提法、酶法、微波法、超声波提取法等[7]。酶法提取作为多糖提取的主要方法之一,因其具有反应条件温和、提取效率高、产物活性强、成本低、节能环保等优点,而被广泛用于植物多糖的提取[8]。
本实验以梁平柚柚皮为原料,采用复合酶法提取柚皮多糖。以提取率为指标,考察液料比、pH、酶解温度、酶解时间对多糖提取率的影响。并采用响应面实验确定其最佳工艺参数。此外,采用液相色谱-质谱联用、红外光谱、紫外光谱以及扫描电镜对其构成和结构进行表征。同时,并采用体外抗氧化实验考查梁平柚柚皮多糖的抗氧化活性,为梁平柚柚皮多糖的提取及梁平柚综合利用提供理论依据。
1 材料与方法
1.1 材料与试剂
梁平柚,购于重庆市梁平区;果胶酶、纤维素酶,山东圣斯德食品添加剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),阜阳曼林生物技术有限公司;邻苯三酚,国药集团化学试剂有限公司;三氟乙酸、单糖标品,美国Sigma公司。其余均为国产分析纯试剂。
1.2 主要仪器及设备
UV-2450紫外可见光分光光度计,日本岛津公司;FTIR-650傅里叶变换红外光谱仪,天津港东科技股份有限公司;ALPH1-2/LD-Plus冷冻干燥机,德国CHRIST公司;I-class UPLC,Xevo TQ-S micro三重四级杆液相色谱-质谱联用仪,美国Waters公司;HITACHI S-3400扫描电镜,日本日立公司。
1.3 试验方法
1.3.1 酶法辅助梁平柚柚皮多糖的提取工艺优化
1.3.1.1 多糖提取
选取新鲜的梁平柚柚皮于55 ℃条件下烘干,待其干燥至恒重后粉碎并过80目筛。按一定液料比称取去离子水与柚皮粉末,溶解后加入15 g/L的复合酶[m(果胶酶)∶m(纤维素酶)=1∶1][9],调节pH后,在一定温度下酶解一定时间,酶解完成后采用Savag法除去蛋白,再加入3倍体积的无水乙醇进行多糖提取,静置24 h后离心收集沉淀,并经冷冻干燥后即得梁平柚柚皮多糖。
1.3.1.2 单因素实验
以液料比25∶1 (mL∶g),pH 4,酶解时间120 min,酶解温度50 ℃为基础实验条件。考察液料比(10∶1、15∶1、20∶1、25∶1、30∶1、35∶1 (mL∶g)、pH(4.0、4.5、5.0、5.5、6.0、6.5)、酶解时间(30、60、90、120、150、180 min)和酶解温度(40、45、50、55、60、65 ℃)对柚皮多糖提取率的影响。
1.3.1.3 响应面优化
采用4因素3水平的响应面分析方法, 以A(液料比)、B(pH)、C(酶解时间)、D(酶解温度)为自变量,梁平柚柚皮多糖提取率为响应值,优化提取的最佳工艺。因素及水平编码见表1。
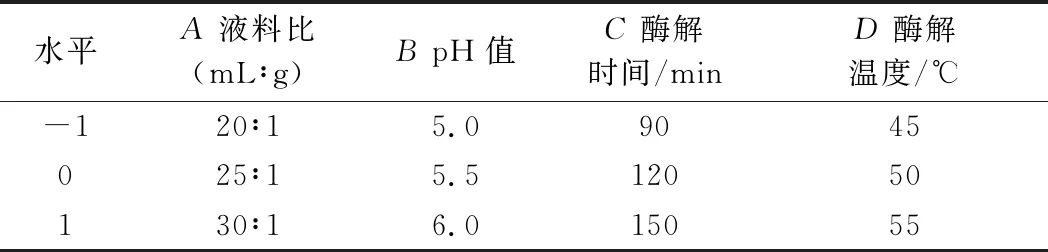
表1 响应面试验设计因素水平表Table 1 Factors and levels of response surface test design
1.3.1.4 多糖提取率的测定
提取得到的粗多糖样品放入250 mL容量瓶中,用去离子水定容,并采用苯酚—硫酸法测定其多糖含量[10]。以葡萄糖为对照制作标准曲线,其回归方程:y=0.883 5x+0.025 6,R2=0.991 6。柚皮多糖提取率按公式(1)计算:

(1)
式中:c,多糖溶液的质量浓度,mg/mL;m,梁平柚柚皮质量,g。
1.3.2 梁平柚柚皮多糖结构表征
1.3.2.1 单糖组成
根据文献所描述的方法,采用PMP柱前衍生结合液相色谱-质谱联用(ultra-performance liquid chromatography/tandem mass spectrometry, UPLC-MS/MS)对梁平柚柚皮多糖的单糖组成进行分析[11-12]。称取10 mg样品于20 mL安瓿瓶中,加入5 mL三氟乙酸(2 mol/L)溶液,N2封管后在100 ℃条件下水解2 h。水解完成后,取1 mL水解液并加入1 mL甲醇,于70 ℃条件下用N2吹干,重复2次后加入1 mL NaOH(0.3 mol/L)溶液溶解残渣。分别取400 μL的样品水解液与单糖标准溶液于5 mL试管中,加入400 μL的PMP甲醇溶液,混匀,70 ℃反应2 h,反应完成后放置至室温,再加入400 μL的HCl(0.3 mol/L)溶液调节pH至6~7,加水1 200 μL,再加入等体积的氯仿萃取,涡旋混匀,静置后收集水相,重复2次。将水相用0.45 μm水系滤膜过滤后供UPLC-MS/MS分析。
HPLC条件:Agilent EC-C18色谱柱(2.7 μm, 2.1 mm×50 mm);流量0.4 mL/min;流动相A 20 mmol/L乙酸铵缓冲液(pH 7);流动相B 乙腈;梯度洗脱模式:时间梯度为0、1、7、11、13、14.5、14.6、17 min,流动相B的体积分数梯度为14%、14%、18.5%、20%、60%、60%、14%、14%。
质谱条件:ESI+模式;喷雾电压2.0 kV;锥孔电压30 V;离子源温度150 ℃;脱溶剂温度500 ℃;脱溶剂气体N2流速为1 000 L/h;质谱扫描范围m/z170~800。
1.3.2.2 紫外光谱分析
称取一定量的梁平柚柚皮多糖溶于蒸馏水中,并以蒸馏水为对照在200~600 nm波长范围内进行紫外光谱扫描。
1.3.2.3 红外光谱分析
称取1~2 mg梁平柚柚皮多糖粉末,置于玛瑙研钵中,加入150~200 mg干燥后的KBr晶体,研磨均匀后压片,在4 000~400 cm-1范围内记录其红外光谱。
1.3.2.4 扫描电镜分析
用导电胶把梁平柚柚皮多糖固定在样品台上,送进真空喷镀仪内进行喷金处理,随后在12.5 kV下用扫描电镜进行扫描,拍摄不同倍数下的外貌形态。
1.3.3 梁平柚柚皮多糖体外抗氧化活性测定
1.3.3.1 DPPH自由基清除能力的测定
根据文献[13]报道的方法测定梁平柚柚皮多糖的DPPH自由基的清除能力。称取0.020 1 g的DPPH,用体积分数95%乙醇溶解并定容至250 mL,DPPH溶液和不同浓度的多糖溶液各取2 mL分别混合,静置30 min,在517 nm波长下测定其吸光度值。DPPH自由基清除率按公式(2)计算:
(2)
式中:A1,多糖样品溶液反应后的吸光度值;A2,无水乙醇代替多糖溶液反应后的吸光度值;A3,无水乙醇代替DPPH溶液反应后的吸光度值。
1.3.3.2 ·OH清除能力的测定
采用Fenton反应体系模型[14],在2 mL多糖溶液中,按顺序加入2 mL 9 mmo1/L的FeSO4溶液、2 mL 9 mmo1/L的水杨酸-乙醇溶液、2 mL 8.8 mmo1/L的H2O2溶液,混匀后37 ℃水浴30 min,在波长510 nm处测定吸光度值, ·OH清除率按公式(3)计算:
(3)
式中:A1,多糖样品溶液的吸光度值;A2,蒸馏水代替样品溶液后的吸光度值;A3,蒸馏水代替H2O2后的吸光度值。
(4)
式中:A1,多糖样品溶液的吸光度值;A2,蒸馏水代替样品溶液后的吸光度值;A3,蒸馏水代替邻苯三酚溶液后的吸光度值。
1.4 数据处理
2 结果与分析
2.1 单因素实验结果及分析
如图1-a所示,液料比在达到25∶1 (mL∶g)时,多糖的提取率最高;液料比<25∶1 (mL∶g)时,提取率随着液料比的增加而显著提高(P<0.05);液料比>25 (mL∶g)时,提取率随着液料比的增加而显著降低(P<0.05)。其原因在于,当液料比较低时,溶剂量较少,溶液中的多糖溶解度容易达到饱和,导致多糖不能完全渗出,从而提取率较低;随着液料比的增大,多糖的溶出量提高;液料比>25∶1 (mL∶g)时,复合酶被过度稀释,对细胞壁的破坏作用不完全,导致多糖的溶出量降低。因此选择液料比为25∶1 (mL∶g)更合适。

a-液料比;b-pH;c-酶解时间;d-酶解温度图1 单因素实验结果Fig.1 Results of single-factor experimental注:不同字母表示存在显著性差异(P<0.05)
由于果胶酶和纤维素酶作用的pH范围分别在3.0~7.0和4.2~5.2,因此选择pH 4.0~6.5的提取体系进行单因素实验[16],结果如图1-b所示。pH 4.0~5.0时,多糖提取率随着pH的升高而显著提高(P<0.05);pH 5.0~5.5时,虽然多糖提取率随着pH的升高有提高的趋势,但不具有统计学意义(P>0.05);pH>5.5时,多糖提取率随着pH的升高而显著下降(P<0.05)。综上,pH 5.5左右可以获得更高的多糖提取率。
酶解时间对多糖提取率的影响如图1-c所示。酶解时间<120 min时,多糖提取率随着酶解时间的延长而显著提高(P<0.05)。其原因在于随着酶解时间的延长,果胶酶和纤维素酶对柚皮细胞壁的破坏作用更加完全,使得柚皮多糖可以充分溶出。酶解时间在120 ~150 min时,多糖提取率随着酶解时间的延长而显著降低(P<0.05)。其原因可能是长时间的酶解造成柚皮细胞中大量细胞质溶出,影响多糖的溶出。酶解时间>150 min时,酶解时间对多糖提取率的影响趋于平缓(P>0.05)。综上,选择酶解时间120 min更合适。
酶解温度对多糖提取率的影响如图1-d所示。酶解温度<50 ℃,多糖提取率随着酶解升高而显著提高(P<0.05)。其原因在于随着酶解温度的升高,柚皮粉软化,果胶酶和纤维素酶的活性增强,对柚皮细胞结构的破坏程度逐渐加强,溶剂分子运动速度加快,多方面作用下,溶剂与多糖的接触几率增加[17]。酶解温度>50 ℃时,随着酶解温度的升高,多糖提取率显著降低(P<0.05)。其原因在于过高的温度使得酶的活性降低,导致多糖提取率降低[18]。
2.2 响应面实验结果及分析
2.2.1 响应面实验结果及方差分析
响应面实验结果如表2所示。采用Design-expert.8.0.6软件进行回归分析,得到回归方程:Y=4.78+0.44A+0.11B-0.072C+0.79D+0.002 5AB-0.43AC+0.45AD-0.097BC-0.22BD+0.015CD-0.85A2-1.15B2-0.99C2-0.50D2。其中A、B、C、D分别代表液料比、pH值、酶解时间以及酶解温度,Y代表多糖提取率。
响应面回归模型的方差分析如表3所示,模型P=0.000 6<0.05,失拟项P=0.168 36>0.05,表明该模型显著,可以很好地描述测试结果。由各因素的F值可知,各因素对梁平柚柚皮多糖提取率的影响程度由高到低依次为:D(酶解温度)>A(液料比)>B(pH)>C(时间)。
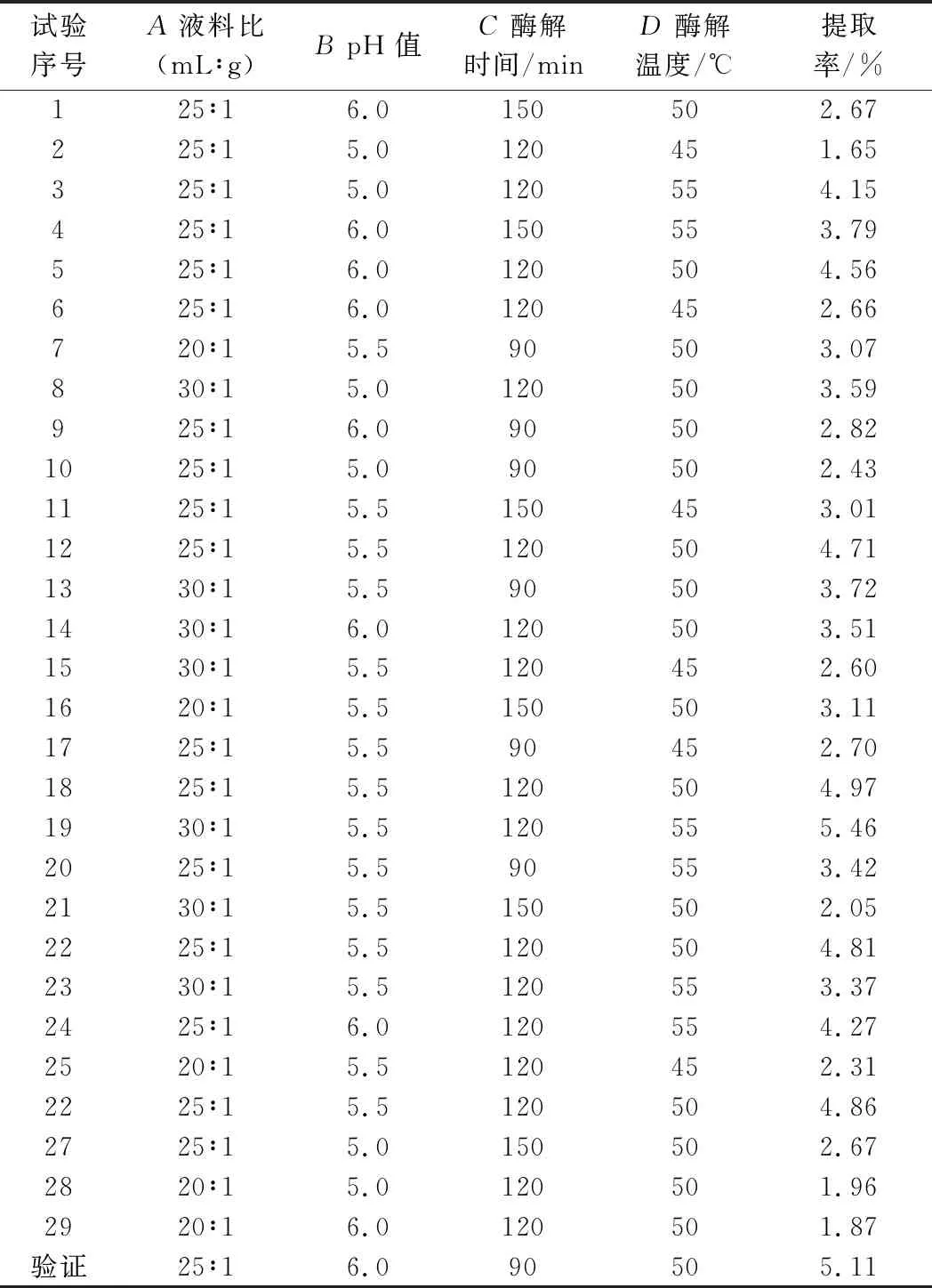
表2 响应面分析的试验结果Table 2 Program and experimental results of RSA
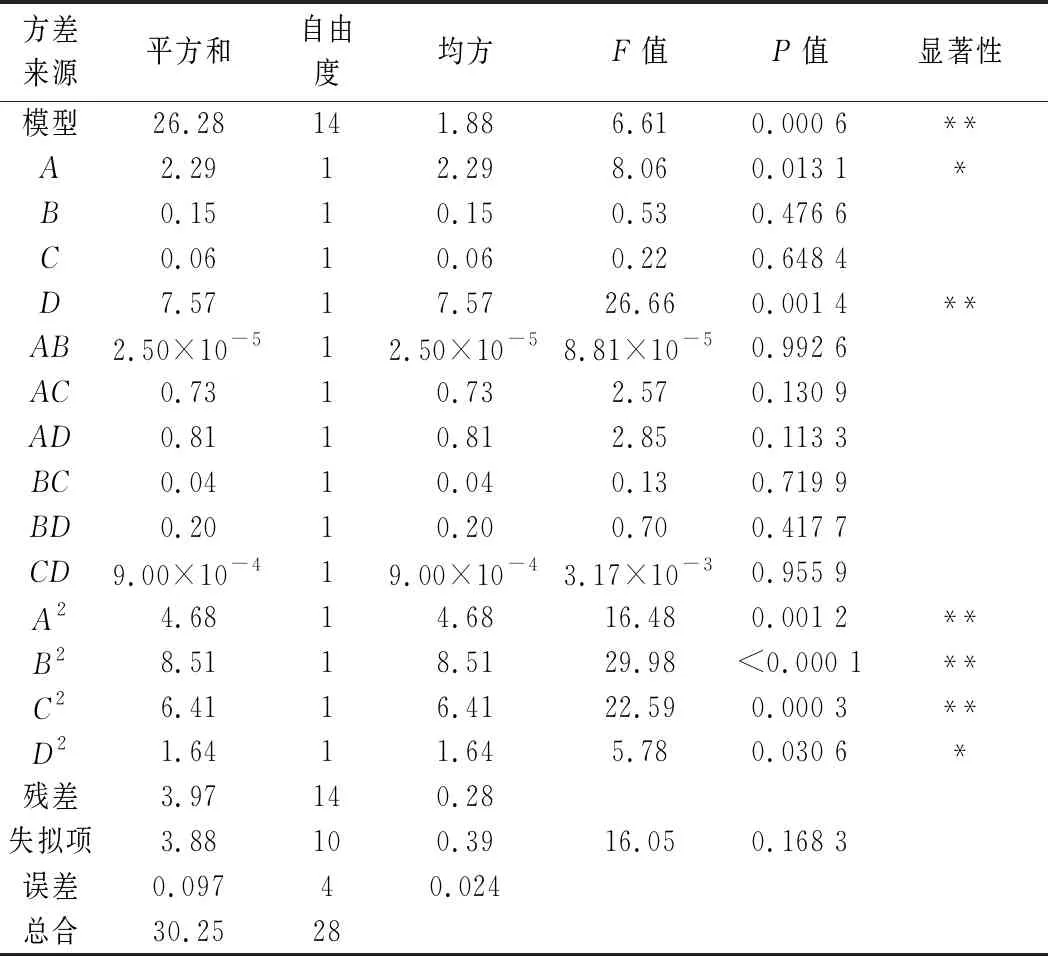
表3 二次响应面回归模型方差分析Table 3 ANOVA for response surface quadratic model analysis of variance table
2.2.2 各因素交互作用的响应面分析及最佳工艺的确定
根据响应面回归方程,利用Origin 2018软件绘制各因素响应面分析图和等高线图(图2)。当等高线呈圆形时表明两因素交互作用不显著,而呈椭圆形或马鞍形时则表示交互作用显著;其次,交互作用的曲面坡度越大,其影响程度越高[19]。如图2所示,液料比所对应的曲面坡度强于pH,证明液料比对多糖提取率的影响强于pH。由图2分析可知,各因素对多糖提取率的影响强弱依次为:酶解温度>液料比>pH>酶解时间,其结果符合方差分析。
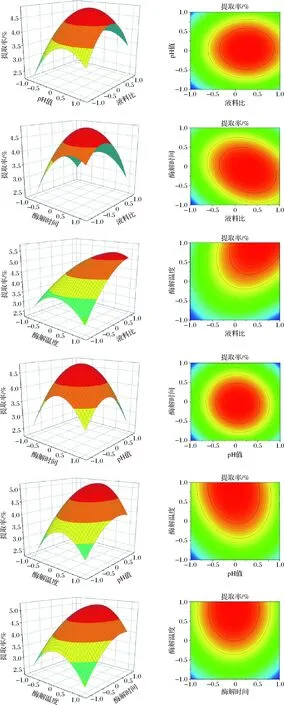
图2 各因素交互作用对柚皮多糖提取率影响的响应面图和等高线图Fig.2 Response and contour diagram of the interactions between factors on the extraction rate of pomelo peel polysaccharide
根据实际情况并采用Design-expert.8.0.6软件确定酶法辅助提取梁平柚柚皮多糖的最优工艺参数为:液料比25∶1 (mL∶g),pH 6.0,提取时间90 min,提取温度50 ℃。程序预测此条件下柚皮多糖提取率达到5.11%。实际在此条件下获得的提取率为5.46%,与程序预测值相比相对误差<5%,优化参数准确可靠,具有实际应用价值。
2.3 梁平柚柚皮多糖结构鉴定
2.3.1 单糖组成分析
利用PMP柱前衍生液相色谱质谱联用法测定梁平柚柚皮多糖的单糖组成,其结果如表4所示。梁平柚柚皮多糖主要由核糖(1.18%)、葡萄糖醛酸(1.32%)、甘露糖(4.26%)、鼠李糖(4.72%)、葡萄糖(11.46%)、半乳糖(21.48%)、半乳糖醛酸(23.67%)和阿拉伯糖(31.90%)组成。

表4 单糖组成结果Table 4 Results of monosaccharide composition
2.3.2 紫外光谱及红外光谱分析

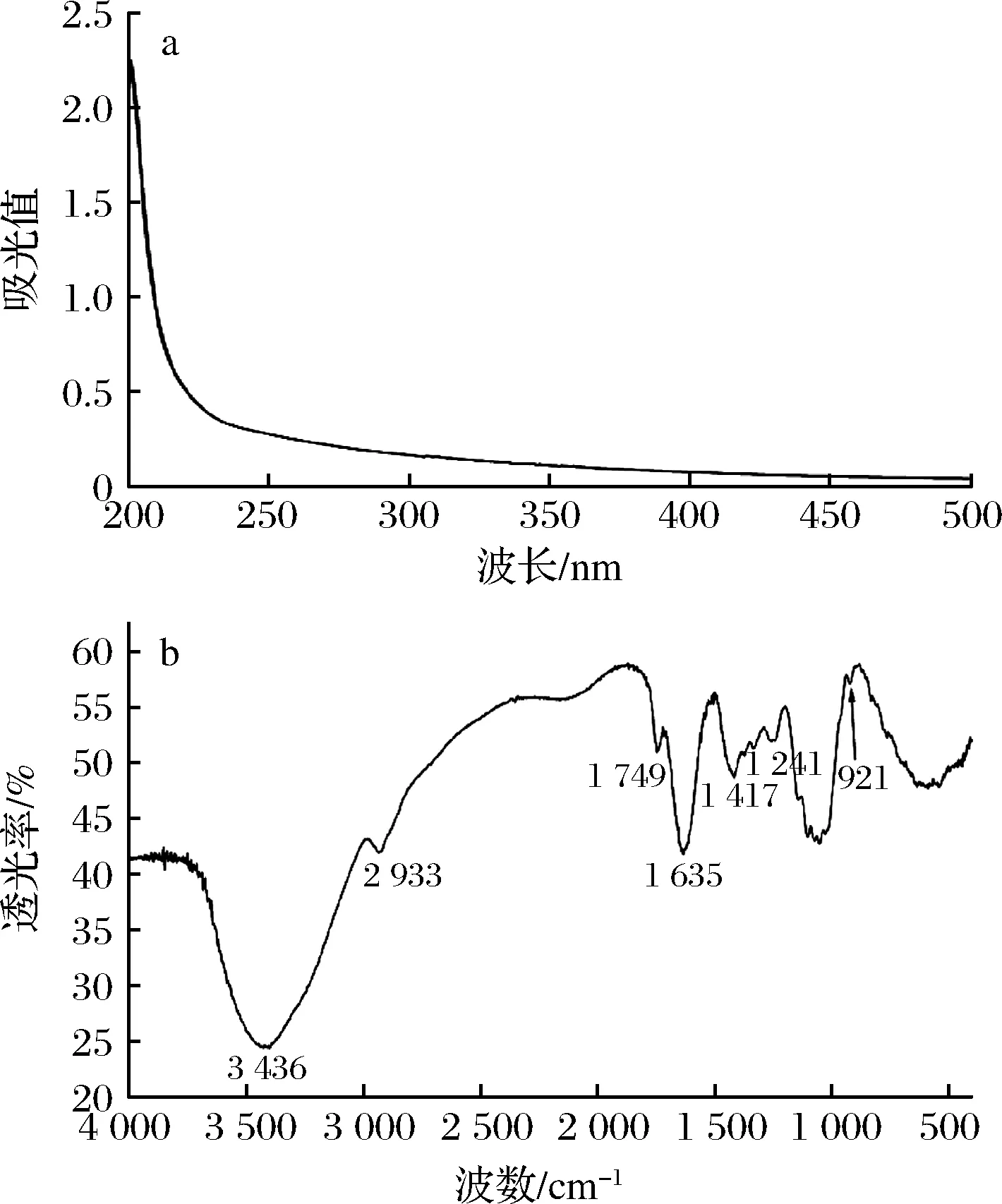
图3 梁平柚柚皮多糖的紫外光谱图(a)和红外光谱图(b)Fig.3 UV(a) and IR(b) spectra of polysaccharide from Liangping pomelo peel
2.3.3 扫描电镜分析
梁平柚柚皮多糖的扫描电镜图如图4所示,当柚皮多糖放大130倍时,多糖为颗粒状且表面粗糙多孔;当放大500倍时,可看到有光滑的片状和粗糙的块状,许多小颗粒附着在上表面,有纤维状的结构;当放大1 000倍时可看到梁平柚柚皮多糖呈片状结构,有纤维状的结构。

a-×130;b-×500;c-×1 000图4 梁平柚柚皮多糖扫描电镜图Fig.4 Scanning electron microscopy of polysaccharide from Liangping pomelo peel
2.4 梁平柚柚皮多糖的抗氧化活性鉴定
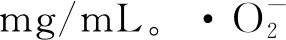

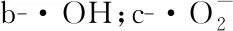
a-DPPH自由基;图5 梁平柚柚皮多糖抗氧化活性Fig.5 Antioxidative activity of polysaccharide from Liangping pomelo peel
3 讨论
复合酶法常被用于短肽、黄酮、花色苷及多糖等天然活性物质的提取[8,32]。在多糖提取研究中,复合酶法主要被用于植物多糖的提取,通过果胶酶与纤维素酶可水解破坏细胞壁结构,从而产生细胞局部的坍塌、溶解和疏松,可减少提取时来自细胞壁和细胞间质的阻力,从而提高植物多糖提取率[33]。但由于酶活性受到温度、pH等因素的影响,同时考虑到多糖提取率易受到液料比、提取时间等因素的影响,本实验选择以液料比、pH、酶解时间和酶解温度为自变量,考察其对梁平柚柚皮多糖的影响。实验结果表明,复合酶法提取梁平柚柚皮多糖的最佳工艺参数为:液料比25∶1 (mL∶g)、pH 6.0、酶解时间90 min、酶解温度50 ℃。此条件下,多糖提取率为5.46%。郭文等[9]对柚皮多糖的提取分级及分子质量分布研究中发现,复合酶法提取蜜柚柚皮多糖的最佳工艺参数为:酶用量1.5%、料液比1∶25、酶解时间120 min、酶解温度50 ℃,提取率为10.39 g/100 g。对比分析后发现,等比例混合的果胶酶与纤维素酶在柚皮多糖的提取中,其最适液料比和最适酶解温度可能为1∶25和50 ℃。由于提取方法及提取率计算方法相同,推测两者提取率间的差异可能是受原料差异的影响。另外,由于多糖提取率计算方法的不同,所以无法与其他研究进行对比。

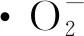
4 结论