诱导多能干细胞在神经系统肿瘤治疗中的研究进展
2021-04-27舒文静江高峰
舒文静 彭 军△ 江高峰
1)武汉科技大学附属天佑医院,湖北 武汉430064 2)武汉科技大学附属天佑医院转化医学中心 肿瘤免疫治疗研究所,湖北武汉430064
1 诱导多能干细胞简介
干细胞具有无限生长、分裂的能力,在特定的信号和适当的分化条件下,它们可以分化成具有特殊功能和性质的不同谱系[1]。由于其独特生物学性质,干细胞在再生医学及细胞治疗领域有着很好的发展前景。但因免疫排斥及伦理学方面问题,干细胞的研究一直发展缓慢。2006 年TAKAHASHI 和YAMANAKA 等[2]通过逆转录病毒将Oct3/4、Sox2、K1f4 和c-Mvc(0SKA4)等4 种基因转染小鼠成纤维细胞,成功获得诱导多能干细胞(induced pluripotent stem cells,iPSCs)。至此,iPSC 技术首次出现在人们面前。不到1年,他们又将人皮肤成纤维细胞成功地重编程为iPSCs[3],成功避免了ESCs研究所面临的医学伦理和免疫排斥问题,这在干细胞研究领域具有里程碑式的意义。到目前为止,研究人员已经从多种体细胞(包括真皮成纤维细胞、脂肪细胞、造血干细胞和外周血单核细胞)建立了制备iPSCs的方法[4-9]。除利用病毒重编程iPSCs外,RNA病毒[10]、无病毒DNA[11]、RNA[12]、蛋白质[13]和混合化合物[14]也被用来取代病毒,以增强iPSCs 的遗传稳定性和安全性[15],此外还探索了改良的mRNA 编码重编程因子[16],以提高iPSCs 的生成效率,这些策略加强了人类iPSCs(human iPSCs,hiPSCs)在疾病研究和治疗开发中的应用。目前多种疾病模型已建立,如慢性骨髓瘤、白血病、黑色素瘤等,为深入理解疾病发病机制和药物的筛选、监测提供帮助。
2 iPSCs在神经系统肿瘤中的应用
神经系统肿瘤仍是最难治疗的肿瘤之一。在全身肿瘤导致的死亡中,中枢神经系统肿瘤占第9位[17]。基于干细胞神经元定向分化的方法为疾病建模和再生医学领域提供了一个独特的平台[18]。利用模拟胚胎干细胞转化为神经干细胞(neural stem cells,NSCs)的策略[19],可以将iPSCs 分化为NSCs。因此,基于iPSC 策略来制备患者特异性NSCs 可能是未来中枢神经系统肿瘤治疗的一个有价值的临床工具。神经干细胞固有肿瘤趋向性和跨越血脑屏障的能力,这使其能够选择性地靶向肿瘤部位。作为运输工具,NSCs被设计成表达多种抗癌物质,包括前药激活酶、凋亡诱导剂、抗体和溶瘤病毒等[20-23]。NSCs可携带各种治疗药物并转移至原发性或侵袭性脑肿瘤,显著降低实体肿瘤体积,延长荷瘤小鼠的生存期[24-29]。随着最近新临床试验的启动,用细胞毒性NSC疗法成功治疗人类癌症的潜力正在接近成为现实,从而推动神经干细胞广泛用于神经系统肿瘤的治疗,现将NSCs在神经系统肿瘤中的应用进展总结于表1。
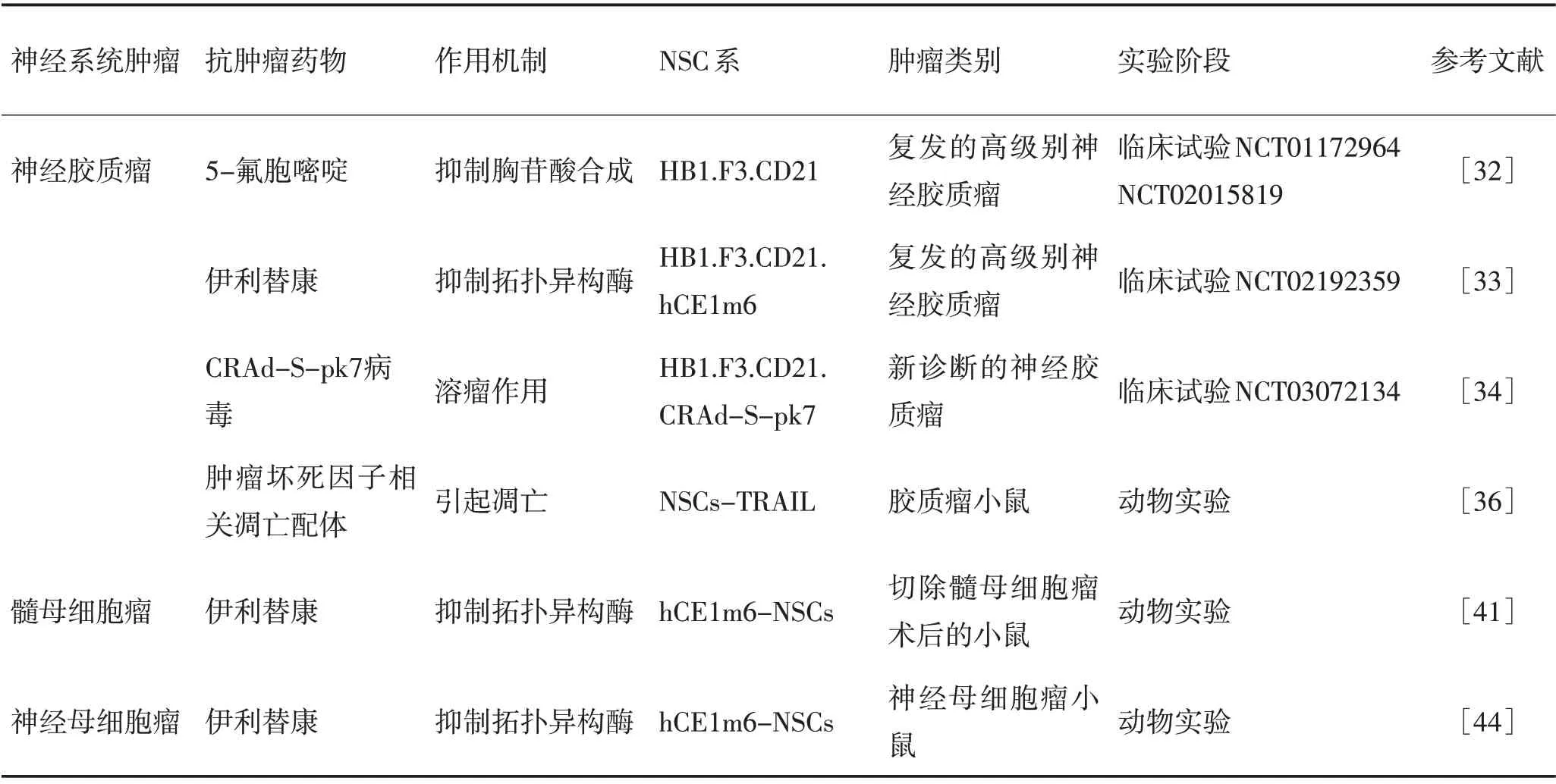
表1 NSCs在神经系统肿瘤中的应用Table 1 Application of NSCs in nervous system tumors
2.1 神经胶质瘤 胶质瘤是成人中枢神经系统最常见的原发性恶性肿瘤,世界卫生组织根据恶性程度将其分为Ⅰ~Ⅳ级,其中胶质母细胞瘤(glioma,GBM)被认为是Ⅳ级胶质瘤,在所有类型的脑肿瘤中增殖和侵袭能力最高。目前GBM标准治疗是手术切除联合放射治疗和化疗[30]。几十年来尽管出现了许多治疗药物,GBM的存活率并没有明显改善,这在很大程度上是由于癌症的侵袭性和浸润性及疾病的异质性。为了改进GBM 的治疗,许多研究探索了改善GBM 药物治疗的新策略。其中iPSC 来源的工程化细胞毒性NSCs是GBM治疗最有前途的策略之一。
2.1.1 NSCs介导的酶/前药治疗:神经干细胞可在肿瘤病灶内释放前药活化酶,将非活性前药转化为肿瘤毒性效应药物。过去20年中,在50多种不同的酶/前药组合中已有5种得以试验以增强其功效[31]。(1)CD/5-FC疗法将细胞毒性NSC治疗GBM的领域首次推进到人体临床试验[32]。该试验应用NSC 系(HB1.F3),通过逆转录病毒转导表达CD(胞嘧啶脱氨酶)及亚克隆,CD将5-FC(5-氟胞嘧啶)转化为5-FU(5-氟尿嘧啶)。该研究中在复发性高级别胶质瘤患者肿瘤切除或活检过程中采用CD-NSCs 颅内灌注治疗。试验发现CD-NSCs 以5-FC 剂量依赖的方式在大脑局部产生5-FU,同时未发现由于CD-NSCs 引起的剂量限制毒性(DLT),结果证明了NSCs 靶向脑肿瘤和局部产生化疗的初步安全性和概念验证。该研究为基于NSC 的脑肿瘤治疗的临床试验奠定了基础。(2)NSCs 介导的羧酸酯酶(CE)/伊立替康(CPT-11)治疗中,CE 可将前药CPT-11 在肿瘤局部转换成活性代谢物SN-38,SN-38 是一种有效的拓扑异构酶Ⅰ抑制剂。最近关于该酶/前药的临床试验已经启动(ClinicalTrials.gov 标识码NCT02192359),主要探讨静脉注射伊立替康联合表达羧化酯酶(CE)的人NSC 是否也适用于复发性GBM患者[33]。
2.1.2 NSCs 介导的溶瘤病毒治疗:溶瘤病毒(oncolytic viruses,OV)治疗是GBM的一种有前途的治疗策略。到目前为止已有7种菌株在针对GBM治疗的临床试验中进行了研究[33]。不同于传统的减毒病毒,OVs 有可能在癌症中有条件地复制细胞。这种复制最终导致肿瘤细胞溶解并释放新病毒感染邻近肿瘤细胞。OV 疗法可以最大程度地杀灭肿瘤细胞。目前通过这种传播方式,该治疗方法已经进入临床试验阶段。针对新诊断的胶质瘤患者,联合传递腺病毒(crad-survivin-pk7)的NSC、替莫唑胺(TMZ)和放射治疗的首次临床试验正在进行中(ClinicalTrials.gov identifier NCT03072143),主要目的是为了探讨crad-survivin-pk7的安全及最大剂量[34]。
2.1.3 神经干细胞介导的治疗性蛋白的分泌:神经干细胞可以通过整合载体进行转导,从而稳定释放抗癌蛋白,通过细胞间隙连接介导的“旁观者效应”诱发肿瘤细胞凋亡,但对正常细胞没有影响,其中最常用的药物是肿瘤坏死因子相关凋亡配体(TRAIL)。EHTESHAM 等[35]采用NSCs-TRAIL 治疗胶质瘤模型小鼠,发现能够有效地诱导胶质瘤细胞凋亡,使模型小鼠肿瘤体积显著减小,且对正常组织没有毒性。另外体外研究发现,采用NSCs表达膜结合型TRAIL(NSCs-mTRAIL)与可溶型TRAIL相比更容易使U87 胶质瘤细胞凋亡,而且蛋白酶体抑制剂硼替佐米能够增强这种抗肿瘤作用,同时体内研究也证明NSCs-mTRAIL 治疗可显著提高胶质瘤模型小鼠的存活率,硼替佐米也能进一步改善小鼠的生存状况[36]。
2.2 髓母细胞瘤 髓母细胞瘤(medulloblastoma,MB)是儿童最常见的原发性脑瘤[37],MB 可分为5 个分子亚型,具有明显的转录和表观遗传特征。标准的MB治疗方法为放疗和辅助多药化疗,继而最大限度的手术切除[38]。这种疗法的5 a 生存率为60%~70%,而且在部分亚型MB患儿中,MB的高侵袭性使得手术与放化疗效果欠佳[39]。存活下来的儿童往往受到放疗和化疗延迟后果的影响,包括永久性神经认知障碍、心理社会缺陷、发育迟缓和内分泌缺陷等。NSCs固有的致瘤特性为MB的治疗提供了一个前所未有的优势。由于NSCs能有效穿越血脑屏障,选择性地将抗癌药物靶向浸润肿瘤细胞,可提高局部药物浓度,同时降低对正常组织的毒性。细胞毒性NSCs 已成为治疗MB 的一种有前途的方法。GUTOVA等[40]使用一个已建立的转基因人类NSC系(HB1.F3.CD)将CE传递至小脑肿瘤病灶,使CPT-11局部转化为SN-38。该研究探讨了HB1.F3.CD NSC在肿瘤内分布及临床疗效,实验显示同时接受NSCs和CPT-11 治疗的实验组小鼠的肿瘤生长速度较对照组明显下降,CE/CPT-11 治疗为进一步临床应用提供了参考数据。有研究人员[41]使用5 个不同MB分子亚群中的两个细胞系(DAOY,D282)建立了第一个图像引导下的MB切除/复发模型,对比术前MB小鼠发现,术后小鼠MB 生长速度及复发率明显增快。同时利用患儿皮肤来源的iNSCs,将表达胸苷激酶的iNSCs注射到术后MB 小鼠手术腔内,并给小鼠全身注射更昔洛韦(GCV),结果发现NSCs 迁移到MB,且显著抑制了残余MB体积的增长,使其存活增加了1 倍以上。这些发现首次证明腔内NSC 治疗可以有效地治疗术后MB 小鼠。虽然这些研究表明NSC 在MB 治疗中非常有效,但尚缺乏更多、更全面准确模拟手术切除后MB临床模型,这限制了NSC在临床治疗中的进展[42]。
2.3 神经母细胞瘤 神经母细胞瘤(NB)是起源于交感神经系统的神经内分泌肿瘤,是儿童最常见的颅外实体瘤,目前对这些患者的标准治疗包括:(1)强化诱导化疗;(2)清髓巩固放化疗和自体造血干细胞移植;(3)维甲酸与靶向免疫治疗。由于其具有易复发、远处转移、产生耐药性等特点,尽管进行了积极的综合治疗,预后仍不佳,5 a 总体生存率低于50%[43]。治疗失败主要发生在原发部位和转移部位的微小残留性疾病(MRD),特别是转移到骨和骨髓的部位,表明MRD是复发的一个重要原因。目前的强化化疗剂量和放疗方案可能处于抗肿瘤疗效和患者耐受性的极限,而且巩固后治疗并不能根除许多患者的MRD。因此,迫切需要改进NB 的治疗方法,以提高本病患儿的临床结果。NSCs 为NB 的治疗提供了一种可能。已有研究[44]证实表达兔羧酸酯酶(rCE)的NSCs 可分布于小鼠的多个NB 转移部位,并使CPT-11 转化为1 000 倍毒性的拓扑异构酶-1抑制剂SN-38,产生显著的治疗功效。这些研究为继续发展NSCs 介导的基因治疗提供了依据。该研究接着利用表达改良人类CE(hCE1m6-NSCs)探索发挥最大疗效的静脉使用剂量及治疗方案,药代动力学结果证实人源性NB 细胞系对hCE1m6 和CPT-11 同时用药的敏感性明显高于单独用药。此外,与单独药物治疗的小鼠相比,反复静脉注射hCE1m6-NSCs 和CPT-11 的NB 小鼠肿瘤负荷率显著降低。这些研究证实NSCs 介导的药物治疗可以改善NB小鼠的预后。
3 问题与展望
iPSC在破译病因学和多种疾病的病理生理机制方面极大提高了我们的认识。用iPSC衍生的表型细胞治疗一些严重的退化性疾病和器官损伤已进入临床试验,然而以iPSCs 为基础的治疗仍处于起步阶段。到目前为止,大多数使用iPSCs细胞的疾病模型都集中在单基因引起的疾病。iPSCs 应用于临床仍然存在一些问题,一方面iPSC技术中的安全性、效率和诱导多能干细胞再分化机制等方面的问题,另一方面基因的不稳定性、表观遗传异常和致瘤性的可能都将是iPSCs 技术面临的困难。相信在不远的未来,诱导多能干细胞技术定会在临床实际应用取得重大突破,为治疗人类疾病带来新希望。
