外周血循环肿瘤细胞在晚期肺鳞癌患者免疫联合化疗疗效及预后中的价值初探
2021-04-27杜静怡徐兴祥卞家蓉
杜静怡 徐兴祥, 卞家蓉
肺癌是世界上发病率和死亡率最高的恶性肿瘤之一[1]。由于早期缺乏症状,确诊时大部分患者已失去手术机会,全球肺癌的5年生存率仅为5%~15%[2]。非小细胞肺癌(Non-small cell lung cancer,NSCLC)是肺癌最常见的组织类型,占80%~85%。肺腺癌是NSCLC 中最常见的亚型,肺鳞癌(Lung squamous cell carcinoma,LUSC)是第二常见亚型[3]。大多数NSCLC 发现时已失去手术机会,预后较差。大量研究表明,循环肿瘤细胞(Circulating tumor cells,CTCs)计数在肿瘤疗效预测、预后评估以及复发转移监测方面具有重要作用。Krebs 等[4]研究表明CTCs计数与NSCLC 化疗疗效密切相关,但是目前尚未形成CTCs计数与联合治疗疗效方面的评估体系。基于此,本研究旨在分析CTCs 在晚期LUSC患者治疗中的疗效评价及预后评估价值。
1 材料与方法
1.1 一般资料选取2018年10月~2020年2月于扬州大学附属苏北人民医院诊治并接受CTCs检测的晚期LUSC患者39例。根据国际肺癌研究学会(IASLC) 制定的第八版国际肺癌TNM分期标准进行分期。本研究经扬州大学附属苏北人民医院伦理委员会批准,入组患者均签署知情同意书。
1.2 纳入与排除标准纳入标准:①年龄18~75周岁;②患者的东部肿瘤协作组(ECOG)评分0~1分;③经组织病理学确诊为LUSC,且TNM分期为Ⅲ期或Ⅳ期;④既往未接受过系统性抗肿瘤化疗;⑤自愿参与本研究并签署知情同意书。排除标准:①合并其他恶性肿瘤、免疫系统疾病者;②存在脑转移者;③严重心、肺、肾等脏器疾病者;④无法配合采集标本和资料者。
1.3 治疗方法39例晚期LUSC患者中,实验组15例采用卡瑞利珠单抗联合卡铂+紫杉醇治疗方案:第1天静脉滴注200mg 卡瑞利珠单抗、卡铂AUC=5、紫杉醇175mg/m2,21d 为1个疗程,共2个疗程。对照组24例采用安慰剂联合卡铂+紫杉醇治疗方案:第1天静脉滴注200mg 安慰剂、卡铂AUC=5、紫杉醇175mg/m2,21d 为1个疗程,共2个疗程。
1.4 临床与实验室评估患者治疗前均接受标准的临床和实验室评估,包括胸腹部增强计算机断层扫描(CT)、头部增强磁共振成像、骨扫描(ECT),并于每2个治疗周期后通过影像学检查进行肿瘤评估,或在怀疑疾病发生进展时对肿瘤进行影像学评估。无进展生存期(Progression-free survival,PFS)定义为从开始治疗到患者疾病进展或其他原因死亡所经过的时间。
1.5 外周血CTCs检测方法及截断值判定分别于治疗前及第2疗程治疗结束后当天采集患者上肢静脉血6ml,放置于含有ACD 抗凝剂的真空采血管(Becton Dickinson,Franklin Lakes,NJ,USA)中。采用SE-i·FISH®CTC 试剂盒(Cytointelligen,San Diego,CA,USA)富集NSCLC患者外周血中的肿瘤细胞[5,6],iFISH试剂盒(Cytointelligen,San Diego,CA,USA)对富集的肿瘤细胞进行检测和计数。操作均按照试剂盒说明书进行。目前国际上对CTCs截断值没有统一标准,在本研究中以CTCs=5个/6ml外周血作为NSCLC CTCs 的截断值[7]。
1.6 疗效评价肺癌治疗疗效评价标准采用实体肿瘤疗效评价标准(Response evaluation criteria in solid tumor,RECIST) 1.1[8]。完全缓解(Complete response,CR):所有靶病灶消失;部分缓解(Partial response,PR):靶病灶直径之和比基线水平减少至少30%;疾病进展(Progressive disease,PD):靶病灶直径之和增加至少20%,或出现1个或多个新病灶;疾病稳定(Stable disease,SD):靶病灶减小的程度没有达到PR,增加的程度也没有达到PD 水平。疾病控制(Disease control,DC)为CR+PR+SD。RECIST 疗效评价标准治疗有效为DC,治疗无效包括PD。
CTCs 疗效评价标准:治疗有效指治疗后外周血CTCs数量下降≥1/5,治疗无效指治疗后外周血CTCs数量不变或升高>1/5[4]。
1.7 随访随访截至2020年12月1日,入组的39例患者全部完成随访,随访率100%。以疾病出现进展或者患者死亡为随访终点。
1.8 统计学分析采用SPSS 21.0 软件对数据进行统计学分析。计量资料应用Shapiro-Wilk 先进行正态性检验,得到计量资料均不符合正态分布,故采用中位数(四分位数)表示,分类资料用例数和百分数(%)表示。计量资料组间比较,采用非参数秩和检验。计数资料组间比较,采用卡方检验或Fisher 精确检验。采用Spearman 相关系数对CTCs数量变化与治疗疗效进行相关性分析。Fisher 精确检验评价RECIST和CTCs 两种疗效判定方法。生存分析采用Kalplan-Meier 生存曲线。两组间差异比较采用Log-rank 检验。单因素及多因素分析采用Cox 比例风险回归分析。P<0.05 为差异有统计学意义。
2 结果
2.1 晚期LUSC患者基线CTCs数目与临床病理特征的关系本研究共纳入39例晚期LUSC患者,患者均检测到CTCs,CTCs检出率100%。经统计学分析,基线CTCs数目与不同的年龄区间、性别、吸烟史、TNM分期、治疗前有无远处转移及ECOG 评分患者间差异无统计学意义(P>0.05),而与肿瘤最大直径的差异有统计学意义(P<0.05),见表1。
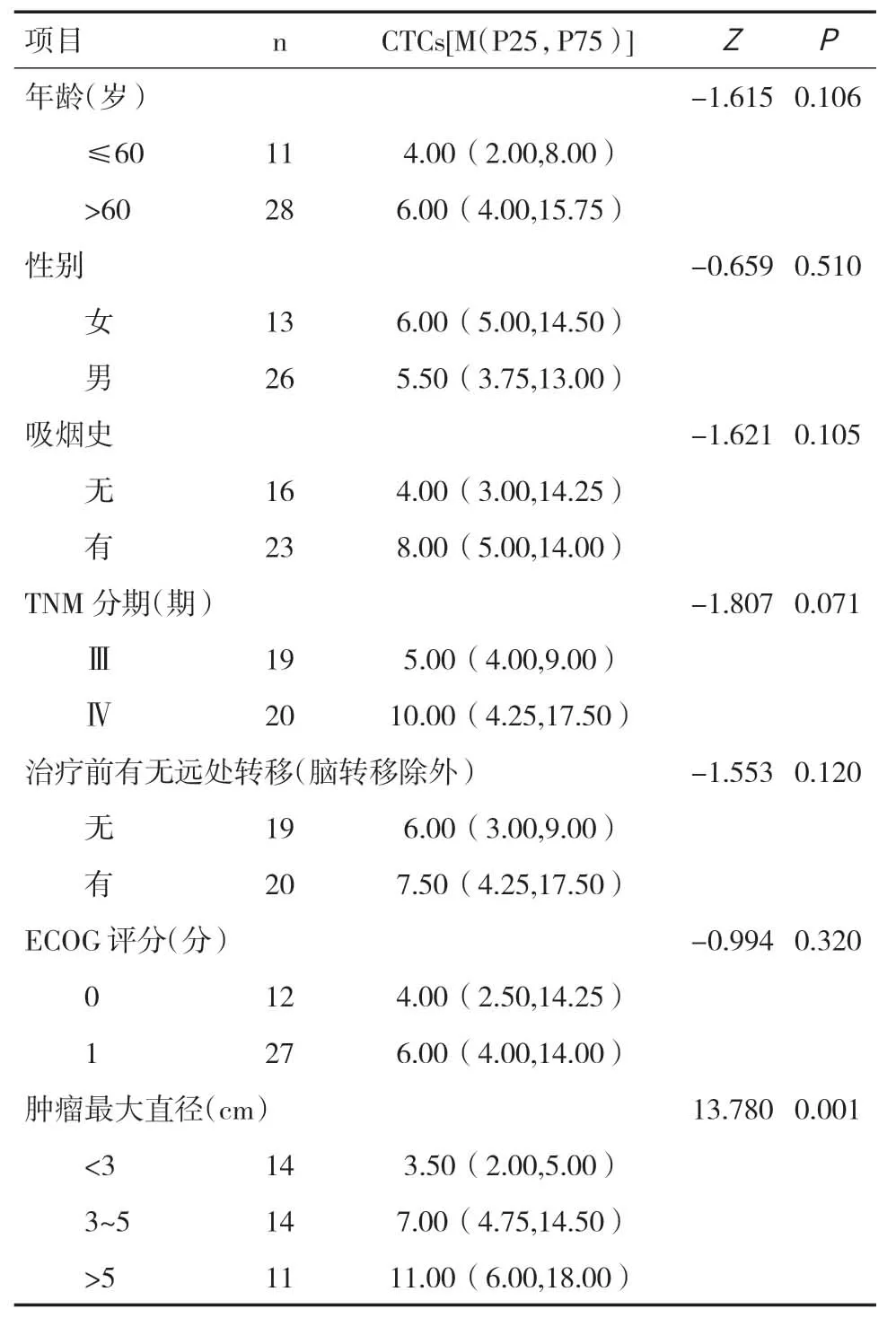
表1 晚期LUSC患者基线CTCs数目与临床病理特征的关系
2.2 治疗方法和CTCs数量变化与治疗效果的关系RECIST 1.1 评价结果显示,治疗2个疗程后,采用卡瑞利珠单抗联合卡铂+紫杉醇治疗的患者,PD 4例,DC 11例。DC患者中,CTCs数目升高的有2例,CTCs数目不变/下降的有9例;采用安慰剂联合卡铂+紫杉醇治疗的患者,PD 9例,DC 15例。DC患者中,CTCs数目升高的有9例,CTCs数目不变/下降的有6例。对CTCs数目变化和治疗效果行Spearman 相关性分析,结果显示,CTCs数目变化与卡瑞利珠单抗联合卡铂+紫杉醇疗效之间呈显著负相关(r=-0.533,P=0.041),而与安慰剂联合卡铂+紫杉醇疗效之间无相关性(r=0.258,P=0.223),见表2。
2.3 CTCs与RECIST评价标准比较治疗2个疗程后,按照CTCs 评价标准判定,有效者22例,无效者17例。按照RECIST 标准判定,有效者26例,无效者13例。采用Fisher 精确检验评价两种疗效判定方法,差异无统计学意义(P=1.00>0.05),即CTCs评价可作为治疗效果的评价标准,见表3。
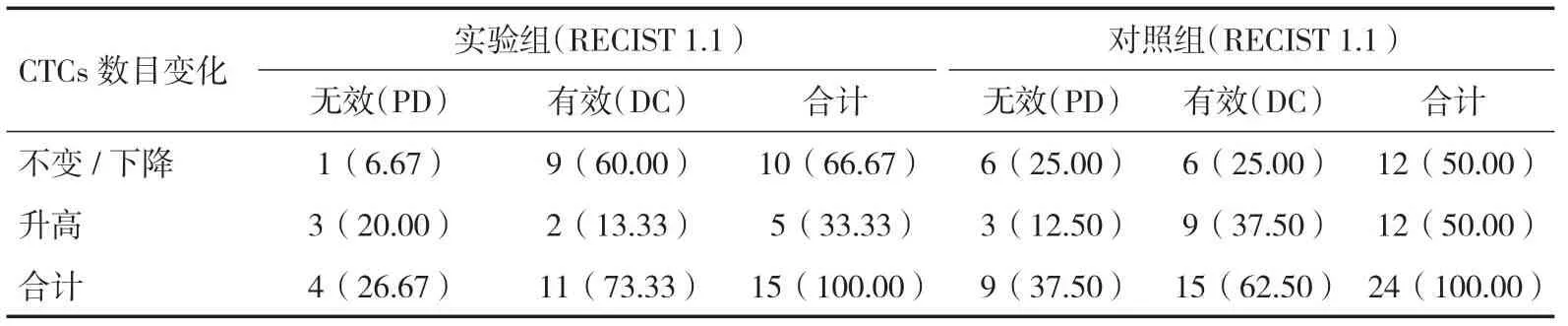
表2 CTCs数目变化与两种治疗方案的关系[n(%)]

表3 CTCs 与RECIST 疗效评价标准比较[n(%)]
2.4 CTCs数量与晚期LUSC患者PFS生存曲线39例晚期LUSC患者中基线CTCs<5个/6ml 外周血和≥5个/6ml 外周血分别为14例和25例,中位PFS分别为34.92周(95%CI:28.45~41.39)和22.37周(95%CI:17.85~26.88),Log-rank 检验显示差异有统计学意义(χ2=7.730,P=0.005),见图1。治疗2个疗程后,CTCs<5个/6ml 外周血的患者和≥5个/6ml外周血的患者分别为22例和17例,中位PFS分别为33.42周(95%CI:24.39~42.45) 和22.80 周(95%CI:13.23~32.37),Log-rank 检验显示差异有统计学意义(χ2=6.775,P=0.009),见图2。

图1 晚期LUSC患者的生存曲线

图2 治疗后晚期LUSC患者的生存曲线
2.5 不同治疗方式与晚期LUSC患者PFS生存曲线39例晚期LUSC患者,实验组与对照组中位PFS分别为33.65周(95%CI:28.13~39.18)和21.11周(95%CI:16.86~25.37),Log-rank 检验显示差异有统计学意义(χ2=11.954,P=0.001),见图3。
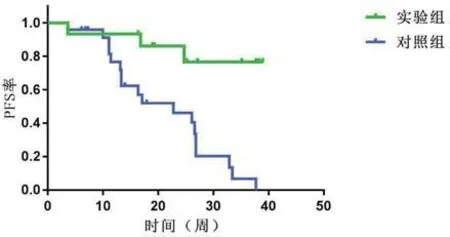
图3 不同治疗方式下晚期LUSC患者的生存曲线
2.6 单因素与多因素分析采用Cox 比例风险回归分析对39例晚期LUSC患者的临床病理特征及基线CTCs数目进行单因素分析,结果显示,肿瘤最大直径、治疗方式、NSE、基线CTCs数目与PFS 有相关性(P<0.05)。将单因素Cox 比例风险回归分析中有意义的4个指标作为自变量,进行多因素分析,结果显示,不同的治疗方式、基线CTCs数目是影响患者PFS 的独立影响因素(P<0.05),见表4、5。

表4 影响晚期LUSC患者PFS 单因素分析
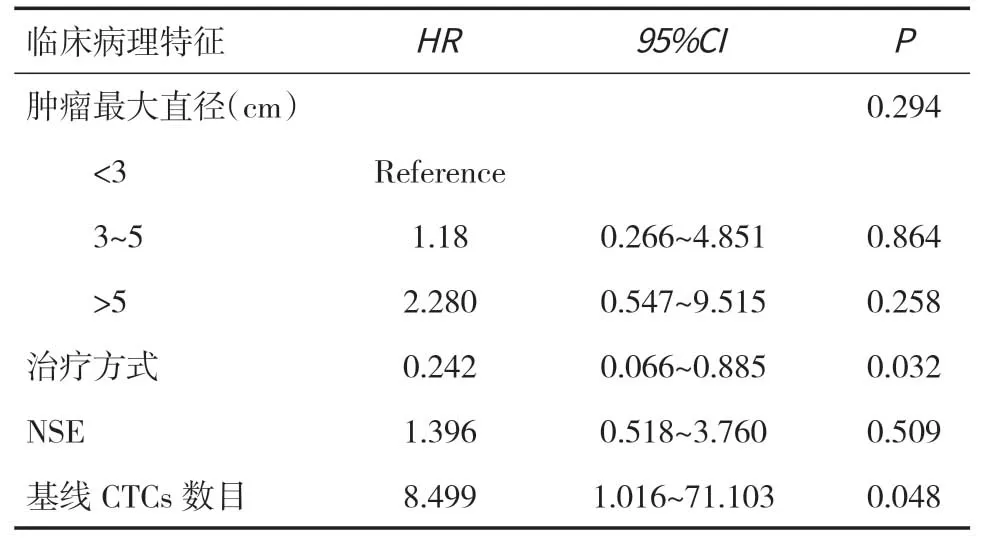
表5 影响晚期LUSC患者PFS 多因素分析

续表4
3 讨论
肺癌是世界范围内癌症相关死亡的首要原因,尽管癌症治疗取得了一定进展,但晚期肺癌的总体五年生存率仍然不到20%[1]。化学疗法、放射疗法和外科技术的进步使得晚期NSCLC 的PFS 和总生存期(Overall survival,OS)显著提高,但OS 仍然很低。含铂双药化疗是身体状况较好(PS 0~1)的晚期NSCLC 标准化疗方案,然而,在PS≥2 的患者和老年患者中,这种联合治疗发生不良反应的风险很高[9]。针对程序性死亡蛋白1(Programmed death-1,PD-1)/程序性死亡配体1(Programmed death-ligand 1,PD-L1)的免疫检查点抑制剂(Immune checkpoint inhibitors,ICIs)已被发现在统计学上可以提高肺癌患者的生存率,并且已经成为晚期NSCLC 主要的免疫疗法,改变了晚期肿瘤的治疗模式。但是并非所有的NSCLC患者均能从中受益。近年来,为使更多的患者受益于免疫治疗,越来越多的联合治疗均在探索中,其中联合化疗是目前的研究热点。已有研究表明,抗PD-1/PD-L1 的ICIs 联合铂类化疗可以改善晚期NSCLC患者的预后,并延长其生存期[10]。在本研究中,接受PD-1 抑制剂卡瑞利珠单抗联合卡铂+紫杉醇治疗的晚期LUSC患者的PFS 明显高于安慰剂联合卡铂+紫杉醇的患者。但是免疫治疗并非在所有情况下均有效,临床医生仍需要使用可靠的生物标志物来选择可能受益的患者及评估疗效、预后。当前对中晚期肺癌疗效的评价普遍采用RECIST评价标准,然而主要依赖CT检测的RECIST评价标准对疗效的判定存在一定的滞后性。CTCs检测作为一种新兴的液体活检技术,有望为癌症检测和疾病监测提供一种非侵入性手段。
CTCs是指从原发肿瘤或转移肿瘤部位分离出来的,可以逃脱人体免疫系统,并在循环系统中存活的肿瘤细胞[11]。有研究发现,CTCs 存在于恶性肿瘤患者体内,如肺癌、前列腺癌、乳腺癌等,几乎不存在于健康人群中[12]。若在肿瘤患者外周血中检测到CTCs,则提示预后不良[13]。本研究中,所有患者均检测出CTCs。在各种实体肿瘤类型中,CTCs 已被确定为肿瘤进展的危险因素。近年来,CTCs计数也已被证明是NSCLC 的独立预后指标。Krebs 等[4]通过CellSearch 系统评估了101例接受标准化疗的晚期NSCLC患者CTCs计数的预后价值。在多因素分析中,基线时较高的CTCs计数与较 差 的PFS(HR:4.85;95%CI:1.93~12.17;P=0.001)和OS (HR:7.92;95%CI:2.85~22.01;P<0.001)相关。本研究证实了晚期LUSC患者基线CTCs计数与PFS 相关,基线CTCs数目≥5个/6ml 外周血的患者PFS 明显低于基线CTCs数目<5个/6ml 外周血的患者,且在多因素分析中基线CTCs计数是影响患者PFS 的独立因素,这与既往研究结果一致[14]。本研究还表明,39例晚期LUSC患者在治疗2个疗程后,CTCs数目≥5个/6ml 外周血的患者PFS 显著低于CTCs数目<5个/6ml 外周血的患者,这些结果提示CTCs 可能预测晚期LUSC患者的远期生存。与组织活检相比,CTCs 可以更好地反映肿瘤的异质性,已逐渐成为监测肿瘤细胞复发转移及评估疗效、预后的重要手段。有研究表明,化疗后CTCs计数与肿瘤大小密切相关[15]。Hirose 等[16]的研究发现,CTCs计数可能是转移性NSCLC患者化疗疗效的预测因素。然而Zhou 等[17]的研究却表明CTCs计数变化与化疗疗效无相关性。Juan 等[18]评估了37例晚期NSCLC患者在基线和化疗2个月后的CTCs 水平,发现化疗2个月后PFS 无显著差异(P=0.45)。在本研究中,PD-1 抑制剂卡瑞利珠单抗联合卡铂+紫杉醇治疗的晚期LUSC患者,治疗前后CTCs数目变化与疗效呈显著负相关,即CTCs数目不变/减少或动态增多与RECIST评价标准为DC 或PD 相关,而安慰剂联合卡铂+紫杉醇的患者,治疗前后CTCs数目变化则与疗效无关。在未来,需要更多的研究来确定CTCs计数与治疗效果间是否确实存在相关性。
本研究结果显示,晚期LUSC患者基线CTCs数目与肿瘤最大直径密切相关,而与年龄、性别、吸烟史、TNM分期、治疗前有无远处转移及ECOG 评分无关。目前关于CTCs 与TNM分期之间的相关性存在争议,Wei 等[19]的研究显示,Ⅳ期NSCLC患者中CTCs数目明显高于Ⅰ、Ⅱ或Ⅲ期患者。而Zhou 等[17]的研究表明,CTCs计数与TNM分期无相关性,但与远处转移有关。这可能与所采用的CTCs检测技术不同,纳入的研究患者不同以及个体异质性有关。然而,本研究纳入样本量较少、观察周期较短,仍需更多临床研究来证实上述观点。
综上所述,免疫联合化疗是有望成为进一步提高免疫系统杀伤肿瘤细胞能力的新策略。外周血CTCs检测有助于评估患者疗效及预后,且有望成为评价晚期LUSC 治疗效果的标准。
