丛枝真菌调节类黄酮和NO的水平减轻镉胁迫对小麦幼苗的氧化伤害研究
2021-04-27韩蕾蕾王红霞李阳张乐乐袁祖丽
韩蕾蕾,王红霞,李阳,张乐乐,袁祖丽
(河南农业大学生命科学学院,河南 郑州 450002)

植物体自身具有响应Cd胁迫的机制,可通过信号调控、酶促和非酶促反应等清除过量ROS,在一定程度上缓解Cd胁迫产生的过量ROS造成的氧化伤害[14]。类黄酮、NO、H2O2既属于植物生长发育过程中的信号物质,也参与植物逆境生理过程。类黄酮(Flavonoid)是一类广泛存在于植物中的多酚类次生代谢产物,是活性氧自由基的清除剂,可以直接清除H2O2,·OH,1O2等活性氧分子[15-17]。王宇涛等[18]研究表明,Cd胁迫下拟南芥植株类黄酮含量增加,通过积累的类黄酮发挥其抗氧化作用而提高其对Cd的耐受性。岳凯等[19]研究表明,在干旱胁迫下藜麦叶片类黄酮含量升高,不同程度干旱胁迫下的类黄酮对自由基的清除能力不同,在5%的聚乙二醇(Polyethylene glycol,PEG)干旱处理下表现出最强的自由基清除力。
NO是一种可扩散的气态信号分子,在植物的生长、发育和抗逆胁迫中起着至关重要的作用[20]。NR被公认为内源性NO生物合成的重要酶源,催化亚硝酸盐还原生成NO;胁迫下,植物光合作用被破坏,电子传递受阻,碳代谢与氮代谢的失衡,NR会利用胞浆中累积的亚硝酸盐大量合成NO[21]。NO具有清除Cd胁迫产生的过量H2O2能力[8]。CKAYA等[22]研究显示,NO通过加速抗坏血酸-谷胱甘肽循环(ASA-GSH)增强辣椒对Cd的耐受性。
丛枝真菌是生态系统中一类分布广泛的内生菌根菌,可与大多数高等植物根系共生,产生丛枝菌根,直接或间接地参与缓解Cd污染对植物造成的氧化损伤[23]。研究表明,接种丛枝真菌可以提高共生植物的抗氧化酶活性,清除过积累的ROS;可以提高叶绿素含量,增强叶片光合作用,促进植物的生长与发育[24-25]。丛枝真菌在形成菌根共生体的过程中可以影响植物多种信号物质的合成,如类黄酮、NO、H2O2等,通过类黄酮、NO、H2O2的作用缓解逆境伤害[26]。因此,本试验通过对Cd污染土壤小麦接种丛枝真菌后类黄酮含量、NO含量、NR活性和H2O2含量的研究,探讨丛枝真菌对Cd胁迫小麦幼苗的修复机制,为Cd污染土壤小麦栽培的原位修复技术提供理论依据。
1 材料与方法
1.1 试验材料与试验设计
小麦(TriticumaestivumL.)品种为百农207。丛枝真菌(Arbuscularmycorrhizalfungi,AMF)为摩西球囊霉菌(Glomusmosseae,Gm)。
采用土培的试验方法,营养土灭菌后晾干备用。塑料杯消毒,未接种丛枝真菌的杯子装入120 g已灭菌营养土,接种丛枝真菌的杯子装入115 g营养土和5 g菌种。小麦种子用3%的H2O2浸泡消毒20 min,再用蒸馏水冲洗数次,浸泡30 min。每杯播种36粒种子,将杯子放置光照培养箱中培养,培养条件设置为14 h光照/10 h黑暗,温度为16~25 ℃,相对湿度为80%,光照度为0~100 μmol·m2·s-1。
种子播种3 d后,对小麦幼苗进行Cd胁迫处理。此后幼苗每2 d浇灌Hoagland’s营养液50 mL。每个处理重复5次。幼苗生长至两叶一心后,将叶片用锡箔纸包裹迅速放液氮冷冻,-80 ℃保存备用。
试验设计为6个处理,分别为:对照(CK);对照接种丛枝真菌(CK+AMF);5 mg·kg-1Cd胁迫(Cd5);5 mg·kg-1Cd胁迫接种丛枝真菌(Cd5+AMF);10 mg·kg-1Cd胁迫(Cd10);10 mg·kg-1Cd胁迫接种丛枝真菌(Cd10+AMF)。
1.2 研究内容与方法
研究检测了小麦幼苗叶片类黄酮含量、NR活性、NO含量、H2O2含量,分别进行3个重复。
1.2.1 类黄酮含量 小麦幼苗叶片类黄酮含量测定参考董李平等[27]的方法,对小麦幼苗叶片类黄酮含量进行检测。准确称取小麦幼苗叶片干粉0.2 g,40%乙醇(pH值为3)室温提取24 h,用提取溶剂定容至50 mL。取提取液0.5 mL于试管中,依次加入2 mL双蒸水和5%亚硝酸钠0.15 mL,静置5 min;加10%六水氯化铝0.15 mL,混匀静置5 min;再加入3 mol·L-1的氢氧化钠溶液1 mL,静置15 min,使用紫外可见分光光度计在波长415 nm处检测吸光值。以芦丁为标准品绘制标准曲线。
1.2.2 NR活性 NR活性检测采用索莱宝公司的硝酸还原酶酶活性检测试剂盒,根据说明书操作。将新鲜小麦幼苗叶片洗净,放入诱导剂应用液中避光浸泡,2 h后取出,滤纸吸干,-20 ℃冷冻30 min。称取约0.1 g样本,加入1 mL提取液,冰浴下研磨,在4 ℃下以4 000×g离心10 min,收集上清液待用。按照说明书设定测定管和空白管,分别依次加入试剂,使用酶标仪测定波长340 nm下的初始吸光值A1,25 ℃反应30 min后再次测定吸光值A2,进而计算酶活性。
1.2.3 NO含量 NO含量测定参考OKANT等[28]的方法。称取0.5 g试验小麦幼苗叶片,加液氮研磨,然后加入3 mL浓度为50 mol·L-1的冷乙酸缓冲液(pH值为3.6,含有4%二乙酸锌),在4 ℃下以10 000×g离心15 min,取上清液。在剩余沉淀中加入1 mL缓冲液,在4 ℃下以10 000×g离心15 min,取其上清液。将2次所取上清液混合,加入0.1 g木炭,涡旋混匀后,在4 ℃下以12 000×g离心10 min,收取最终上清液,待用。取最终上清液1 mL,和1 mL Gress试剂充分混匀,室温30 min后,使用紫外可见分光光度计在波长540 nm处检测样本的吸光值。通过与NaNO2的标准曲线比较计算NO的含量。
1.2.4 H2O2浓度 H2O2含量测定参考王浩[29]的方法。取新鲜小麦幼苗叶片0.2 g,加液氮研磨,然后加入4 mL 0.1%的三氯乙酸,研磨成匀浆。在4 ℃下以12 000×g离心10 min,收集上清液。准备新的离心管,依次向管中加入1 mL上清液,0.5 mL 10 mol·L-1磷酸缓冲液(pH 7),1 mol·L-1的KI溶液1 mL。混匀后,使用紫外可见分光光度计在波长390 nm处检测吸光值。通过与H2O2标准曲线比较计算H2O2的浓度。
1.3 数据分析
使用Excel 2013进行基本的数据处理,用DPS v 14.10对数据进行LSD-二因素有重复试验统计分析。
2 结果与分析
2.1 丛枝真菌对Cd胁迫小麦幼苗叶片类黄酮含量的影响
如图1所示,对照接种丛枝真菌小麦幼苗叶片类黄酮含量比对照小麦幼苗显著上升12.53%;5和10 mg·kg-1Cd胁迫小麦幼苗与对照小麦幼苗比较,5和10 mg·kg-1Cd胁迫小麦幼苗叶片类黄酮含量有所提高;分别对5和10 mg·kg-1Cd胁迫小麦接种丛枝真菌,Cd胁迫接种丛枝真菌小麦幼苗叶片类黄酮含量与同质量浓度Cd胁迫小麦幼苗相比,类黄酮含量变化不显著。结果表明,接种丛枝真菌可以提高Cd胁迫小麦幼苗叶片类黄酮含量。
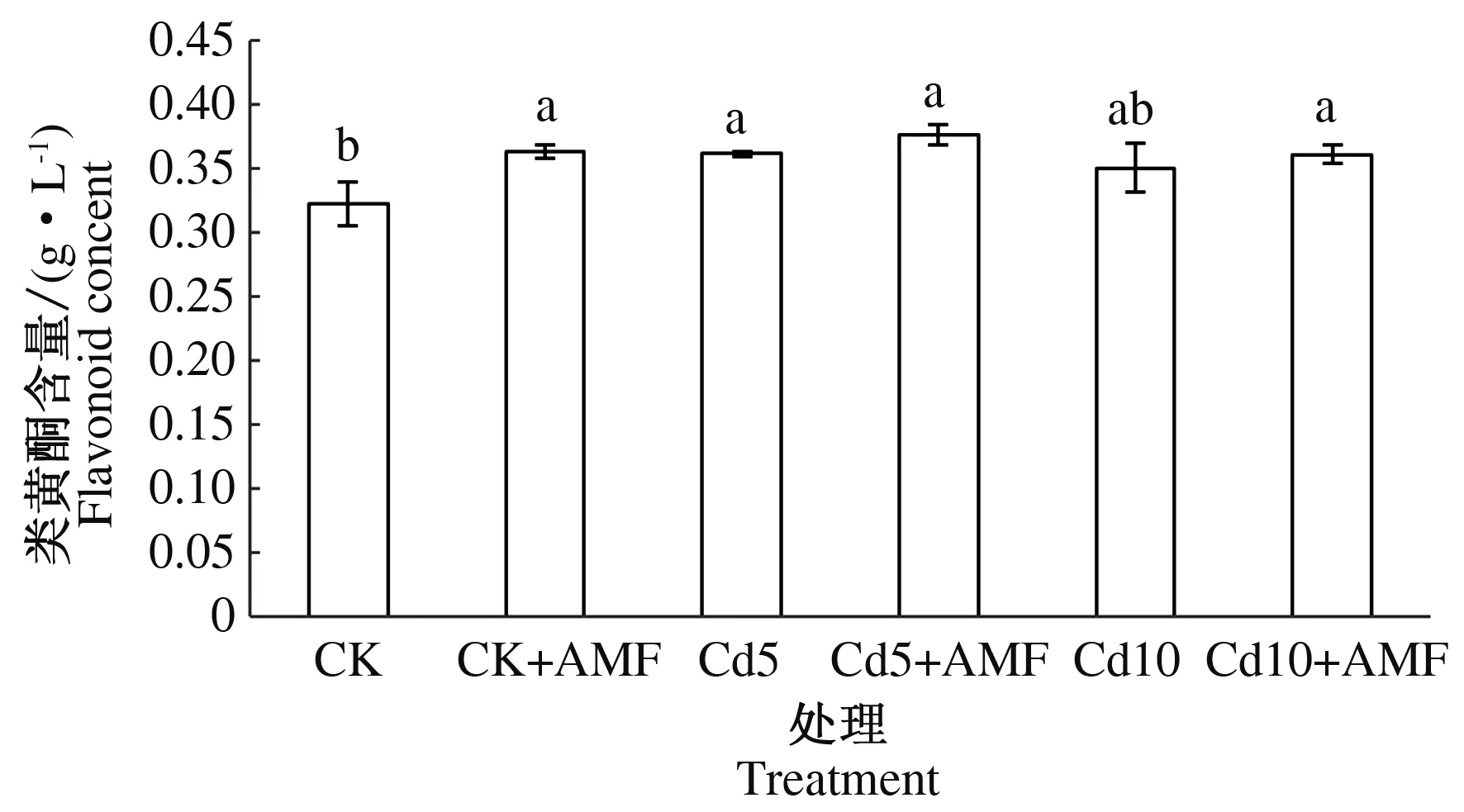
CK:对照;CK+AMF:对照接种丛枝真菌;Cd5:5 mg·kg-1 Cd胁迫;Cd5+AMF:5 mg·kg-1 Cd胁迫接种丛枝真菌;Cd10:10 mg·kg-1 Cd胁迫;Cd10+AMF:10 mg·kg-1 Cd胁迫接种丛枝真菌。不同小写字母表示差异显著(P<0.05)。下同。CK:Control;CK+AMF:Control inoculation;Cd5:5 mg·kg-1 Cd stress;Cd5+AMF:5 mg·kg-1 Cd stress inoculation;Cd10:10 mg·kg-1 Cd stress;Cd10+AMF:10 mg·kg-1 Cd stress inoculation.The different lowercase letters show the significant differences(P<0.05).The same as below.图1 丛枝真菌对Cd胁迫小麦幼苗叶片类黄酮含量的影响Fig.1 Effects of arbuscular mycorrhizal fungi on flavonoid content of wheat seedling leaves under Cd stress
2.2 丛枝真菌对Cd胁迫小麦幼苗叶片NR活性的影响
如图2所示,对照接种丛枝真菌小麦幼苗叶片NR活性是对照小麦幼苗叶片的2.14倍,差异显著;5和10 mg·kg-1Cd胁迫小麦幼苗叶片的NR活性与对照小麦幼苗相比,均有所提高,其中10 mg·kg-1Cd胁迫小麦幼苗叶片的NR活性呈5%显著水平,提高了68.50%;5和10 mg·kg-1Cd胁迫接种丛枝真菌小麦幼苗叶片NR活性分别是同质量浓度Cd胁迫小麦幼苗的1.94,2.03倍,差异显著。结果表明,接种丛枝真菌可以提高Cd胁迫小麦幼苗叶片NR活性。

图2 丛枝真菌对Cd胁迫小麦幼苗叶片NR活性的影响Fig.2 Effects of arbuscular mycorrhizal fungi on nitrate reductase activity in wheat seedling leaves under Cd stress
2.3 丛枝真菌对Cd胁迫小麦幼苗叶片NO含量的影响
如图3所示,对照接种丛枝真菌小麦幼苗NO含量与对照小麦幼苗相比有所提高,差异不显著;5和10 mg·kg-1Cd胁迫小麦幼苗与对照小麦幼苗比较,叶片NO含量均有所提高;而5和10 mg·kg-1Cd胁迫接种丛枝真菌小麦幼苗NO含量分别比同质量浓度Cd胁迫小麦幼苗上升50.70%,35.96%,差异显著。结果表明,接种丛枝真菌可以提高Cd胁迫小麦幼苗叶片NO含量。
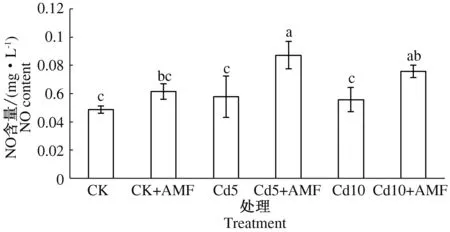
图3 丛枝真菌对Cd胁迫小麦幼苗叶片NO含量的影响Fig.3 Effects of arbuscular mycorrhizal fungi on nitric oxide content in wheat seedling leaves under Cd stress
2.4 丛枝真菌对Cd胁迫小麦幼苗叶片H2O2浓度的影响
如图4所示,对照接种丛枝真菌小麦幼苗H2O2浓度比对照小麦幼苗显著下降31.57%;5和10 mg·kg-1Cd胁迫小麦幼苗H2O2浓度比对照小麦幼苗分别显著上升9.34%,14.19%;5和10 mg·kg-1Cd胁迫接种丛枝真菌小麦幼苗H2O2浓度显著比同质量浓度Cd胁迫小麦幼苗分别下降34.77%,36.07%。结果表明,接种丛枝真菌会降低Cd胁迫小麦幼苗叶片H2O2浓度,缓解Cd胁迫对小麦幼苗造成的氧化伤害。
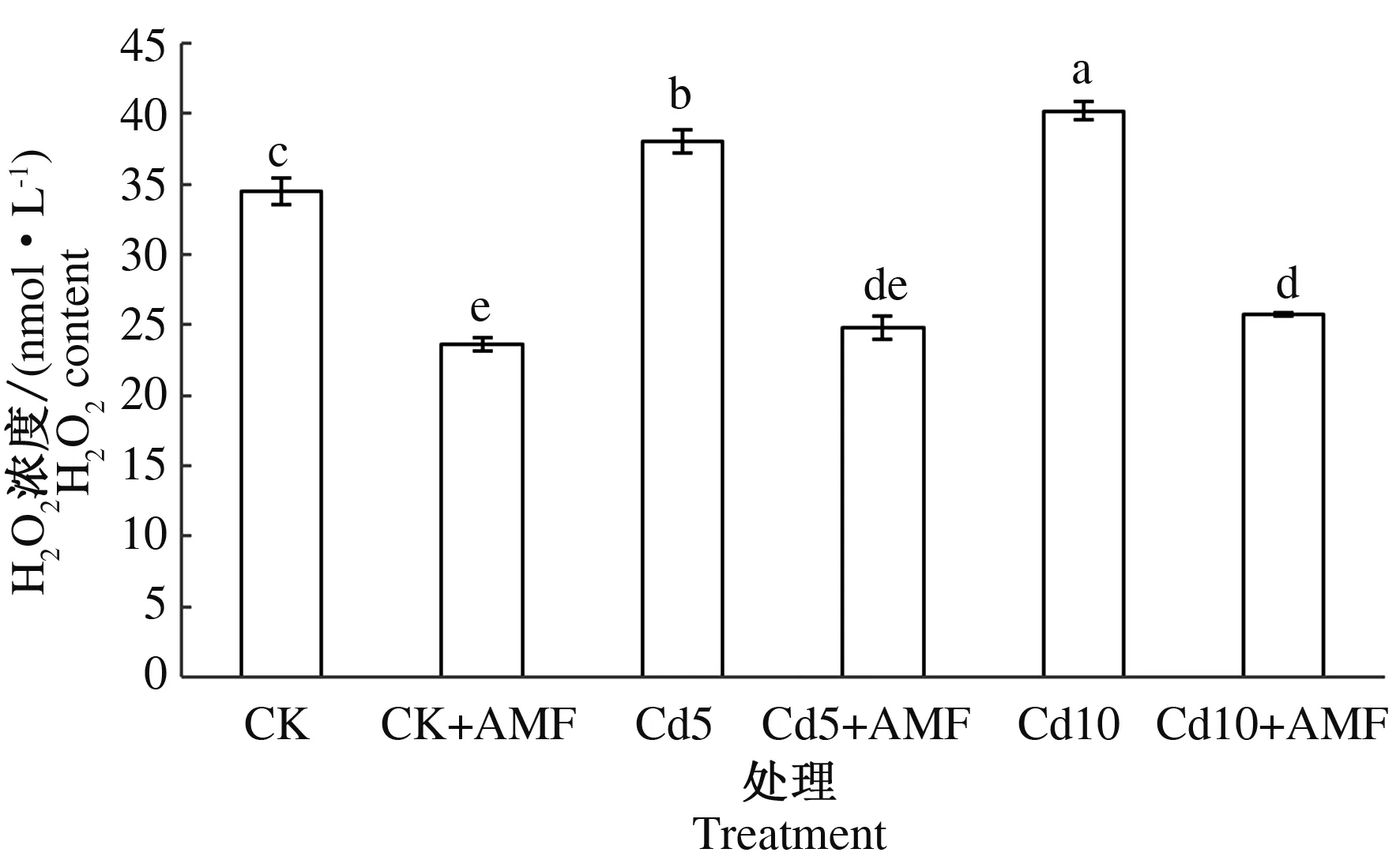
图4 丛枝真菌对Cd胁迫小麦幼苗叶片H2O2浓度的影响Fig.4 Effects of arbuscular mycorrhizal fungi on hydrogen peroxide content in wheat seedling leaves under Cd stress
3 结论与讨论
逆境胁迫下,植物体内会产生大量活性氧自由基,ROS是否会起到破坏性或信号分子的作用,取决于ROS产生和清除之间的微妙平衡。植物已经进化出一个复杂的基于ROS合成、清除和信号物质的调控网络,来介导生物和非生物胁迫反应。类黄酮在保护植物非生物和生物胁迫因素的负面影响方面发挥着主要作用[30]。作为抗氧化物质的类黄酮可直接消除活性氧而保护细胞免受氧化伤害[31]。研究显示,接种丛枝真菌可以提高植物果实中类黄酮(如花青素)水平[32]。本研究结果表明,5和10 mg·kg-1Cd胁迫对小麦幼苗叶片类黄酮的作用不显著;Cd胁迫小麦幼苗接种丛枝真菌较同质量浓度Cd胁迫小麦幼苗,其类黄酮含量有所提高。这与TORRES等[32]研究结果一致。在5和10 mg·kg-1Cd胁迫下,Cd胁迫小麦幼苗和同质量浓度Cd胁迫接种丛枝真菌小麦幼苗叶片相比,10 mg·kg-1Cd胁迫导致小麦幼苗类黄酮含量上升趋势较5 mg·kg-1Cd胁迫小麦幼苗低,可能因为10 mg·kg-1Cd胁迫对植物的伤害增大,接种丛枝真菌虽能提高植株类黄酮含量,但用于清除活性氧的类黄酮消耗增大,所以随着Cd胁迫质量浓度的增加,类黄酮含量上升趋势下降。
本研究结果表明,5和10 mg·kg-1Cd胁迫均显著增加小麦幼苗叶片NR活性,且10 mg·kg-1Cd处理高于5 mg·kg-1Cd处理的NR活性;不同质量浓度Cd胁迫接种丛枝真菌均可以显著提高小麦幼苗叶片NR活性。这与CARAVACA等[33]研究结果一致。由于NR是NO合成的重要酶,其活性提高有助于提高NO含量,后者具有抗氧化功能,可缓解植物的氧化伤害[34]。研究表明,外源NO可降低草莓的MDA(Malondialdehyde)含量和H2O2含量,缓解胁迫造成的氧化伤害[35],而Cd胁迫使植物内源NO含量上升[33]。Cu胁迫也可促进大麦幼苗NO的释放,且NO释放量最高时NR活性最高[36]。本研究结果表明,5和10 mg·kg-1Cd胁迫下,小麦幼苗叶片NR活性和NO含量均有所提高,不同质量浓度Cd胁迫接种丛枝真菌小麦幼苗叶片NR活性和NO含量显著高于同质量浓度Cd胁迫未接种处理。说明接种丛枝真菌可以提高Cd胁迫小麦幼苗的NO浓度,并且通过与H2O2发生反应降低H2O2浓度,从而发挥抗氧化功能,缓解Cd胁迫对小麦幼苗的氧化伤害[37-38]。
Cd胁迫造成小麦幼苗叶片H2O2浓度显著升高,且10 mg·kg-1Cd胁迫H2O2浓度高于5 mg·kg-1Cd胁迫,而2种质量浓度Cd胁迫小麦幼苗分别接种丛枝真菌后H2O2浓度均显著下降。说明接种丛枝真菌可以降低Cd胁迫造成的氧化伤害。本研究表明,丛枝真菌可以通过提高类黄酮和NO含量,降低Cd胁迫产生的过量ROS,缓解Cd胁迫造成的氧化伤害。
