新生儿机械通气撤机失败的影响因素及预测指标分析
2021-04-27朱凤芹徐艳刘文强王军
朱凤芹 徐艳 刘文强 王军
机械通气(Mechanical ventilation,MV)是危重新生儿维持有效呼吸不可缺少的一部分。尽管近年来在使用非侵入性呼吸支持方面取得了巨大进展,但相当一部分极早早产儿和危重疾病新生儿仍需要气管插管和侵入性机械通气。由于长期通气与并发症、死亡率增加等有关[1-4],因此需要早期撤机或拔管。通常,撤机指征的评估主要仍依赖临床医生个人经验,并受血气分析、氧供需求和通气设置的影响[5],然而这些评估往往是主观的、不精确的,缺乏客观的评估方法,并没有减少撤机失败率。既往常规的撤机指征不能完全评估新生儿能否成功撤机,预测撤机的指标在新生儿科缺少数据,使得撤机准备评估,向复杂化迈进。因此,本研究旨在从多方面探讨新生儿撤机失败的影响因素,确定高危因素,寻找预测指标,减少撤机失败率。
资料与方法
一、研究对象
选取徐州医科大学附属医院2015年1月1日至2019年12月31日期间新生儿重症监护病房neonatal intensive care unit(NICU)接受有创机械通气治疗时间≥72 h并存活的新生儿350例为研究对象。按照撤机标准撤机,根据撤机48 h内是否再次插管,分为撤机成功组与撤机失败组。撤机成功组303例,其中男性186例,女性117例;撤机失败组47例,其中男性31例,女性16例。排除标准:① 先天性发育异常如:先天性胸廓及肺发育畸形、复杂型先天性心脏病、多发畸形等;② 神经肌肉疾病、遗传代谢性疾病等;③ 高频通气、意外脱管;④ 机械通气期间死亡或撤机前自动出院;⑤ 撤机前确诊心律失常;⑥ 在撤机时接受任何镇静或血管活性药物;⑦ 因外科手术需要插管。所有数据均来自患儿电子病历和我院NICU临床数据库。徐州医科大学附属医院机构审查委员会批准。
二、研究方法
1 机械通气指征[6]所有新生儿均采用德尔格Babylog 8000呼吸机进行通气,根据2015版新生儿机械通气常规,满足机械通气标准进行上机。
2 撤机指征[6]① 导致机械通气的原发疾病控制并好转;② 自主呼吸恢复,并能维持一定的有效通气量;③ 在同步间歇指令通气(synchronized intermittent mandatory ventilation,SIMV)或压力支持(pressure support ventilation,PSV)等辅助通气时,吸入氧浓度(fraction of inspired oxygen, FiO2)≤0.4, 吸气末峰压(peak inspiratory pressure, PIP)≤18 cmH2O(1 cmH20=0.098 kPa),平均气道压(MAP)<8 cmH2O,呼气末正压(positive end-expiratory pressure, PEEP)≤6 cmH2O等较低通气条件下,动脉血气结果维持正常。
3 撤机失败判定[5, 7]撤离呼吸机后48小时内需要再次插管接有创机械通气。
4 再次插管指征 当出现下列一项或一项以上时需考虑再次插管:① 呼吸功能障碍(低氧血症、高碳酸血症、明显呼吸费力、呼吸衰竭、大量肺不张); ② 动脉血气分析显示pH<7.25,且PCO2>60 mmHg(1 mmHg=0.133 kPa);③ 当FiO2达到60%,氧饱和度仍小于88%;④ 每小时呼吸暂停大于2 次,或任何一次呼吸暂停不能通过刺激缓解,需正压通气才能改善;⑤血流动力学不稳定(如主要脏器大出血、心跳骤停等)。
三、观察指标
两组撤机前观察指标:性别、出生胎龄及体重、Apgar评分1分钟及5分钟、产前激素使用、肺表面活性剂、咖啡因应用、地塞米松使用、地塞米松距离撤机的使用时间、利尿剂、吸痰耐受能力、机械通气时间、撤机时体重、撤机时有无呼吸窘迫、撤机当日液体入量、撤机时自主呼吸频率及心率、有无多脏器损害、有无动脉导管未闭(patent ductus arteriosus,PDA)、有无呼吸机相关性肺炎(ventilator associated pneumonia,VAP)、撤机前机械通气模式(SIMV or PSV)、撤机前呼吸机参数(FiO2、PIP、MAP、PEEP)及血气分析结果(PH、PO2、PCO2、HCO3)。
两组撤机后观察指标:① 无创通气模式:鼻间歇正压通气(nasal intermittent positive pressure ventilation,NIPPV)、持续气道正压通气(continuous positive airway pressure,CPAP)、其他(高流量鼻导管吸氧、低流量鼻导管吸氧或头罩吸氧);② 是否雾化。
其中吸痰耐受能力[8]:① 能耐受:吸痰后血氧饱和度(SPO2)在10 s内能迅速上升至85%以上;② 不能耐受:吸痰后SPO2在10 s或更长时间不能上升至85%。
四、统计学分析

结 果
一、两组撤机前一般情况及临床变量因素比较
出生胎龄<28、28~32、32~34、35~36、≥37周撤机失败率发生率分别为50.0%(4/8)、20.0%(22/110)、12.6%(11/87)、7.8%(6/77)、5.9%(4/68);出生体重<1 500、1 500~2 500、≥2 500 g撤机失败发生率为23.1%(21/91)、12.3%(19/155)、6.7%(7/104);撤机失败组出生胎龄及体重、Apgar评分1分钟及5分钟、撤机时体重均明显低于撤机成功组,机械通气时间、撤机当日液体入量、撤机时自主呼吸频率及心率均明显高于撤机成功组,差异均有统计学意义(P<0.05)。两组性别、产前激素使用、肺表面活性剂、咖啡因应用、地塞米松使用、地塞米松距离撤机使用时间、利尿剂、PDA、VAP差异均无统计学意义(P>0.05)。撤机失败组吸痰耐受能力差、撤机时呼吸窘迫、多脏器损害均明显高于撤机成功组,差异均有统计学意义(P<0.05)(见表1)。
二、两组撤机前通气设置及血气分析结果因素比较
两组撤机前机械通气模式及参数差异均无统计学意义(P>0.05)。撤机失败组血气分析中PH值低于撤机成功组,PCO2水平明显高于撤机成功组,差异均有统计学意义(P<0.05)(见表2)。
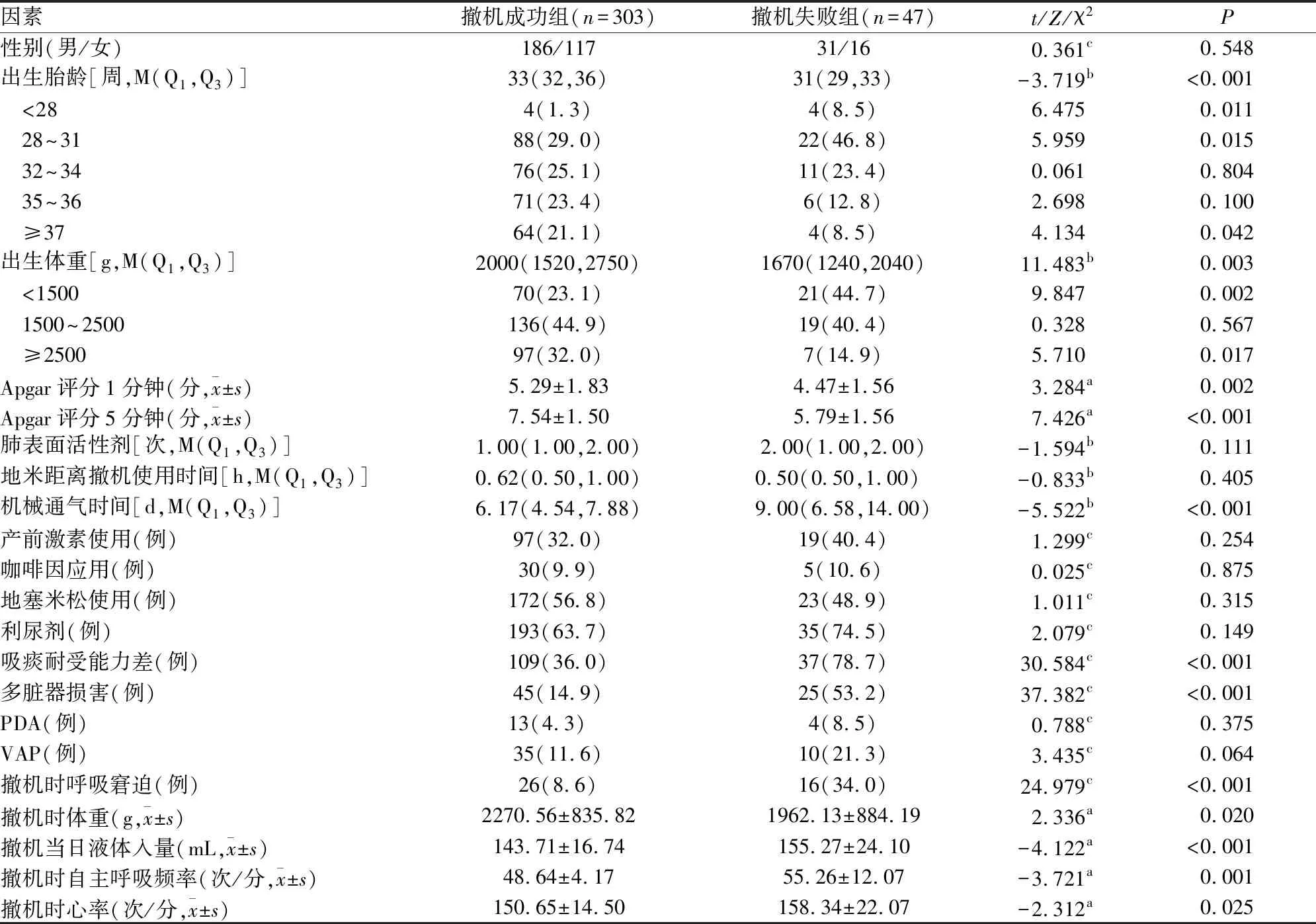
表1 两组患儿撤机前一般情况及临床变量因素比较

表2 两组患儿撤机前通气设置及血气分析结果因素比较
三、两组撤机后因素比较
撤机成功组与失败组撤机后无创通气模式选择不同,差异有统计学意义(χ2=6.430,P=0.040),且撤机失败组CPAP模式占比明显低于撤机成功组,差异有统计学意义(P<0.05);撤机成功组与失败组NIPPV模式及其他模式差异均无统计学意义(P>0.05)。撤机后雾化差异无统计学意义(P>0.05)(见表3)。

表3 两组患儿撤机后因素比较(例)
四、影响撤机失败的高危因素
以撤机失败为因变量,以表(1、2、3)中差异有统计学的因素为自变量,进行多因素logistic回归分析。结果显示,机械通气时间长、吸痰耐受能力差、多脏器损害、高PCO2、撤机时自主呼吸频率及心率快是撤机失败的高危因素(P<0.05)(见表4)。

表4 影响患儿撤机失败的高危因素
五、撤机失败相关因素的预测价值
ROC曲线下面积AUC分析示PCO2预测效果显著。利用这个变量建立预测撤机失败的模型,该模型ROC曲线下面积AUC为0.819,最佳截断值为47.5 mmHg(见表5及图1)。

表5 撤机失败相关因素的预测价值
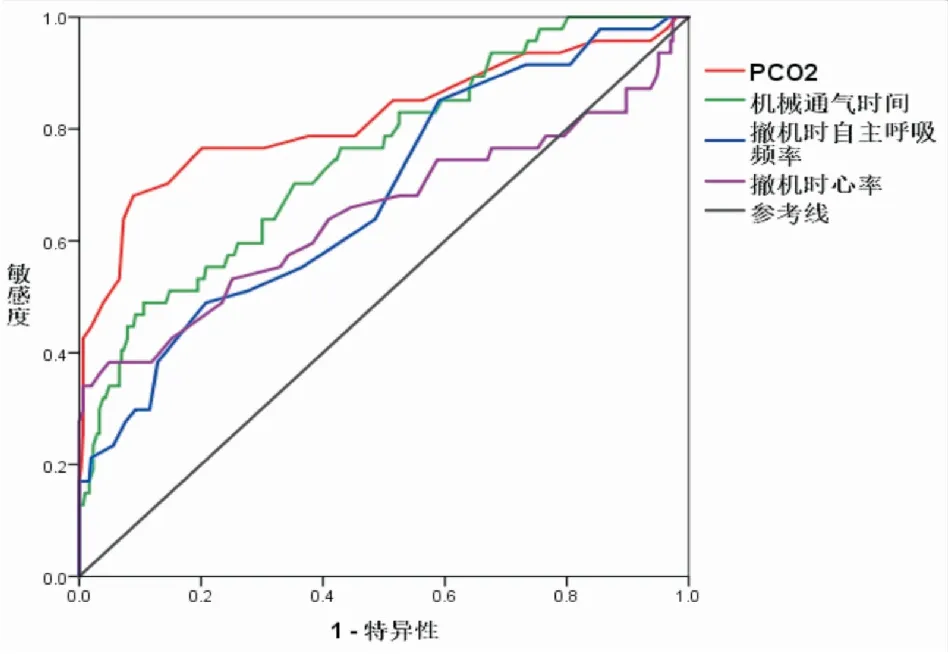
图1 相关因素预测撤机失败的ROC曲线
讨 论
本研究从多方面分析撤机失败的影响因素,因为确定新生儿撤机的理想时间是相当困难且是有争议的主题。本研究在符合撤机标准下撤机,撤机失败率为13.4%,略低于既往的报道[3-4, 7],这种差异可能是人口特征及临床实践的差异和文献中对撤机失败的不同定义[7]。影响撤机失败的因素众多,机械通气时间长、吸痰耐受能力差、多脏器损害、高PCO2、撤机时自主呼吸频率及心率快是撤机失败的高危因素。PCO2预测撤机失败价值高,曲线下面积为0.819。
机械通气时间长是撤机失败的高危因素。单因素分析撤机失败,在胎龄及体重较低的婴儿中发生率高,与既往的研究一致[3-4,9],这提示撤机失败是呼吸发育不成熟的标志,可能需要长时间机械通气。另一个可能的原因是长时间的机械通气和随之而来的呼吸机相关肺损伤,进一步加重了潜在的肺部疾病。虽然机械通气时间是新生儿VAP的危险因素[10],尽管我们研究中机械通气时间较长,但两组VAP发生率无统计学差异,与刘宏伟等[11]的研究不同。这种差异可能与新生儿VAP定义不明确导致新生儿医生缺乏知识以及临床实践差异有关[10]。所以,制定机械通气撤机策略及时拔管、大量使用无创通气,减少撤机失败风险。
机械通气时进行气管插管内吸痰是清除呼吸道分泌物、保持气道通畅、保证足够氧合的重要措施[12]。在成人,吸痰耐受能力根据患者吸痰后临床表现可分度及评分[13],但对于新生儿,吸痰后一些临床表现不如成人明显。尽管气管内吸痰广泛应用,但新生儿对吸痰后的客观反应资料却很少。我们的回归分析显示吸痰耐受能力差是撤机失败的高危因素。在撤机阶段吸痰后两组SPO2变化不同,一方面与吸痰本身导致肺内富氧气体被抽出、氧储备量减少有关[8, 12],另一方面可能是因脱离呼吸机而中断PEEP发生部分肺不张导致低氧血症,间接反应撤机阶段的不适应。这一客观发现表明,吸痰耐受能力可为新生儿撤机阶段客观评估提供了新的研究空间。
多脏器损害是撤机失败的高危因素,与刘宏伟等[11]的研究一致。机械通气期间伴有多脏器损害可能会给呼吸、循环及其他多系统等造成影响,内环境失衡,导致撤机失败。因此,预见性评估新生儿疾病的发展,重要脏器功能及生命体征动态监测,才能有助于稳定撤机。
大多数临床医生撤机前考虑监测血气分析[5]。我们发现高PCO2是撤机失败的高危因素,与Chawla等[3]、Manley等[4]的报道一致。机械通气伴有高碳酸血症的婴儿不太可能产生足够的自发潮气量来成功地撤机,这表明,如果婴儿达到撤机标准,但血气PCO2较高(大于47.5 mmHg),我们可以考虑推迟撤机。
撤机过程代表了一个从机器辅助呼吸到自主呼吸的转变时期,与自主活动变化有关[14]。我们研究发现,撤机时安静状态下,自主呼吸频率及心率快是撤机失败的高危因素。这显示撤机阶段婴儿内在行为变化与撤机失败存在一种关联。目前,关于撤机成功与失败的高质量预测指标资料缺乏,Shalish等[15]的一项荟萃分析显示自主呼吸试验(SBT)预测拔管敏感性高,但特异性有限。虽然呼吸及心率次数是生理稳定性的粗略衡量,但两者ROC曲线分析显示特异性较高。Draghici等[14]利用心率与心电图R波之间的间隔呈逆函数定义了心率变异性,Sullivan等[16]发现心率变异性小与呼吸系统疾病恶化有关,且通常在一些临床症状被识别之前出现,随后Shalish 等[17]也通过心肺行为自动分析测量来预测极早早产儿拔管准备情况。我们的研究撤机前未常规进行SBT程序化脱机,失败组心肺变化反应了撤机前SBT试验的不耐受性,为未来进行SBT指导撤机提供有力的数据参考,心肺等生理变量测量也可为早期预防撤机失败的干预提供了机会。
我们的研究是一项回顾性单中心研究,研究对象数量相对有限。虽然通气方面有广泛的指导,但采集血气分析到撤机的时间间隔也没有规范,采集过程可能因不稳定因素(比如哭闹、疼痛等)而干扰结果。尽管有这些局限性,我们的研究还是有一些优势。这是从更多可干预方面评估新生儿撤机成功与失败结果的研究。我们的调查结果,应被用来进一步指导临床、刺激研究,利用这些人口学特征及临床数据建立撤机准备评估,为未来旨在减少撤机失败率的各种干预措施的研究提供风险信息。
综上所述,撤机失败的影响因素众多,多种因素同时存在,减少机械通气时间,临床症状合理掌控,纠正酸碱紊乱,维持自主活动稳定,预测指标评估撤机准备,可减少撤机失败率,但仍需进一步大样本对照试验及多中心验证。
