七叶皂苷A在小鼠软骨细胞及骨关节炎中的作用及相关分子机制
2021-04-25万锐杰
王 淼,万锐杰,刘 伟,彭 科
骨关节炎(osteoarthritis,OA)是老年人群中最常见的关节退行性疾病,据统计,致使成人残疾的第四大原因也是骨关节炎[1-2]。OA发病过程涉及关节软骨退化和软骨下骨的重塑,其潜在病因包括炎症、机械损伤、氧化应激、衰老、肥胖和糖尿病,这些都会导致OA的发生发展[3]。软骨细胞作为关节软骨中的唯一细胞,在OA发展中起关键作用,预防和治疗OA的策略是抑制软骨细胞降解和破骨细胞的生成[4]。
近年来,从传统草药植物中提取有效成分在退化性炎症疾病的研究中引起了广泛关注。七叶皂苷是从七叶树种子中提取的三萜皂苷类化合物,七叶皂苷A(Escin A,EsA)是其主要的活性成分[5]。研究表明,七叶皂苷具有抗病毒、抗炎、抗肿瘤以及调节免疫等作用,其中,抗炎特性可能与其抑制核因子-κB(NF-κB)活化和MAPK磷酸化有关,NF-κB信号通路在OA的病理过程中起着至关重要的作用,在OA的关节软骨及软骨下骨中被激活,也是诱导各种促炎性细胞因子产生的基础,包括白细胞介素(IL)-1β、肿瘤坏死因子(TNF)-α、基质金属蛋白酶(MMP)及聚蛋白多糖酶(ADAMTS5)等[6]。在骨科疾病中,七叶皂苷能够促进脊髓损伤后修复,具体表现为减轻自由基的氧化损伤、缩小空洞的面积以及抑制炎症细胞的活化与浸润[7]。此外,七叶皂苷钠对骨折后肿胀也具有良好的治疗作用[8]。然而,有关EsA在OA中发挥的作用与相关机制的研究相对较少。本研究通过体内与体外实验研究EsA在OA中的作用,并对其内在机制进行了初步探究。
1 材料与方法
1.1 实验动物 清洁级健康雄性C57BL/6小鼠购于重庆医科大学实验动物中心。将小鼠放在光照、黑暗12 h交替,温度为20~25 ℃,相对湿度为45%~50%的动物饲养箱中饲养,期间自由饮水和摄食。
1.2 主要试剂 EsA(≥98%,上海泽叶生物科技有限公司),IL-1β(美国PeproTech公司),胎牛血清、青霉素/链霉素和DMEM/F12培养基(美国Sigma公司),ELISA试剂盒(上海碧云天生物研究所),RIPA裂解液、ECL显色液及HE染色试剂盒(北京康为世纪生物公司),BCA蛋白试剂盒(上海羽朵生物科技有限公司),TRIzol试剂、Prime ScriptTMRT reagent试剂盒与SYBR Premix Ex TaqTMII试剂盒(日本Takara公司),免疫荧光染色试剂与番红O固绿染液(北京索莱宝科技有限公司),抗体缺氧诱导因子(HIF)-2α、Collagen II、MMP-9、p65、p-p65、IkBα 与 β-actin(美国Abcam公司),辣根过氧化物酶标记的羊抗鼠IgG抗体(美国Santa Cruz公司)。
1.3 方法
1.3.1 小鼠原代软骨细胞的培养 将8只7日龄C57BL/6小鼠通过腹膜内注射过量戊巴比妥钠处死,在无菌环境下分离取小鼠双侧膝关节胫骨坪、股骨髁状突及髌骨内侧透明软骨组织,将其剪切成1 mm×1 mm×1 mm的小块,加入0.1%II型胶原酶在37℃下消化3 h,以1 500 r/min离心3 min,弃去上清液,加入含10%胎牛血清和1%青霉素/链霉素的DMEM/F12培养基重悬细胞,在37 ℃、5% CO2培养箱中培养,每两天更换一次培养基。当细胞密度达到80%~90%时,使用0.25%胰蛋白酶消化传代。
1.3.2 细胞活性测定 将对数生长期的软骨细胞以1×104个/孔均匀铺于96孔板中,在37 ℃、5% CO2培养箱中过夜培养。使用含10 mg/LIL-1β及不同浓度(10、50、100 μmol/L)EsA处理细胞24 h和48 h,IL-1β组加含10 mg/LIL-1β的培养液培养,对照组不进行任何处理。每孔加10 μLCCK-8溶液,放在培养箱中培养2 h,采用酶标仪在450 nm处检测各组吸光度值。
1.3.3 ELISA检测TNF-α和IL-6含量 将软骨细胞使用含10 mg/L的IL-1β及不同浓度(10、50、100μmol/L)的EsA处理细胞48 h,IL-1β组细胞加入含10 mg/L IL-1β的培养液培养48 h,对照组细胞正常培养48 h。收集各组细胞,在离心机中以12 000 r/min离心20 min,分离上清液,ELISA试剂盒检测上清液中TNF-α和IL-6含量,用酶标仪检测450 nm处吸光度值,计算各因子含量。
1.3.4 实时定量PCR 将软骨细胞按1.3.3进行不同处理后收集各组细胞,使用TRIzol试剂提取软骨细胞总RNA,采用NanoDrop 2000测定RNA浓度与纯度。根据反转录试剂盒合成cDNA,以cDNA为模版,采用SYBR Premix Ex TaqⅡ试剂盒检测各基因mRNA表达,以β-actin为内参。反应条件为95℃预变性 3 min(1个循环),95℃变性 15 s,60℃退火 15 s,72℃延伸40 s(42个循环)。采用2-△△Ct法计算各检测目的基因mRNA表达。引物由上海生工生物公司合成,引物序列如下,MMP-13上游:5'-TTGTGGCGATTGCAGGTCT-3',下游:5'-CGT CAGAAGAAACCGAAC-3';ADAMTS5上 游:5'-GTCTCAGCATTGACCTCG-3',下游:5'-AGGG AGTTCCATCTGCCA-3';β-actin上游:5'-CCAA CTGGGACGACATGGA-3',下游:5'-GTGGTGAAG CTGTAGCC-3'。
1.3.5 Western blotting 将软骨细胞按1.3.3进行不同处理后收集各组细胞,加入RIPA裂解液,在冰上裂解15 min,离心机中以12 000 r/min离心30 min,取上清液检测蛋白浓度。蛋白质样品经10% SDS-PAGE分离并转移到PVDF膜上。TBST缓冲液洗膜,在5%脱脂奶粉液中常温封闭1 h,加入稀释的一抗在4 ℃下孵育过夜。次日,TBST缓冲液清洗后,加二抗在室温下孵育2 h。TBST缓冲液洗膜,滴加ECL发光试剂曝光,使用Quantity ONE软件检测各条带灰度值。
1.3.6 免疫荧光染色 将软骨细胞均匀铺于含爬片的24孔板中,在37 ℃、5% CO2培养箱过夜培养,进行相应处理后,用PBS洗涤,室温下采用4%多聚甲醛固定15 min,0.1% Triton X-100通透处理5 min,10%山羊血清封闭细胞2 h。PBS洗涤,滴加兔多克隆抗体p65(1∶200),4℃孵育过夜。洗涤玻片,滴加Alexa Fluor 488标记山羊抗兔IgG(1∶200)于室温下孵育45 min,加DAPI避光孵育10 min,PBS清洗,封片。使用荧光显微镜进行观察并拍照。
1.3.7 氧化应激指标测定 将软骨细胞按1.3.3进行不同处理后收集各组细胞,加入PBS清洗细胞,在4℃以12 000 r/min离心3 min,沉淀中加入细胞裂解液在冰上裂解15 min,超声处理后将裂解液在4℃以12 000 r/min离心5 min,取上清液按照超氧化物歧化酶(SOD)、过氧化氢酶(CAT)及丙二醛(MDA)试剂盒说明进行测定。
1.3.8 小鼠OA模型构建 将60只12周龄的C57BL/6雄性小鼠随机分为4组(假手术组、OA组、OA+低剂量EsA组和OA+高剂量EsA组),每组15只,根据先前文献[9]建立了小鼠OA模型。小鼠腹膜内注射2%戊巴比妥钠(40 mg/kg)麻醉,75%乙醇消毒后,无菌环境下于膝关节内侧约1 cm纵行切口,打开关节腔,切断前交叉韧带,逐层缝合伤口,术后连续4天肌内注射氨苄青霉素,假手术组除不切断外其他操作均相同。术后第2天,OA+低剂量EsA组、OA+高剂量EsA组小鼠分别按照5 mg/kg、10 mg/kg于腹膜注射EsA,每隔一天注射1次,持续6周。
1.3.9 骨密度测定 治疗6周后,处死所有小鼠,取两侧股骨,剔除股骨周围软组织,采用美国LUNAR公司双能X线骨密度测量仪检测小鼠股骨近端的骨密度。
1.3.10 组织病理学分析 采集小鼠膝关节组织,将其置于4%多聚甲醛中固定24 h后,放入10%EDTA溶液(pH=8.0)中脱钙1个月。组织使用梯度乙醇脱水后,进行石蜡包埋,并切成5 μm厚的切片,进行HE染色。切片在二甲苯中脱蜡,梯度乙醇复水,加苏木精染色5 min,0.1%氨水中分色数秒钟,放入伊红染液中染色2 min,经乙醇脱水、二甲苯透明后,中性树胶封片,在光学显微镜下观察软骨区域组织病理形态学改变。
1.3.11 番红O固绿染色 将组织切片常规脱蜡水化后,PBS冲洗。加入苏木素染核3 min,流水下冲洗,盐酸乙醇分化,流水冲洗后,滴加固绿染色5 min,接着加入1%乙酸固色。流水再次冲洗,滴加番红O染色数秒,进行脱水、透明后,滴加中性树胶进行封片,在光学显微镜下观察图像。

2 结果
2.1 EsA对IL-1β刺激的软骨细胞存活率的影响与对照组比较,IL-1β刺激下细胞存活率显著下降(P<0.05);经10、50、100μmol/LEsA处理后24 h和48 h,细胞存活率均高于IL-1β组(P<0.05),其中,在50 μmol/LEsA作用48 h细胞存活率最高,见表1。

表1 各组软骨细胞存活率比较
2.2 EsA对IL-1β诱导的炎症反应的影响IL-1β诱导下TNF-α和IL-6含量较对照组显著升高(P<0.05);与IL-1β组比较,不同浓度EsA(10、50、100 μmol/L)作用均使TNF-α和IL-6含量显著降低(P<0.05),见表2。

表2 各组软骨细胞上清液TNF-α和IL-6含量比较
2.3 EsA对IL-1β诱导的软骨细胞外基质合成及降解的影响 与对照组比较,IL-1β诱导下细胞中MMP-13和ADAMTS-5 mRNA表达显著升高(P<0.05);在不同浓度 EsA(10、50、100 μmol/L)作用下,MMP-13和ADAMTS-5 mRNA表达较IL-1β 组显著降低(P<0.05),见表 3。IL-1β诱导下Collagen II蛋白表达显著下降(P<0.05),MMP-9蛋白表达显著升高(P<0.05);在不同浓度EsA(10、50、100 μmol/L)作用下,Collagen II蛋白表达升高,MMP-9蛋白表达降低(P<0.05),见表3、图1。

图1 Western blotting检测Collagen II与MMP-9蛋白表达

表3 各组软骨细胞中MMP-13、ADAMTS-5 mRNA与Collagen II、MMP-9蛋白表达比较
2.4 EsA抑制了软骨细胞中IL-1β诱导的HIF-2α与NF-κB信号通路激活 与对照组比较,IL-1β组p-p65、HIF-2α蛋白表达显著升高,IκBα蛋白表达显著下降(P<0.05);与IL-1β组比较,经不同浓度EsA(10、50、100μmol/L)处理的细胞中IκBα蛋白表达显著升高(P<0.05),而 p-p65与HIF-2α的蛋白表达显著降低(P<0.05);p65蛋白在各处理组软骨细胞中的表达差异无统计学意义(P>0.05),见表4、图2。

表4 各组软骨细胞中p-p65、p65、IκBα与HIF-2α蛋白表达比较

图2 Western blotting检测p-p65、p65、IκBα与HIF-2α蛋白表达
与对照组比较,IL-1β刺激后细胞核显示出高密度荧光,而细胞质显示出较少的荧光,表明p65被激活并且完成了核易位;与IL-1β组比较,使用50 μmol/LEsA处理细胞的细胞核荧光强度明显下降,说明p65激活受到抑制,见图3。

图3 免疫荧光染色检测细胞中p65表达
2.5 EsA对抗氧化标记物的影响 与对照组比较,软骨细胞经过IL-1β诱导后,MDA水平显著升高(P<0.05),SOD和CAT活性较对照组显著下降(P<0.05),而经过不同浓度EsA(10、50、100 μmol/L)处理的细胞,MDA水平显著下降,SOD和CAT活性显著升高(P<0.05),见图4。

图4 各组软骨细胞中SOD、CAT与MDA活性比较
2.6 EsA对OA小鼠骨密度的影响 与假手术组比较,OA组小鼠股骨骨密度值明显降低(P<0.05);与OA组比较,OA+低剂量EsA组及OA+高剂量EsA组的骨密度值均明显升高(P<0.05),见图5。
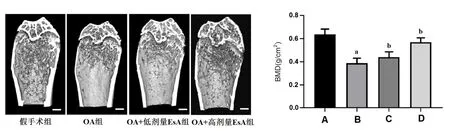
图5 各组小鼠骨密度检测
2.7 EsA对OA小鼠膝关节组织病理形态变化的影响 假手术组小鼠膝关节软骨组织未见明显缺损,细胞排列整齐,番红O染色正常;OA组软骨破坏严重,细胞减少,番红O着色较浅;在高、低剂量EsA作用下,小鼠膝关节软骨破坏得以改善,细胞数目增加,且在高剂量作用下改善更明显,见图6、图7。

图6 HE染色观察各组小鼠膝关节组织病变

图7 番红O固绿染色观察各组小鼠膝关节组织病变
3 讨论
OA作为一种常见的致残性关节疾病,其主要表现为软骨细胞的行为学改变引起的软骨退化[2]。OA反映了软骨细胞基质合成代谢与分解代谢过程之间的失衡,通常可调节细胞外基质(ECM)蛋白如II型胶原蛋白的合成与分解代谢过程如MMP来维持软骨重塑和修复,并通过含血小板结合蛋白基序的去整合素和金属蛋白酶的ADAMTS来降解ECM以维持其平衡[10]。在OA期间,由于炎症和代谢等因素相关的复杂机制,ECM的失衡可引起关节软骨破裂、软骨下骨损伤和滑膜发炎,最终致使滑膜关节结构破坏[11-12]。
OA是由多种炎性因子介导的无菌性炎症疾病[13]。研究表明,IL-1β在OA病程中起关键作用,能够介导其他炎性因子的产生,刺激软骨细胞合成和分泌MMPs,并抑制软骨Ⅱ型胶原的表达[14]。而聚集蛋白聚糖和II型胶原蛋白的含量降低以及MMPs和促炎细胞因子的表达增加,都是OA的标志性特征[15]。本研究通过体外IL-1β 刺激软骨细胞实验观察炎性因子TNF-α和IL-6含量,MMP-13和ADAMTS-5 mRNA的表达以及Collagen-II、MMP-9的蛋白水平,结果显示EsA可抑制软骨细胞中TNF-α和IL-6含量,下调MMP-13、ADAMTS-5mRNA和MMP-9蛋白表达水平,并上调Collagen-II蛋白表达水平。
NF-κB是与炎症密切相关的转录因子,能够调节一系列炎症介质的产生,这些介质在OA过程中起着重要的作用[16]。在正常状态下,NF-κB和IκB紧密结合在细胞质中,在IL-1β刺激下IκB会降解,而磷酸化的NF-κB进入细胞核可诱导一些炎症因子表达。因此,抑制NF-κB活化是治疗炎性疾病的有效方法[17]。研究显示,HIF-2α在OA软骨中呈现高表达,并通过诱导基质降解酶的表达而促进OA的发展[18-19]。本研究发现EsA可抑制NF-κB通路的激活。HIF-2α是OA过程中的分解代谢因子,可直接诱导分解因子在软骨细胞中表达。IL-1β刺激的软骨细胞中HIF-2α蛋白表达升高,而EsA可抑制HIF-2α蛋白表达。
在正常情况下,机体内存在的抗氧化酶能够清除体内过量的氧自由基,从而维持氧化平衡状态。SOD和CAT作为主要的抗氧化酶,在机体内氧化与抗氧化平衡中起着重要作用[20-21]。MDA是机体过氧化最重要的产物之一,其水平升高标志着氧化应激水平升高,能够加剧细胞膜的损伤[22]。目前,氧化应激反应已成为OA研究领域的热点,使用抗氧化剂能够保护软骨细胞免受活性氧损害[23]。本研究中,经过EsA处理的细胞中MDA水平下降,而SOD和CAT活性均升高。说明EsA可能具有抗OA氧化应激的作用。
为进一步说明EsA对OA进程的影响,本研究通过建立小鼠OA模型初步探究了EsA在机体内的作用。目前,利用动物来制备OA模型以探究发病机制与防治措施,主要动物以兔、鼠居多。本研究选择C57BL/6小鼠为造模对象,主要原因是:1)小鼠关节组织结构与软骨凋亡方式与人类关节相似;2)个体较小,操作方便;3)关节软骨较小且相对脆弱,刺激后容易产生病理变化;4)该品系小鼠能够自发产生类似膝骨OA的改变,已有多项研究使用C57BL/6小鼠来构建OA模型进行实验研究[24]。本实验通过制备小鼠OA模型并给予七叶皂苷治疗后,发现经低、高剂量EsA治疗的OA小鼠膝关节软骨破坏均得到了明显改善。结合上述体外研究结果,推测EsA对OA小鼠具有一定的治疗作用,可能与其发挥的抗炎、抗氧化作用有关。在OA中关节局部骨密度水平是讨论的热点内容,关于OA膝关节中骨密度变化检测结果存在一定差别,但绝大数研究发现OA中膝关节局部如股骨内侧髁、胫骨内外侧的骨密度均是降低的,临床研究结果也显示,骨密度水平越低,疼痛症状越严重[25]。本研究结果也显示,在OA小鼠中骨密度下降,而经过EsA治疗后股骨骨密度升高,进一步说明了EsA对OA具有治疗作用。
综上,本研究通过体内、外实验探讨了EsA在小鼠软骨细胞以及OA进程中的作用,表明EsA能够通过抑制HIF-2α表达与NF-κB信号通路的活化,并且发挥抗氧化活性来抑制小鼠OA进展,由此表明EsA对治疗OA具有一定的潜在作用,为后续研究奠定了实验基础。
