施氏假单胞菌在玉米根际的固氮效率和促生效果研究
2021-04-25杨华李江张维周正富燕永亮郭嘉刘相国郝东云林敏柯秀彬
杨华, 李江, 张维, 周正富, 燕永亮, 郭嘉,刘相国, 郝东云, 林敏, 柯秀彬*
(1.中国农业科学院生物技术研究所, 北京 100081; 2.西南科技大学生命科学与工程学院, 四川 绵阳 621010; 3.吉林省农业科学院农业生物技术研究所, 长春 130033)
氮素是土壤中的主要养分限制因子之一,氮肥投入是农业高产的必要途径[1]。中国已成为世界上较大的化肥生产国和消费国之一,导致我国氮肥过度使用的一个重要原因是我国农作物氮肥利用效率普遍不高[2]。由于化肥利用率较低,氮肥通过挥发和淋溶等途径损失数量巨大,引起如温室气体排放、水体富营养化等一系列环境问题[3-4]。面对人口压力,中国农业在未来发展中面临着既要保持高产,又要减少农田面源污染的双重挑战,如何提高氮肥利用率并降低农业生产中对氮肥的依赖,对于我国粮食安全和节能减排的可持续发展战略都具有十分重要的意义。
植物根际是宿主植物和微生物相互作用的主要活动区[5],生存于植物根际的促生菌能直接或间接地促进或调节植物生长[6]。联合固氮菌属于植物促生菌的范畴,广泛存在于非豆科植物(玉米和水稻等)根际,与宿主作物形成一个复杂的根际固氮体系[7-8]。联合固氮菌促进植物生长的机理分为直接作用和间接作用。直接作用通过生物固氮为植物提供氮素、产生植物激素或产生铁载体和各类维他命物质以及通过磷元素的增溶作用来促进植物生长[9]。间接作用是通过诱导植物产生植物激素、改善植物对矿物质的利用率、抑制植物病原体或诱导植物产生拮抗物质等来促进植物生长。因此,通过根际联合固氮作用为农作物提供氮源、部分或完全替代化学氮肥,是农业生产中最经济、最环保和最高效的氮素供应方式。鉴于联合固氮作用在农作物节肥增产方面具有巨大的应用潜力,以联合固氮菌为有效菌种并开发研制的微生物肥料已经广泛应用在田间接种。
固氮施氏假单胞菌(Pseudomonasstutzeri)A1501分离自我国南方水稻根际,属于模式根际联合固氮菌,具有高效固氮活力和根际定殖优势[10]。已有研究表明,野生型A1501能够显著促进水稻和玉米的生长,并通过生物固氮为宿主植物提供氮素[11-12]。但是野生型的根际联合固氮受环境因素影响大,具有固氮效率不高和田间接种不稳定等缺陷。针对这些缺陷,可采取如下策略:一方面应用基因工程构建耐铵、泌铵型联合固氮菌,将固定的铵分泌出菌体外;另一方面通过分子遗传学手段获得转基因氮高效利用玉米品系改良作物对铵的吸收效率,通过微生物-植物相互作用建立根际高效固氮体系,进一步探究根际固氮与植物促生效果的相互关系,实现微生物高效固氮和植物高效利用氮。因此,本研究利用转基因氮高效利用玉米和固氮施氏假单胞菌野生型及泌铵工程菌构建高效固氮体系,在温室条件下评价固氮菌株对玉米的促生效果,并利用15N稳定性同位素稀释法测定根际生物固氮量,以期为完善根际高效联合固氮体系构建,促进农田生态系统的良性发展以及微生物肥料开发提供理论依据。
1 材料与方法
1.1 供试菌株及活化
固氮施氏假单胞菌A1501具有高效固氮能力,属于革兰氏阴性菌,菌体呈杆状[13];在野生型A1501铵转运载体基因amtB1/amtB2双缺失突变株及固氮酶的正调节基因nifA组成型质粒pVA3基础上,通过三亲接合方法[14]获得泌铵工程菌1568/pVA3;突变株1502为对照菌株,其敲除了固氮功能基因nifH,丧失固氮能力,以上菌株均为本实验保存。
菌株在LB培养基中过夜培养后涂平板划线培养,检测菌株的生长曲线、固氮酶活和泌铵能力等生理性状,再转接至LB液体培养基中震荡培养至OD6001.0。菌液6 000 r·min-1离心10 min,弃上清液后用等量0.8%生理盐水重悬备用。
1.2 供试菌株生理活性测定
1.2.1菌株培养挑取待测菌株接种于含对应抗生素的LB 液体培养基中,30 ℃、220 r·min-1振荡培养过夜。4 ℃、4 000 r·min-1离心10 min 收集培养过夜的菌株,经0.85%的NaCl 溶液洗涤菌体2次,转接至A15培养基中[15],调整初始OD600至0.1,30 ℃、200 r·min-1振荡培养,每隔2 h取样测定菌株的OD600,绘制生长曲线。
1.2.2固氮酶活性测定取10 mL过夜培养的菌液,6 000 r·min-1离心10 min,再使用0.85%的NaCl溶液悬浮洗涤菌体沉淀2次,取1 mL OD600为1.0的菌液转接至装有9 mL A15无氮源培养基的三角瓶中,初始OD600为0.1,体积为10 mL。盖上胶塞,密封瓶口,充氩气4 min 用以排出三角瓶中的空气。向瓶中注入0.5%的氧气和10%的乙炔。实验设置4个重复,30 ℃、220 r·min-1振荡培养。每隔2 h用微量进样器从瓶中抽取250 μL气体注入气相色谱仪中(SP-2305型气相色谱仪)检测乙烯含量,记录乙烯峰面积,利用公式计算固氮酶的活性。
1.2.3固氮菌株泌铵能力测定挑取待测菌株接种于含对应抗生素的LB 液体培养基中过夜培养,菌株离心收集后转至10 mL A15液体培养基中,调整初始OD600为0.1。菌液在固氮条件下培养72 h后收集上清液利用酶标仪(Molecular Devices Flexstaion 3,美国)测定铵离子浓度[16]。实验设置4个重复。
1.3 玉米品系
转基因氮高效利用玉米品系与对照普通玉米品系的种子由吉林省农业科学院提供。转基因氮高效利用玉米品系通过转ZmAMT1.1基因改良铵盐高效吸收过程,提高玉米植株对氮素的吸收效率[17]。将编码氨转运蛋白的目的基因ZmAMT1.1和抗除草剂草铵膦筛选基因bar构建到 pCAMBIA 3300-ZmAMT1.1-bar表达载体上,以玉米Hill为受体,通过农杆菌介导的玉米幼胚转化法获得转基因玉米。利用除草剂筛选、PCR、RT-PCR、Southern blot等技术验证目的基因插入玉米基因组中,稳定表达,且多世代稳定遗传。该玉米品系进入农业部中间试验阶段,中间试验批文号为农基安办报告字(2019)第122号。
1.4 菌株接种
试验在吉林省农业科学院温室(公主岭)进行。接种固氮菌设置5个处理:泌铵工程菌1568/pVA3、野生型菌株A1501、nifH基因突变菌株1502以及50 mg N·kg-1土施氮处理和不接种处理对照,接种和不接种对照均不施加氮肥;玉米品种包括2个处理(转基因高效利用品系和对照品系);试验设置8个重复。
将玉米种子在无菌水中浸泡清洗30 min后转移至5% NaClO溶液中浸泡1 min,在75%乙醇中处理2 min,最后用无菌水清洗5次。表面消毒后的种子分别放入准备好的菌悬液以及灭菌的野生型悬浮液(不接种对照)浸泡30 min。将浸泡后的玉米种子放入装有2.5 kg土壤基质(Klasmann-Deilmann)的塑料盆中(内径20 cm、高20 cm),每盆4颗种子,每组8个重复。玉米出苗后间苗至2颗·盆-1,玉米生长周期内按照正常管理。种植60 d后分别测定玉米地上和地下部生长量。
1.5 生物固氮量测定
试验开始前两周将15N稳定性同位素标记的硫酸铵(浓度为50 mg N·kg-1土壤,丰度为10%)加入土壤中并充分混合待用。经菌液浸泡后的玉米种子放入盆装土壤中。栽培60 d后取部分根系及茎叶烘干至恒重,研磨过100目筛后,经稳定性同位素质谱(同位素分析仪-稳定性同位素质谱仪联用,中国农业科学院农业环境与可持续发展研究所)检测。实验设置4个重复。生物固氮百分率以从空气中固定的氮素占植物总氮量的百分比(%Ndfa)来表示,计算方法如下。
%Ndfa=(1-atom%15NFexcess/atom%15NNFexcess)×100%
式中,atom%15NFexcess为接种固氮菌玉米体内15N原子百分超;atom%15NNFexcess为接种丧失固氮能力的突变株玉米体内15N原子百分超。计算结果以3次独立测定结果的算术平均值表示。
植物体内总的固氮量(Nfixed)按以下公式计算。
Nfixed(g) =Nt×%Ndfa × Biomass
式中,Nt为植物总氮含量;Biomass为植株地上和地下部的生物量总和, g·株-1。
针对15N稳定性同位素稀释法获得的玉米生物固氮量数据,对玉米的节肥量进行估算。假定玉米正常尿素施用量是375 kg·hm-2(约187.5 kg N·hm-2),估算节肥率。
生物固氮量(kg·hm-2)=
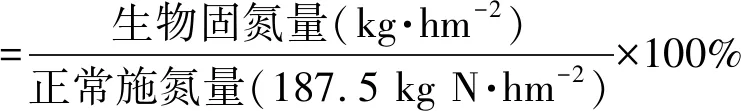
1.6 数据与分析
试验数据包括玉米的株高、株重、根重及稳定性同位素分析数值处理均利用SPSS 20.0软件(IBM,美国)进行统计分析。
2 结果与分析
2.1 固氮菌株生长曲线分析
三株待测菌株的生长曲线(图1)表明,固氮施氏假单胞菌野生型A1501、泌铵菌1568/pVA3和nifH基因突变株1502在LB培养基中长势基本一致,均在2 h后进入对数生长期,在8~10 h时到达平台期。
2.2 固氮酶活性分析
酶活测定结果(图2)表明,泌铵菌1568/pVA3的固氮酶活达到1 477 nmol C2H4·mg-1protein·h-1,略高于野生型的固氮酶活(约1 350 nmol C2H4·mg-1protein·h-1),而nifH基因缺失突变株1502未检测到固氮酶活。
2.3 泌铵特性分析
在固氮条件下,培养72 h后泌铵菌1568/pVA3的胞外铵离子浓度达到18 μmol·L-1,而野生型和nifH基因突变菌株的培养基中均未检测到铵离子(图3)。以上结果表明,三株菌株的生长、固氮、泌铵等生理活性正常,可用于后续的接种实验。

图1 固氮施氏假单胞菌野生型及其衍生菌株生长曲线Fig.1 Growth properties of wild-type A1501 and mutant strains in LB liquid medium
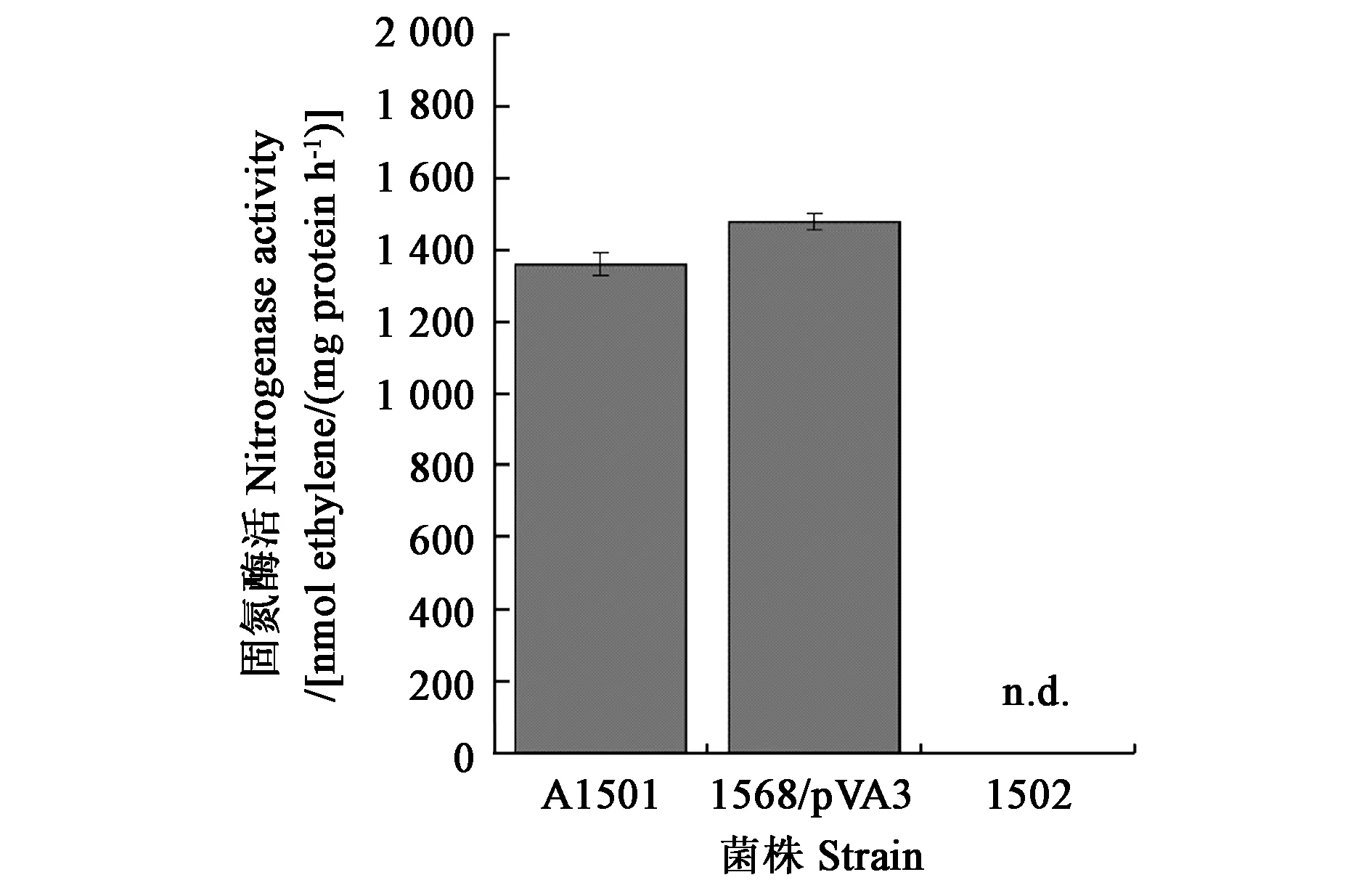
注:n.d.表示未检出数值。Note: n.d. indicates no detection.图2 固氮施氏假单胞菌野生型及其衍生菌株固氮酶活Fig.2 Nitrogenase activities of the wild-type A1501 and mutant strains

注:n.d.表示未检出数值。Note: n.d. indicates no detection.图3 固氮施氏假单胞菌野生型及其衍生菌株泌铵能力(72 h)Fig.3 Ammonium production of wild-type A1501 and mutant strains during 72 h incubation
2.4 固氮菌对玉米生长的影响
玉米生长第60 d采集地上和地下部测定植物生物量,包括株高、株重和根系重量,结果表明,固氮施氏假单胞菌接种显著提高了玉米的生物量(表1,图4)。固氮施氏假单胞菌接种氮高效利用和对照玉米品系的地上和地下部生物量都显著高于不接种对照。在氮高效利用玉米联合固氮体系中,接种1568/pVA3菌株的植株生物量较施肥处理提高25.5%,较不接种对照提高36.4%;接种A1501菌株的植株生物量较施肥处理提高24.8%,较不接种对照提高35.6%。在对照玉米联合固氮体系中,接种1568/pVA3菌株的植株生物量较不接种增加17.6%,接种A1501菌株后植株生物量较不接种增加20.7%。但是,固氮菌接种处理对氮高效利用玉米和对照玉米植株的总生物量没有显著影响。
接种固氮菌后,氮高效利用和对照玉米品系的株高都显著高于不接种对照(P<0.05),接种固氮菌后氮高效利用玉米品系的平均株高显著(P<0.05)高于对照玉米品系。对于氮高效利用玉米品系,接种野生型A1501和泌铵菌1568/pVA3后玉米平均株高分别达到131和126 cm,而接种nifH突变株1502和施氮处理的玉米平均株高约124 cm,均显著高于不接种处理(P<0.05)。对于普通玉米品系,接种固氮菌株和施氮处理的玉米株高约为122 cm,也均显著(P<0.05)高于不接种处理。
玉米根系发育结果(表1)显示,两个玉米品系在相同处理条件下接种野生型A1501、泌铵菌1568/pVA3和nifH突变株1502的玉米植株根系重量均显著高于不接种对照。
2.5 15N稀释法测定固氮菌株对玉米根际固氮量影响
利用15N稀释法对接种至玉米根际固氮菌的固氮能力进行评价,结果(表2)表明,野生型和泌铵固氮菌接种都显著提高了玉米植株的全氮含量(N%)、植株15N原子百分超、固氮百分率和固氮量。

A:氮高效玉米:B:对照玉米。1—不接种对照;2—氮肥处理;3—接种nifH基因突变株;4—接种野生型;5—接种泌铵菌(1568/pVA3)。A: High N utilization maize; B: Control maize. 1—control without inoculation; 2—N fertilization treatment; 3—Inoculation with nifH mutant strain (1502); 4—Inoculation with wild-type; 5—Inoculation with ammonium-excreting mutant strain (1568/pVA3).图4 固氮施氏假单胞菌野生型及其衍生菌株接种的玉米植株Fig.4 Inoculation of maize with P. stuzeri wild-type and mutant strains
对于氮高效利用玉米联合固氮体系,接种1568/pVA3菌株后植株全氮含量相对于不接种对照增加39%,生物固氮贡献率为21.5%,经换算后生物固氮量为0.8 g·株-1,估算每公顷的生物固氮量为48 kg,节肥率约为25.6%。接种A1501菌株后植株全氮含量相对于不接种对照增加29%,生物固氮量贡献率为18.5%,经换算后生物固氮量为0.64 g·株-1,估算每公顷的生物固氮量为38.4 kg,肥料节约率约为20.4%。
对于对照玉米联合固氮体系,接种1568/pVA3后植株全氮含量相对于不接种对照增加12%,生物固氮量贡献率为10.1%,经换算后生物固氮量约为0.27 g ·株-1,估算每公顷的生物固氮量为16.2 kg,节肥率约为8.6%。接种A1501菌株后植株全氮含量相对于不接种对照增加1.3%,生物固氮贡献率为8.0%,经换算后生物固氮量为0.2 g·株-1,估算每公顷的生物固氮量为12 kg,节肥率约为6.4%。
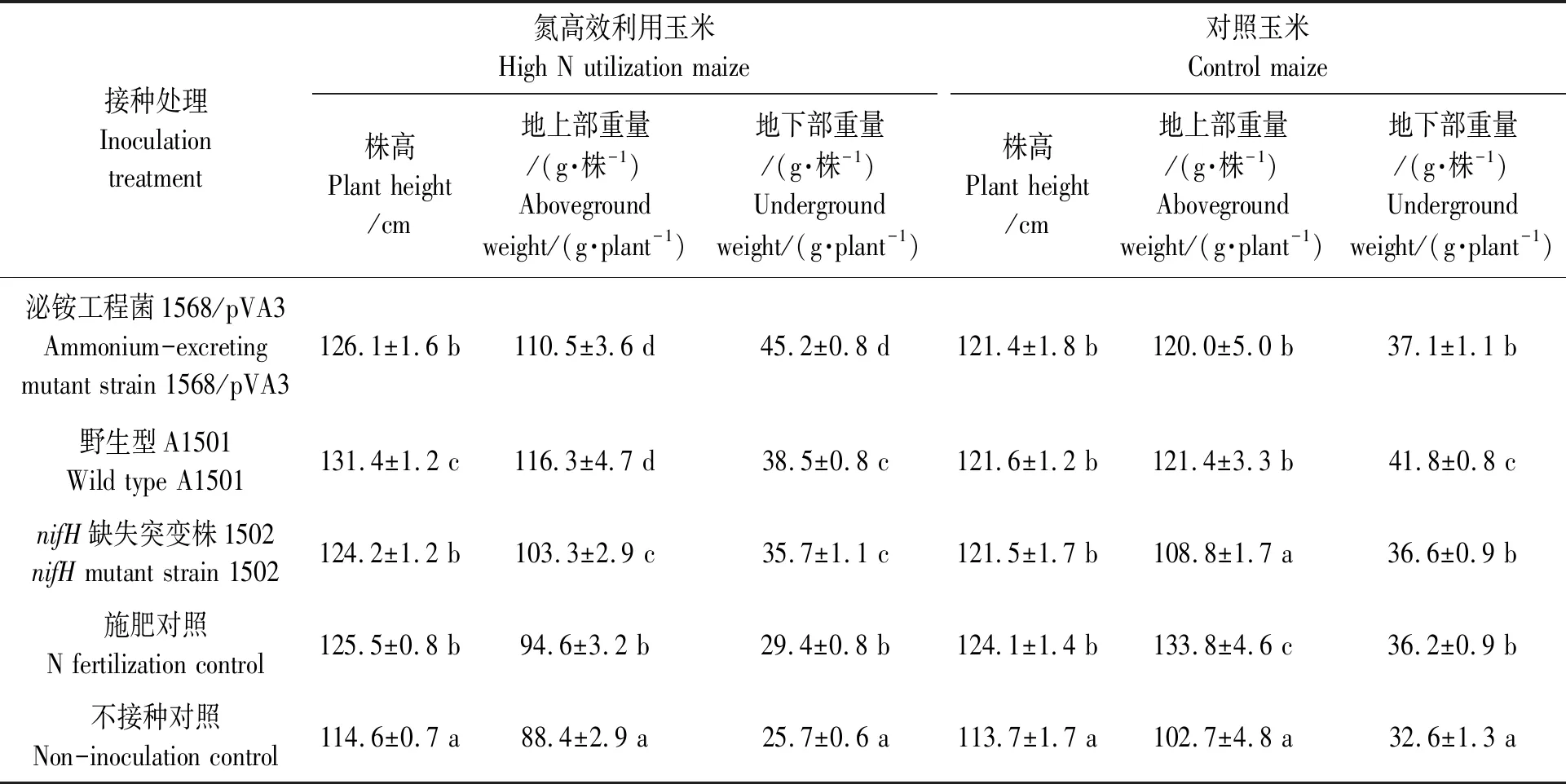
表1 固氮施氏假单胞菌A1501及其衍生菌株接种后玉米植株的生长指标Table 1 Effect of inoculation with P. stutzeri A1501 wild-type and mutant strains on maize plant growth
3 讨论
3.1 泌铵工程菌促生机理探讨
相对于共生结瘤固氮,非豆科根际联合固氮受环境因素影响大,固氮效率低(1~50 kg·hm-2·a-1)[18]。更重要的是固氮作用是一个耗能的反应,固氮微生物很少主动向外分泌合成的铵,并且固氮酶的表达和活性受活性铵的抑制。因此,打破铵抑制,构建泌铵固氮菌株一直是生物固氮研究的热点问题[19]。构建泌铵固氮工程菌的策略有化学诱变、定位突变铵同化、铵转运或固氮负调节基因等[20]。本文使用的1568/pVA3是通过对野生型A1501进行基因操作获得,野生型含有amtB1和amtB2两个编码铵转运蛋白基因,并与glnK共同组成一个操纵子。在氮限制性条件下,AmtB蛋白将细胞外的铵转运到细胞内。通过增强nifA基因表达以提高固氮酶活,将其转入amtB1和amtB2双缺失突变株中,从而获得耐铵泌铵固氮工程菌[13]。本研究中野生型及其衍生菌株在长特性等方面没有显著差异,表明对野生型进行基因敲除等操作不会影响固氮菌的其他生理活性如生物膜形成或根际定殖能力。本研究的目的之一是验证泌铵工程菌1568/pVA3能否促进玉米植株的生长,以及提供植物宿主更多生物固定的氮。与不接种对照相比,1568/pVA3菌株接种显著促进了玉米植株的地上部和地下部的生物量以及植株的高度。但是1568/pVA3菌株和野生型A1501对玉米的促生效果相似,两者没有显著性差异。这与有些研究结果不一致,例如巴西固氮螺菌(Azospirillumbrasilense)泌铵突变菌株对玉米的促生效果较野生型提高近50%[21]。接种巴西固氮螺菌泌铵工程菌株后,小麦地上和地下部生物量分别提高30%和31%[22]。这种差别可能与不同固氮菌株的泌铵能力及接种条件如土壤性质、植物生长时期等因素有关。同时除了生物固氮,联合固氮菌具有多种促生机制如分泌植物生长激素或溶磷等功能可能被忽略[22]。本研究中,1502接种后玉米的株高和生物量等都显著高于不接种对照。15N稳定性同位素稀释法分析结果表明相对于野生型,接种泌铵菌1568/pVA3后玉米植株内从空气中固定的氮素占植物总氮量的百分比(%Ndfa)提高1.9%~3.0%,生物固氮量提高0.07~0.16 g·株-1。这表明泌铵工程菌比野生型具有更高的固氮活性并能提供宿主更多生物固定的氮。这一结果与之前的研究结论一致,Pankievic等[23]发现在C4植物狗尾草中,接种巴西固氮螺菌泌铵菌株后宿主体内生物固定的氮较接种野生型提高了16倍之多。试验室培养条件下72 h后1568/pVA3泌铵菌株能够向胞外分泌的铵浓度达到18 μmol·L-1,低于Azotobactervinelandii[24]、PseudomonasprotegensPf-5 X940[24]和Azospirillumbrasilense等工程菌的泌铵能力(20~2 000 μmol·L-1)。但是当1568/pVA3与野生型接种至玉米植物,泌铵菌接种后根际土可以检测到的铵离子浓度要显著高于野生型(数据未发表)。泌铵菌接种后铵离子在根际土中富集的现象在Setten等[25]的研究中也有发现。以上结果表明,泌铵菌和野生型都能显著促进玉米的生长,同时泌铵菌具有泌铵能力,因而能给植物宿主提供更多生物固定的氮。
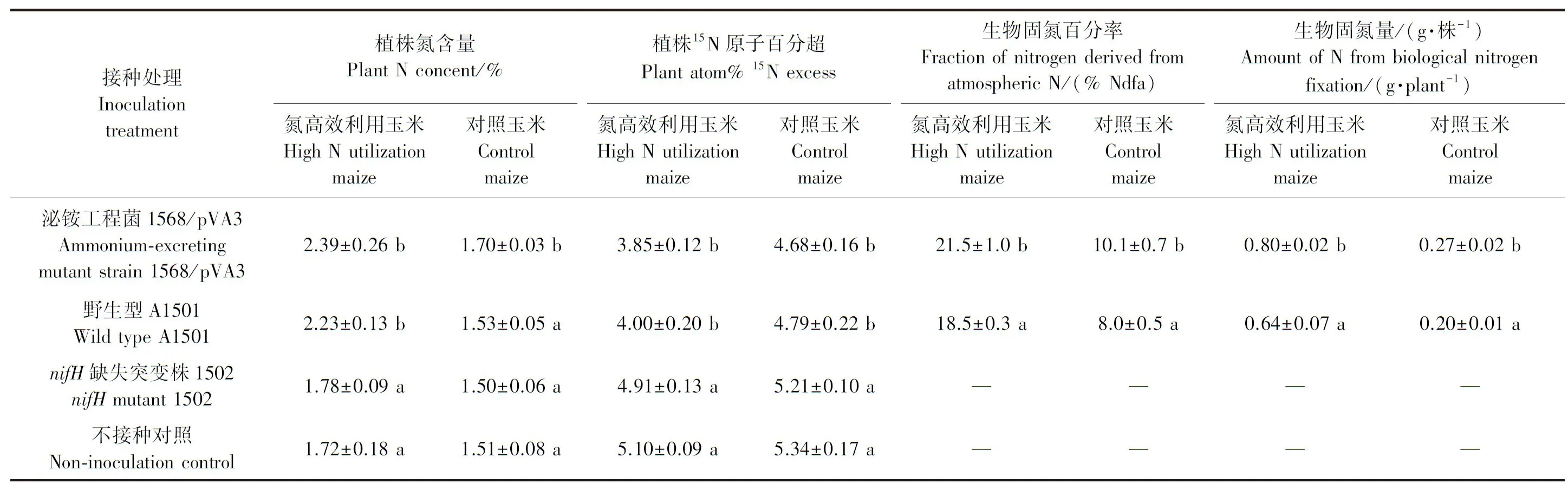
表2 接种固氮施氏假单胞菌A1501及其衍生菌株的生物固氮量评价Table 2 Evaluation of the nitrogen-fixing capacity of maize inoculated with P. stuzeri wild-type and mutant strains using 15N isotope-dilution method
3.2 高效联合固氮系统的建立策略及启示
通过分子遗传学途径进行玉米品质改良是提高玉米氮素利用效率,减肥高产的重要手段之一,但是存在周期长、筛选率低等缺点[26-27]。本研究使用的转基因氮高效利用玉米品系通过转ZmAMT1.1基因进行生理性状改良,在低氮条件下可提高植物铵盐高效吸收过程,提高玉米植株对氮素的吸收效率。除了构建高效的泌铵工程菌,本研究利用氮高效利用玉米品系作为植物宿主,与泌铵工程菌形成高效联合固氮体系,同时假设氮高效玉米联合固氮体系具有更高的生长量和生物固氮量。结果证实,野生型接种后氮高效玉米的株高显著高于相同处理条件下的普通玉米,同时,泌铵菌接种后氮高效玉米的株高和根系生长量均显著高于相同处理条件下的普通玉米。尽管固氮施氏假单胞菌接种对氮高效利用玉米和对照玉米植株地上和地下部总生物量没有显著影响,这可能与本研究所用土壤基质的养分条件有关。值得注意的是,野生型和泌铵菌接种后氮高效利用玉米总生物量较不接种对照均提高约36%,较氮肥处理均提高约25%;而野生型和泌铵菌接种后的普通玉米总生物量较不接种对照提高18%左右,较氮肥处理减少5.5%左右。这表明在固氮菌和氮高效利用玉米形成的联合固氮体系中,固氮菌接种处理对植物生物量的提升作用更明显。此外,相对于普通玉米品系,泌铵菌和野生型接种后的氮高效利用玉米植株氮含量提高41%~45%,生物固氮量提高196%~220%。以上结果表明,固氮菌与氮高效利用玉米形成的联合固氮系统可以使植物获得具有更高的生物固氮量。
本研究发现,构建的根际高效联合固氮体系仍然易受环境因素的影响,尤其在逆境条件下呈现固氮效率低等特点(数据未发表)。因此,在下一步研究工作中,可以利用合成生物学技术在人工固氮系统中增加特定的抗逆模块,以及与根际定殖相关的菌群竞争性模块,进一步提高根际联合固氮体系对逆境的耐受性。此外通过采取构建多个微生物底盘的策略,人工设计根际有益微生物组,在群体水平上通过多种互作机制提高植物抗逆性并促进植物的生长[28-30]。
本研究针对联合固氮作用的天然缺陷,构建泌铵固氮菌-氮高效利用玉米联合固氮体系,并在温室条件下对该体系的玉米植株生物量与生物固氮量进行评价。结果表明,泌铵固氮菌和野生型接种都显著促进了玉米的生长,同时泌铵固氮菌相对于野生型能为植物宿主提供更多生物固定的氮。因此,固氮菌与氮高效利用玉米的联合固氮系统可以使植物获得具有更高的生物固氮量,本研究可为生物固氮合成生物学的进一步研究和微生物肥料的开发提供理论基础。
