HPLC-MS/MS法同时测定烟草中22种Amadori化合物
2021-04-24王晓瑜王昇刘鸿陈志燕潘立宁秦亚琼刘惠民范忠周芸
王晓瑜,王昇*,刘鸿,陈志燕,潘立宁,秦亚琼,刘惠民,范忠*,周芸
1.中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号450001
2.广西中烟工业有限责任公司技术中心,南宁市北湖南路28号530001
烟草加工过程中会伴随美拉德反应发生,对烟草的颜色和品质产生重要影响。美拉德反应初始阶段,还原糖和氨基酸发生加成反应,产物经Amadori重排生成相对稳定的Amadori化合物[1]。Amadori化合物是重要的香味前体物质,快速、准确地对其测定对识别和监测食品和烟草加工过程中的美拉德反应具有重要意义[2-4]。早期关于Amadori化合物测定的研究对象均是烟叶样品,主要是基于液相色谱-光谱检测技术[5-8]。例如,1971年Noguchi等[5]研究了自然陈化4年内烤烟烟叶中Amadori化合物质量分数的变化,采用强酸性阳离子交换色谱与茚三酮柱后衍生并用紫外-可见检测器(UV-Vis)分析了6种Amadori化合物(Fru-Pro、Fru-Ala、Fru-Val、Fru-Thr、Fru-Phe、
Fru-Tyr)质量分数的变化,但该方法存在氨基酸干扰,且灵敏度较低。1982年,Gary等[6]用硝基苯甲醛肟(PNBO)对烤烟中选定的3种Amadori化合物进行衍生后,用液相色谱(氨基反向柱)进行分离,示差折光检测器(RI)检测,但该法前处理较为繁琐,且不同Amadori化合物的保留时间相似,检测灵敏度及选择性也较差。1989年,Hennighan等[7]利用液相色谱(阴离子交换柱)分离Amadori化合物,采用2,3,5-三苯基氯化四氮唑(TTC)对Amadori化合物进行柱后衍生和UV-Vis检测,实现了烟草中6种主要Amadori化合物的分离,但灵敏度仍较低。
随着MS技术的快速发展,在2000年后文献报道的关于烟叶及食品、模拟反应体系中Amadori化合物的检测方法主要以HPLC-MS/MS为主[9-12],也有毛细管电泳-质谱检测法[13],这些方法均有效克服了传统液相色谱-光谱检测技术灵敏度低、选择性差的问题。例如,2004年Hau等[13]首次采用未涂层的熔融石英毛细管电泳-串联质谱分析Amadori化合物,能实现对含有葡萄糖和6种氨基酸的混合反应产生的Amadori化合物的快速分离与定性,色谱分辨率很高,但由于毛细管电泳色谱使用普及率低且重复性较差,该法较难推广。2005年,Davidek等[9]采用高效阳离子交换色谱-串联质谱分析Amadori化合物,能实现对含有葡萄糖或木糖与8种氨基酸混合反应产生的Amadori化合物的快速分离和定性,同时还分析了干番茄和杏子等中的Amadori化合物。2013年,王红瑞等[10]建立了HPLC-MS/MS同时测定烟草中5种Amadori化合物的方法,样品经含5%(体积分数)甲醇的水提取后,采用Waters XBridgeTMAmide色谱柱以甲醇-水为流动相进行分离,采用多反应监测(Multireaction monitor,MRM)模式检测。HPLCMS/MS技术的引入极大提高了Amadori化合物定性及定量的准确度。由于Amadori化合物纯品难以获得,截止到2016年底,文献报道的同时定量测定烟草中Amadori化合物方法的指标均少于6种。本研究组在2017年针对可获得标样的10种葡萄糖型Amadori化合物,系统优化了色谱分离条件及质谱检测参数,建立了同时测定烟叶中这10种Amadori化合物的HPLC-MS/MS方法[12]。然而实际上,烟草以及其他植物体内存在的氨基酸种类大于20种,理论上也应存在20余种Amadori化合物,但受限于标样种类,目前仍未掌握烟草中葡萄糖型Amadori化合物质量分数的总貌。
高效液相色谱-四极杆串联飞行时间质谱(HPLC-Q-TOF-MS)技术基于高分辨率精确质量数匹配,能极大提高未知化合物定性的准确性[14-15]。因此,在前期研究[12]的基础上,针对其他12种无标样的葡萄糖型Amadori化合物,采用文献[9,14]的方法进行合成,通过HPLC-Q-TOF-MS对模型体系中12种Amadori化合物进行一级精确质量数及二级碎片离子扫描,确定定性及定量离子对;继而基于HPLC-MS/MS对10种具有标样的Amadori化合物进行外标定量测定,对12种无标样的采用保留时间及结构较为近似的Amadori标准品的标准曲线近似定量,实现了22种Amadori化合物的同时快速测定,旨在为测定不同类型烟叶Amadori化合物的质量分数提供方法参考。
1 材料与方法
1.1 材料、试剂和仪器
葡 萄 糖 胺(Glucosamine,98.0%,美 国Alfa Aesar公司);1-脱 氧-1-L-丙氨酸-D-果糖(Fru-Ala,98.0%)、1-脱氧-1-L-缬氨酸-D-果糖(Fru-Val,98.0%)、1-脱氧-1-L-脯氨酸-D-果糖(Fru-Pro,98.0%)、1-脱氧-1-L-苯丙氨酸-D-果糖(Fru-Phe,98.0%)、l-脱氧-1-L-色氨酸-D-果糖(Fru-Trp,98.0%)、1-脱氧-1-L-异亮氨酸-D-果糖(Fru-Ile,95.0%)、1-脱氧-1-L-亮氨酸-D-果糖(Fru-Leu,95.0%)、1-脱氧-1-L-天冬酰胺-D-果糖(Fru-Asn,97.0%)、1-脱氧-1-L-谷氨酸-D-果糖(Fru-Glu,98.0%)(加拿大TRC公司);葡萄糖(99.5%)、γ-氨基丁酸(GABA,99.0%)、L-精氨酸(98.0%)、天冬氨酸(98.0%)、半胱氨酸(99.0%)、谷氨酰胺(99.0%)、甘氨酸(99.0%)、L-组氨酸(99.0%)、赖氨酸(98.0%)、蛋氨酸(99.0%)、L-丝氨酸(99.0%)、L-苏氨酸(99.0%)和L-酪氨酸(99.0 %)(北京百灵威科技有限公司);甲醇和乙腈(色谱纯)、甲酸(≥96.0%)(美国Sigma公司)。
3种白肋烟样品产自湖北恩施、重庆;2种香料烟样品产自云南保山、湖北十堰;18种C3F等级烤烟样品,分别产自云南宜良、云南师宗、云南宁洱、福建永定、贵州兴仁、四川会理、河南宝丰、广东南雄、安徽宣州、湖南桂阳、湖南江华、江西信丰、贵州黔西、贵州贵定、贵州德江、湖北利川、湖北彭水和山东蒙阴。所有烟叶样品均为2016年产,涵盖浓、中、清香型。
1200液相色谱仪(美国Agilent公司)和AB Sciex Triple TOF TM 4600质谱系统(美国Applied Biosystems公司);API5500三重四极杆串接质谱系统(美国Applied Biosystems公司);Atlantis T3液相色谱柱(2.1 mm×250 mm,5μm,美国Waters公司);0.45μm有机滤膜(上海安谱实验科技股份有限公司)。
1.2 方法
1.2.1 标样Amadori化合物模型反应体系
按照葡萄糖和氨基酸摩尔比2:1的比例,在12个250 mL圆底烧瓶中分别称取100 mmol葡萄糖和50 mmol的1种氨基酸(12个圆底瓶中加入氨基酸均不相同),加入100 mL甲醇,64℃加热回流80 min,然后将反应体系置于冷水浴中以终止反应。取约30 mL混合液于离心管中,10 000 r/min离心10 min,取约20 mL上清液,过有机滤膜,得到12种含有对应Amadori化合物的滤液,即:1-脱氧-1-L-γ-氨基丁酸-D-果糖(Fru-GABA)、1-脱氧-1-L-精氨酸-D-果糖(Fru-Arg)、1-脱氧-1-L-天冬氨酸-D-果糖(Fru-Asp)、1-脱氧-1-L-半胱氨酸-D-果糖(Fru-Cys)、1-脱氧-1-L-谷氨酰胺-D-果糖(Fru-Gln)、1-脱氧-1-L-甘氨酸-D-果糖(Fru-Gly)、1-脱 氧-1-L-组 氨 酸-D-果 糖(Fru-His)、1-脱 氧-1-L-赖 氨 酸-D-果 糖(Fru-Lys)、1-脱 氧-1-L-蛋 氨 酸-D-果 糖(Fru-Met)、1-脱 氧-1-L-丝 氨 酸-D-果 糖(Fru-Ser)、1-脱 氧-1-L-苏 氨 酸-D-果 糖(Fru-Thr)、1-脱 氧-1-L-酪 氨 酸-D-果 糖(Fru-Tyr)。将得到的滤液按1:1 000的比例用30%(体积分数)的甲醇-水溶液稀释后,采用HPLC-Q-TOF-MS法进行定性分析。
1.2.2 烟叶样品前处理
将实验所用烟叶样品在室温下晾干后,采用YC/T 31—1996[18]的方法测定其含水率。将烟叶样品研磨成粉,过孔径380μm(40目)标准筛。称取1 g(精确至0.01 g)烟末,加入30 mL 30%的甲醇-水溶液,超声萃取25 min后,10 000 r/min离心5 min。上清液过有机滤膜,取50μL于10 mL容量瓶中,以甲醇定容,取1 mL进行HPLC-MS/MS分析;取500μL萃取液滤液用甲醇定容至10 mL,然后取1 mL于色谱瓶中,用于Fru-Arg、Fru-Lys等低质量分数Amadori化合物(<100μg/g)的定量分析。
(1)HPLC-Q-TOF-MS条件。色谱柱:Atlantis T3液相柱;进样量:5μL;流动相:0.2%(质量分数)甲酸水溶液(A相)和乙腈(B相);梯度洗脱程序:0~0.1 min 89.5% A~78.0% A,0.1~10.0 min 78.0%A。每两个样品之间用初始流动相平衡8 min。离子喷雾电压:5 500 V;去簇电压(DP):80 V;碰撞电压(CE):10 V;离子源温度:450℃;气帘气(CUR)压力:206.8 kPa;雾化气(GS1)压力:241.3 kPa;辅助气(GS2)压力:206.8 kPa;离子化方式:正离子;扫描方式:TOF/Production。
(2)HPLC-MS/MS条件。色谱条件同HPLCQ-TOF-MS。离子源:电喷雾(ESI);质谱信号采集模式:多反应监测正离子模式;喷雾电压:5 500 V;离子源温度:550℃;气帘气压力:137.9 kPa;雾化气压力:513.6 kPa;干燥气压力:517.1 kPa;碰撞气压力:962.1 kPa。
1.2.3 22种Amadori化合物的定量分析
采用外标法对10种有标样的Amadori化合物 进 行HPLC-MS/MS定 量 分 析[12],除Fru-Pro和Fru-Asn外的标准曲线浓度范围为5.00×10-3~1.00μg/mL,Fru-Pro和Fru-Asn均 为5.00×10-2~10.0μg/mL。
对12种无标样的Amadori化合物,在Q-TOF准确定性的基础上,设定HPLC-MS/MS二级质谱参数进行测定,并依据有标准品的Amadori化合物的标准曲线进行定量。而12种无标样的Amadori化合物标准曲线的选取,原则上采用与其保留时间相近、峰面积近似的Amadori化合物的标准曲线。由于烤烟、白肋烟和香料烟3种不同烟草基质中Amadori化合物的质量分数相差较大,因此对12种Amadori化合物定量所选取的标准曲线也存在一些差异,具体选择方案见表1。烟叶中Amadori化合物的质量分数是以烟叶干质量(扣除水分)为基础表示的。
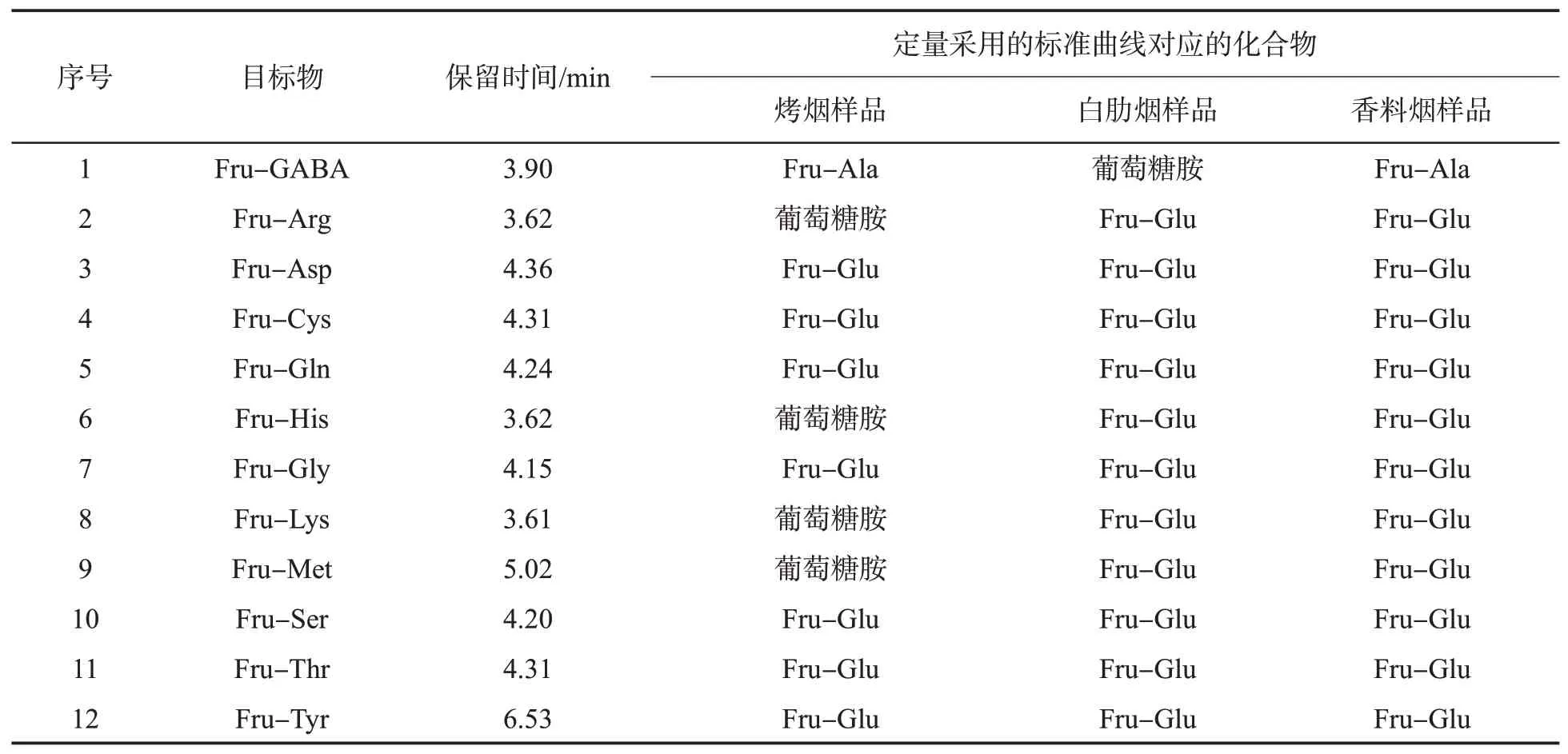
表1 无标样Amadori化合物定量曲线的选择Tab.1 Selection of calibration curves for Amadori compounds without standard reagents
1.2.4 葡萄糖、果糖、氨基酸的检测
参考YC/T 251—2008[16]的方法检测葡萄糖和果糖;参考YC/T 282—2009[17]的方法检测氨基酸。
2 结果与讨论
2.1 无标样Amadori化合物的定性分析
在前期研究[12]中,针对10种Amadori化合物,系统比较了4种液相色谱柱,确定使用Atlantis T3液相色谱柱并优化了色谱及三重四极杆质谱检测参数。本研究中采用了相同色谱方法,优化了Q-TOF质谱参数。分别将12种模型体系合成的Amadori化合物进行HPLC-Q-TOF-MS分析,数据处理使用Peak View 2.0软件,采用目标物和非目标物数据处理模式,参数为提取离子流强度>2 000或信噪比>3;峰宽0.5 Da,保留时间宽度0.2 min。由于12种Amadori化合物的结构及分子式已知,直接将其分别输入数据处理软件,得到对应Amadori化合物的定性参数,包括色谱峰、保留时间、精确质量数、质量误差及二级碎片离子。以Fru-GABA为例,其分子式为C10H19NO7,精确质量数为265.116 2,[M+H]+为266.124 0,检测到的Fru-GABA化合物的保留时间为3.96 min,[M+H]+为266.124 2,其质量误差为0.000 2 Da,准确度较高。二级碎片离子断裂方式与Fru-GABA结构理论断裂方式及具有相似化学结构的其他标准品保持一致。可以确定葡萄糖与氨基丁酸模型反应体系中含有Fru-GABA。与此同时,在上述数据处理参数下共有214种化合物被检出,由此可见,仅美拉德模型体系所生成的产物就极其复杂。采用相同方式,最终得到了12种Amadori化合物的定性参数,见表2。可知,检测到的12种Amadori化合物的精确质量数与理论值误差不大于0.000 8 Da,且其二级碎片即断裂方式与以往文献报道及其他10种Amadori标准品相似,证明模型反应体系中含有对应的Amadori化合物。
2.2 22种Amadori化合物定量方法的建立
对表2中12种Amadori化合物进行HPLC-QTOF-MS二级质谱分析,确定了12种Amadori化合物的离子对,22种(包括有标样的10种)Amadori化合物的离子对信息见表3。将12种含有对应Amadori化合物的模型反应溶液与10种Amadori化合物标样混合,在HPLC-MS/MS的MRM模式下检测22种Amdori化合物,同时测定烟草基质样品的22种Amdori化合物(图1和图2)。可知,烟草中检测到的22种Amadori化合物,在保留时间、定性离子对及定量离子对比例方面与对应模型反应及标准品高度一致。
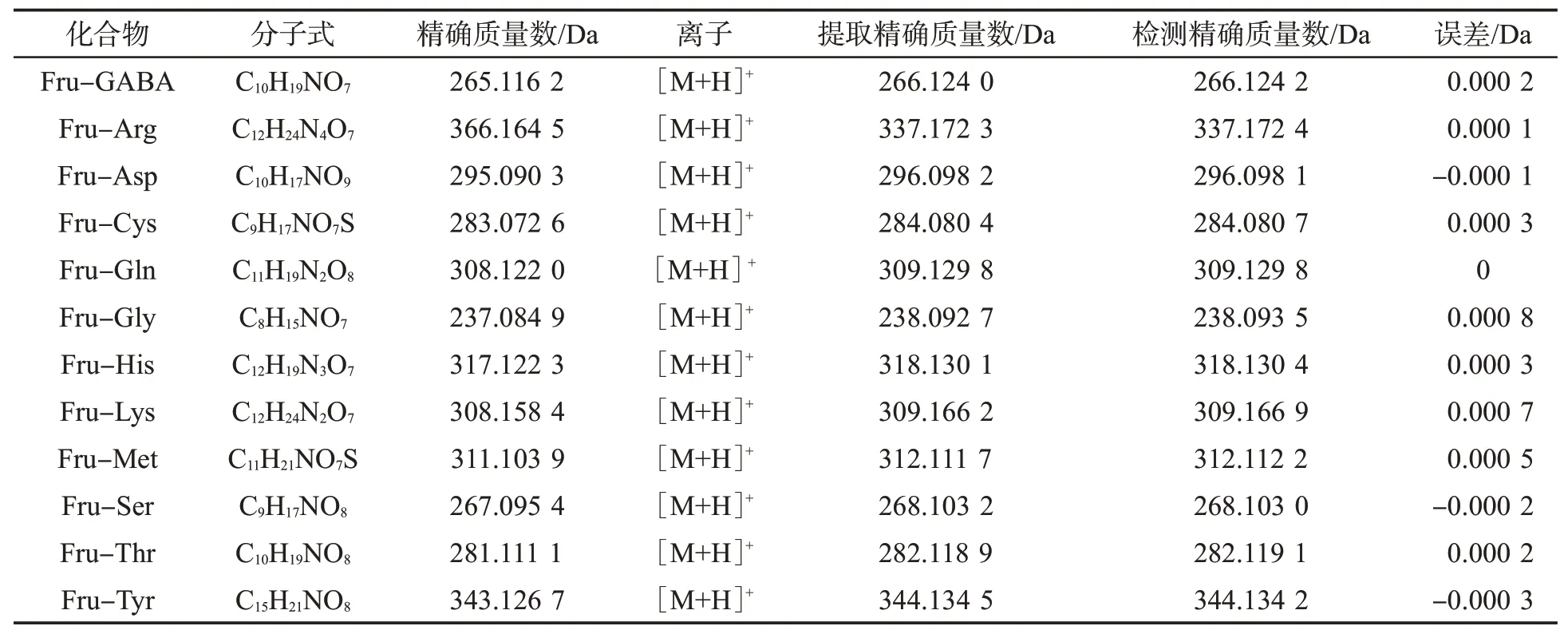
表2 12种模型反应体系中Amadori化合物的定性参数Tab.2 Qualitative parameters of the Amadori compounds identified in the 12 model Maillard reaction mixtures
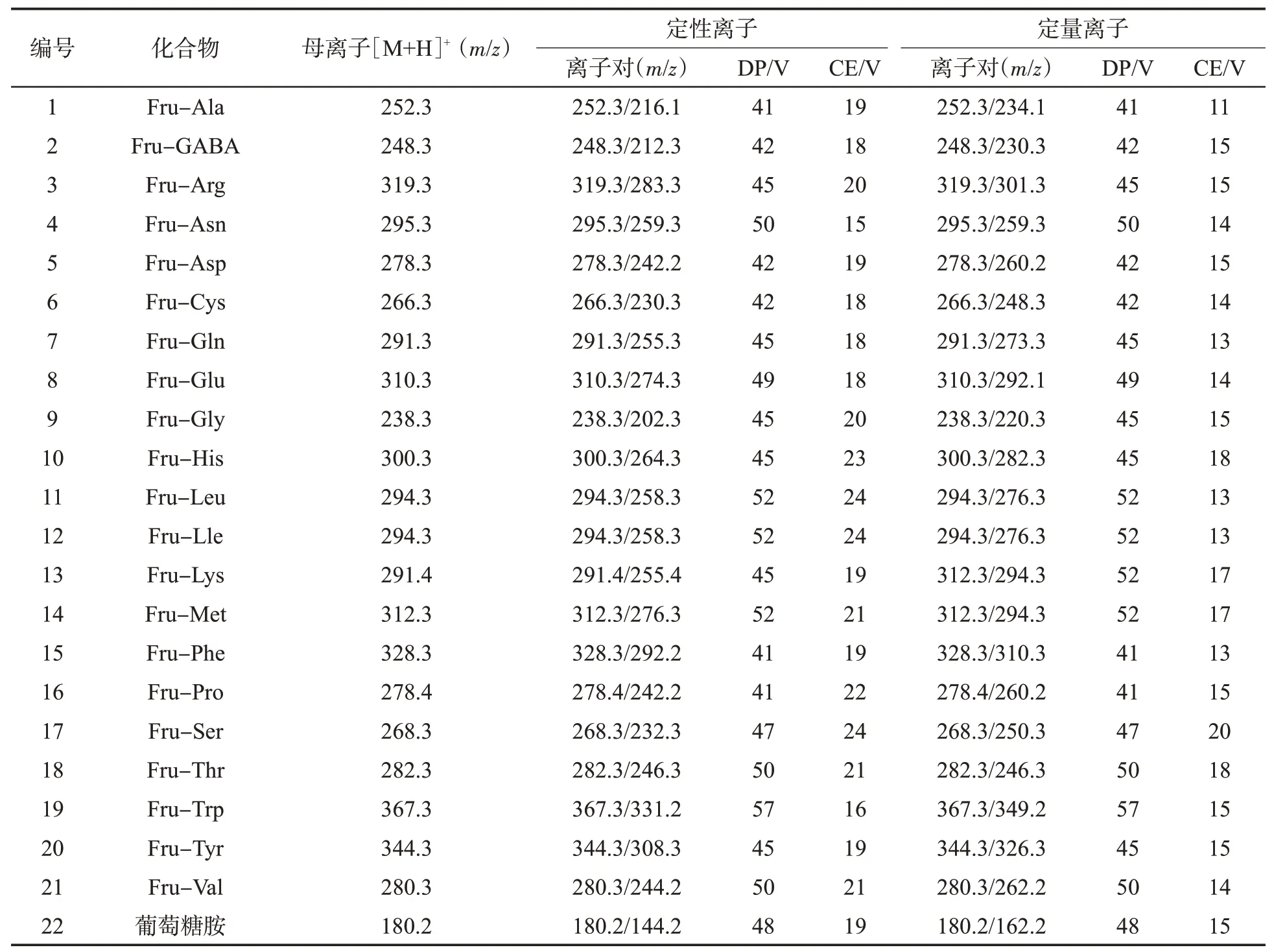
表3 22种Amadori化合物的二级质谱参数Tab.3 MS/MS parameters for 22 Amadori compounds
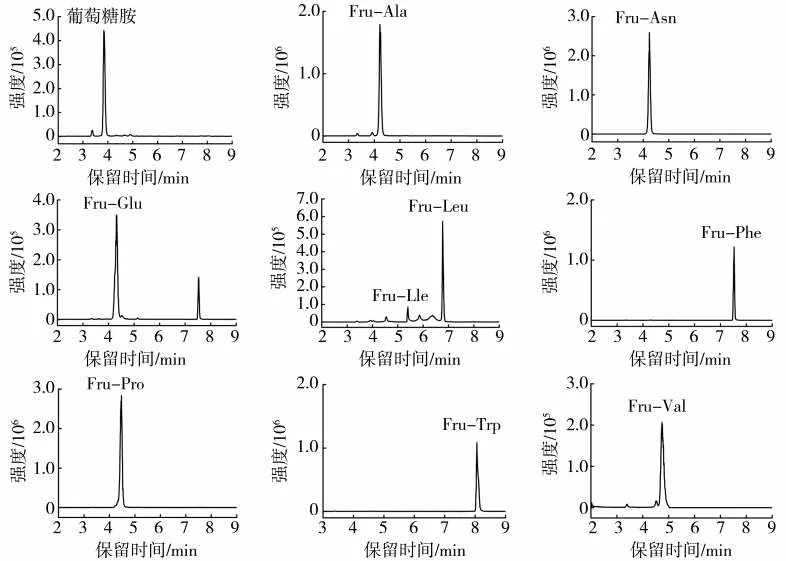
图1 基于HPLC-MS/MS的烟草样品中10种有标准品的Amadori化合物的MRM谱图Fig.1 MRM chromatograms of 10 Amadori compounds with available standard reagents in tobacco sample using HPLC-MS/MS
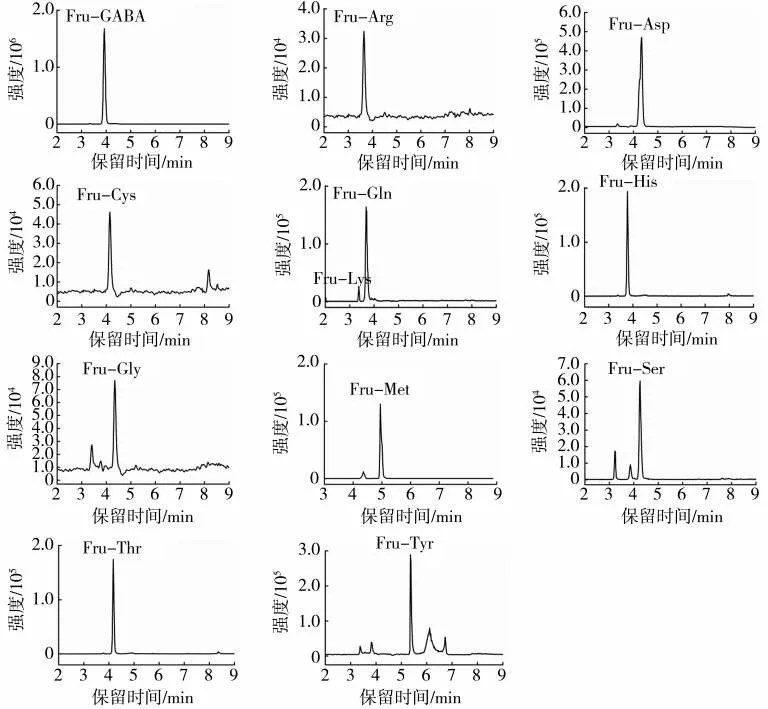
图2 基于HPLC-MS/MS的烟草样品中12种无标准品的Amadori化合物的MRM谱图Fig.2 MRM chromatograms of 12 Amadori compounds without available standard reagents in tobacco sample using HPLC-MS/MS
本研究组在前期的研究[12]中,对10种具有标样的化合物建立了外标定量方法,并进行了方法学验证:10种Amadori化合物线性关系良好,相关系数在0.997 7~0.999 9之间,检测限和定量限分别为1.35~2.53和4.52~8.44 ng/mL,回收率为84.9%~120.3%,日内精密度为1.33%~5.40%。本研究中重点考察了在大批量样品分析(仪器连续进行烟草样品测试6 d,进样超过300针)时,22种Amadori化合物的日内及日间精密度:在同一天内,对同一烤烟烟叶样品进行6次平行测定以确定日内精密度;在连续6 d内,每日均对同一烤烟烟叶进行单次测定,6 d测试结果的精密度即为日间精密度。由表4可知:①22个Amadori化合物中,18个化合物的日内精密度<10%,14个日间精密度<10%,5个日间精密度在10%~15%之间;②Fru-Glu与Fru-Gln的精密度较差,这可能与其在醇溶液中易分解有关;③Fru-Lys、Fru-Met和Fru-Cys由于其质量分数较低,接近定量限,造成精密度较差。
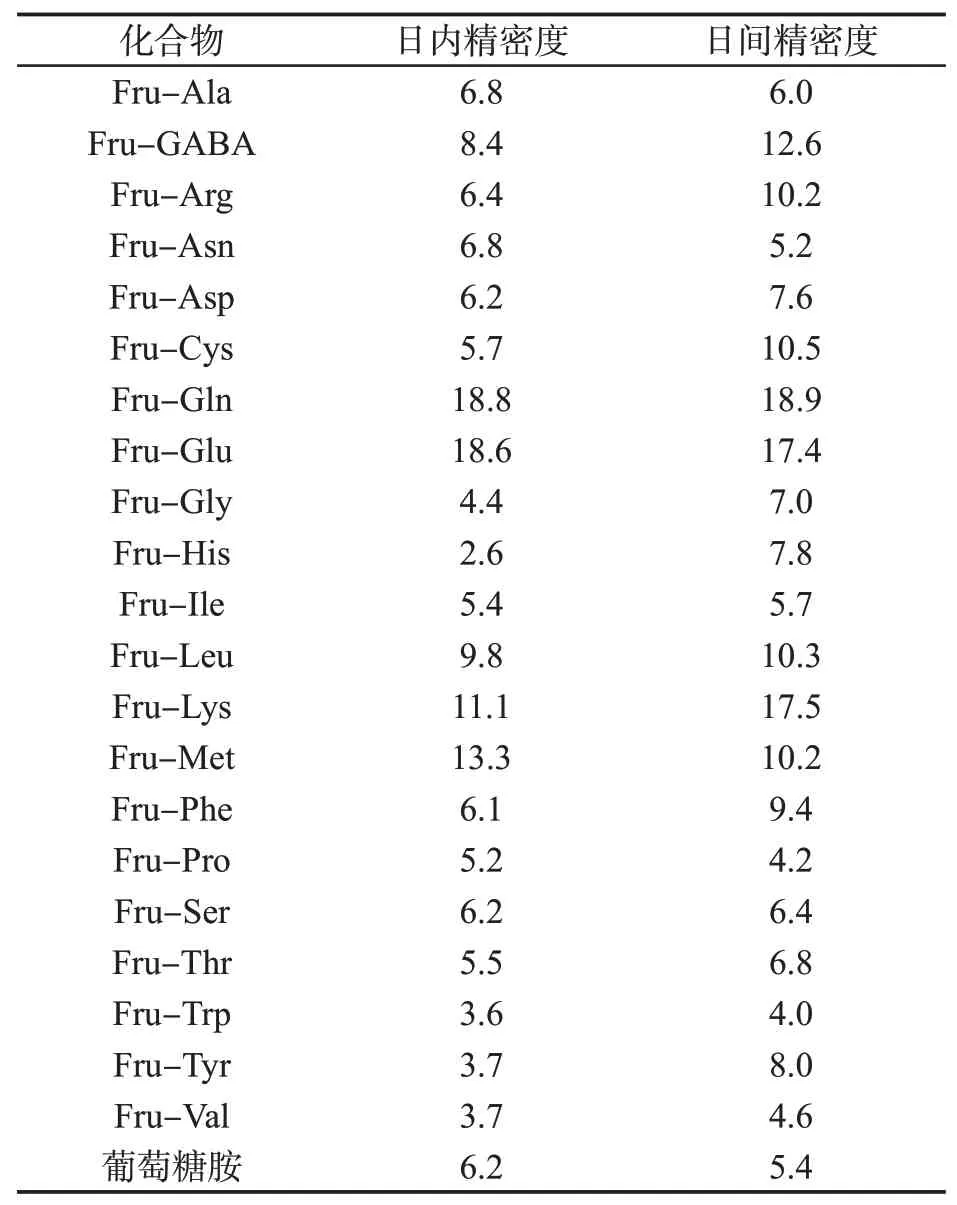
表4 22种Amadori化合物的日内和日间精密度(n=6)Tab.4 Intra-and inter-day precisions for the 22 Amadori compounds(n=6) (%)
2.3 不同类型烟叶Amadori化合物分析
采用不同类型烟叶样品中22种Amadori化合物的质量分数数据进行主成分分析,其得分图如图3所示。可知,3种类型烟叶可以按照Amadori化合物质量分数显著区分为3个区域。说明不同类型烟叶的Amadori化合物的质量分数水平、比例分布上存在显著差异。分别对实验所测3种白肋烟、2种香料烟及18种烤烟烟叶中各Amadori化合物的质量分数求平均值。由表5可知,不同类型烟草Amadori化合物的质量分数相差很大,其中烤烟最多,约占烟叶干质量的2.47%;香料烟次之,约占烟叶干质量的1.70%;白肋烟仅占0.14%。另外,不同类型烟草中不同Amadori化合物质量百分比大小排序不同,白肋烟中质量百分比较高的前8位按从大到小排序为葡萄糖胺、Fru-Asn、Fru-Asp、Fru-Gln、Fru-Pro、Fru-GABA、Fru-Ala、Fru-Glu,质量百分比分别为18.2%、16.9%、13.8%、13.4%、9.3%、6.9%、4.9%、4.6%,共计88.0%;香料烟中质量百分比较高的前8位按从大到小的排序为Fru-Pro、Fru-Asn、Fru-Gln、Fru-Ala、Fru-GABA、葡萄糖胺、Fru-Asp、Fru-Phe,质量百分比分别为18.7%、16.2%、15.2%、11.4%、9.4%、9.1%、5.5%、3.0%,共计88.5%;烤烟中较高的前8位从大到小的排序为Fru-Pro、Fru-Asn、Fru-Ala、Fru-GABA、Fru-Gln、Fru-Asp、Fru-Glu、Fru-Phe,质量百分比分别为34.8%、18.1%、12.0%、8.1%、6.8%、4.7%、2.7%、2.2%,共 计89.4%。不 同 类 型 烟 叶 中Amadori化合物质量分数的差异可能由烟叶中反应物质量分数、工艺加工方式等因素共同决定。
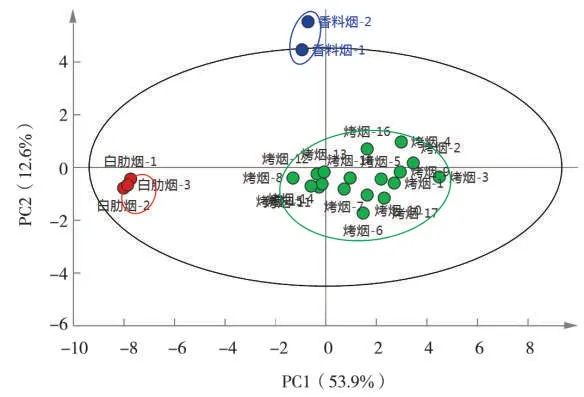
图3 不同类型烟叶样品Amadori化合物质量分数主成分分析得分图Fig.3 Mass fraction PCA score plot for Amadori compounds in tobacco leaves of different types
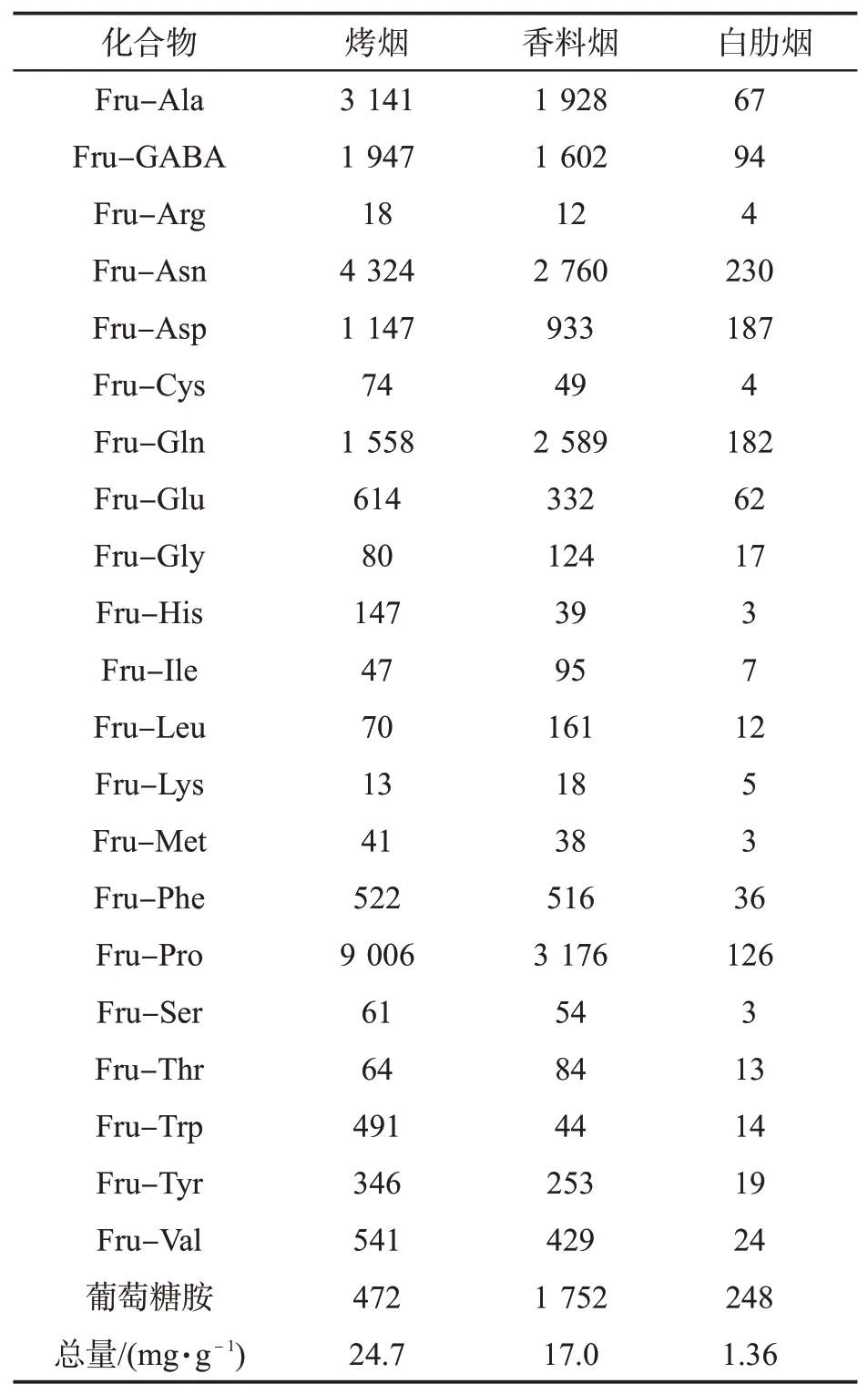
表5 不同类型烟叶Amadori化合物的质量分数Tab.5 Contents of Amadori compounds in tobacco leaves of different types (μg·g-1)
烟草中氨基酸、果糖和葡萄糖的测定结果表明,烤烟中氨基酸的量与香料烟相近,但烤烟中葡萄糖和果糖的量(约18%)高于香料烟(约10%);白肋烟中氨基酸的量远大于烤烟和香料烟,但几乎不含葡萄糖和果糖[19]。为了便于讨论,分别对烤烟、香料烟和白肋烟中各Amadori化合物的量(μg/g)与对应的氨基酸的量(μg/g)做商,结果如表6所示。可见,不同类型烟草中,各Amadori化合物的量与氨基酸的量的比值差异较大,表明美拉德反应在不同类型烟草中进行程度差异较大。其中,烤烟中各氨基酸转化成对应Amadori化合物的比例最高,其次是香料烟,白肋烟最低。例如,对于Fru-Ala/Ala,烤烟约为香料烟的6倍,约为白肋烟的160倍。这样大的差异是由美拉德反应动力学决定的,与不同类型烟草中反应物(即葡萄糖、果糖和氨基酸的量)紧密相关,也与影响反应动力学的因素相关,例如,不同类型烟叶的调制、陈化及工艺加工方式。
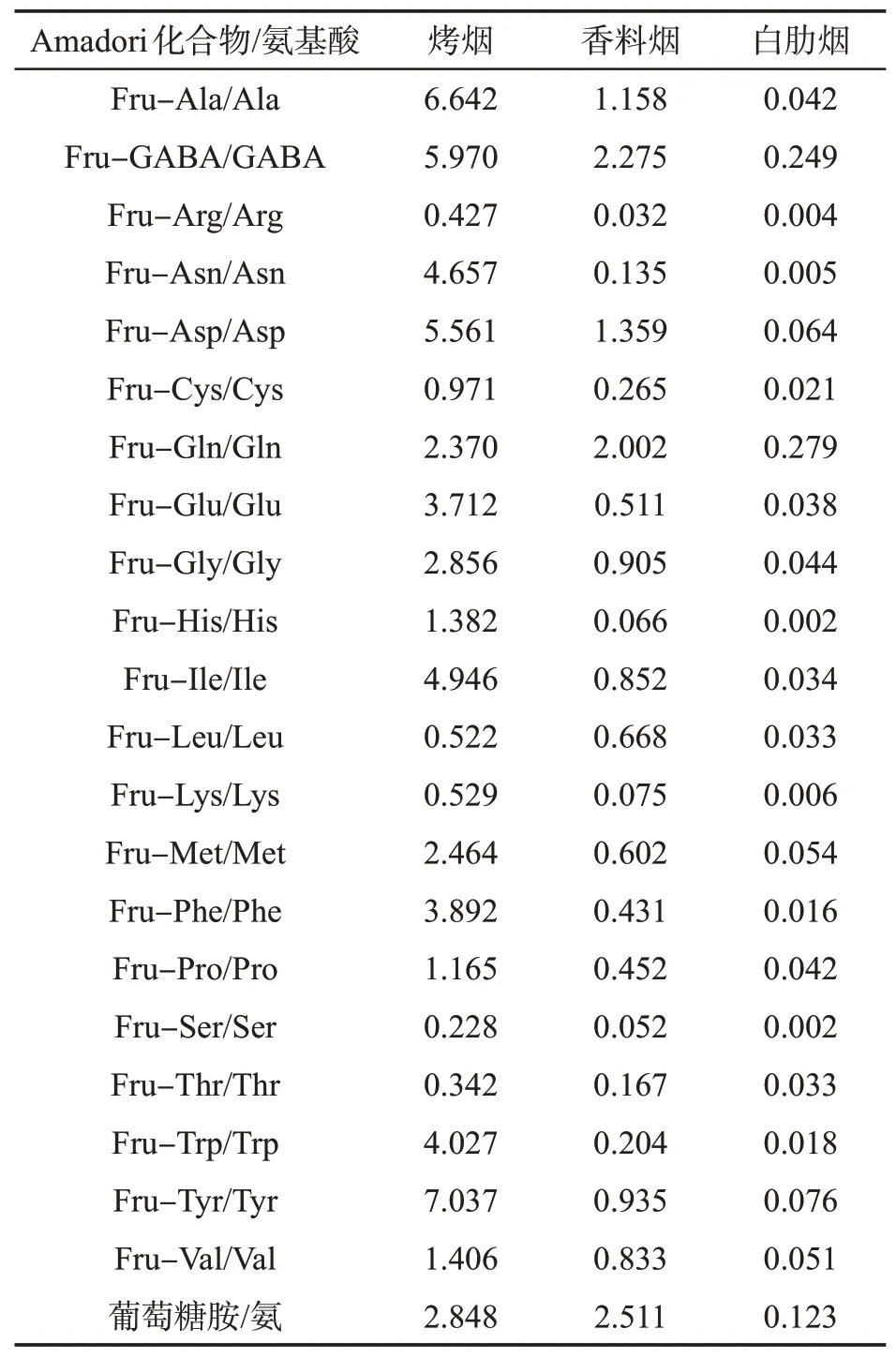
表6 不同类型烟草中Amadori化合物质量分数与氨基酸质量分数的比值Tab.6 Ratios between contents of Amadori compounds and contents of the related amino acids in tobacco leaves of different types
3 结论
①建立了10种有标准品的Amadori化合物与12种无标样的Amadori化合物的HPLC-MS/MS同时测定方法;②连续6 d测试中,14个Amadori化合物的日间精密度<10%,5个Amadori化合物的日间精密度在10%~15%之间;③烤烟、香料烟、白肋烟样品中Amadori化合物总量的质量百分比分别为2.47%、1.70%和0.14%。
