新型靶向人源BCMA 的CAR-T 细胞构建及其对BCMA阳性肿瘤细胞的杀伤作用观察
2021-04-23尚凤琴李晓瑞余卓营张野石冰洁王建勋
尚凤琴,李晓瑞,余卓营,张野,石冰洁,王建勋
北京中医药大学生命科学学院,北京102488
多发性骨髓瘤(MM)是一种以克隆性浆细胞积聚为特征的恶性肿瘤[1],目前MM 的治疗主要依靠四类药物,即蛋白酶体抑制剂、免疫调节剂、单抗类药物以及糖皮质激素。近年来虽然蛋白酶体抑制剂硼替佐米与免疫调节剂来那度胺联合治疗MM 已经取得了较好的效果,但仍无法改善患者的预后[2-4]。B 细胞成熟抗原(BCMA)是肿瘤坏死因子(TNF)受体超家族成员,选择性表达于终末分化的包括MM肿瘤细胞在内的 B 淋巴细胞表面[5]。BCMA 主要在浆细胞上表达,在人体主要器官的细胞上基本不表达[6-9]。嵌合抗原受体(CAR)是结合抗原识别域、共刺激域和 T 细胞激活域的一种蛋白[10-11]。BCMA 是CAR-T 细胞治疗MM 的一个理想靶抗原,经过改造的CAR-T 细胞能够特异性识别并消除表达靶向抗原的肿瘤细胞[9]。2019年3月—2020年1月,我们设计了一种新型靶向人源BCMA 的CAR 分子,采用逆转录病毒载体转导健康志愿者的T 细胞,成功制备Anti-BCMA-CAR-T 细胞,并观察其对BCMA 阳性肿瘤细胞的杀伤作用。现报告如下。
1 材料与方法
1.1 材料 细胞:逆病毒包装细胞系以及人慢性髓系白血病细胞K562、人BCMA 阳性 K562(K562-hB⁃CMA)细胞、食蟹猴BCMA 阳性K562(K562-cBCMA)细胞、人骨髓瘤B 细胞RPMI-8226 细胞系均购自美国ATCC 细胞库。主要试剂:RPMI 1640 培养基、AIM-Ⅴ培养基、胎牛血清(FBS)及PBS 缓冲液均购自美国Gibco 公司,荧光素酶底物、FuGene HD 转染试剂购自美国Promega 公司,淋巴细胞分离液、细胞凋亡试剂盒均购自北京友谊中联生物科技有限公司,白细胞介素2(IL-2)、OKT-3 购自北京义翘神州科技股份有限公司,干扰素γ(IFN-γ)ELISA 试剂盒购自美国 R&D 公司,Myc-PE、BCMA-BV421、CD3-APC等抗体均购自美国BD公司。
1.2 靶向人源BCMA 的CAR(BCMA-CAR)分子构建 实验室前期通过噬菌体展示技术筛选出亲和力较强的Anti-BCMA-CAR,再由通用生物公司合成BCMA ScFv 序列,由此构建靶向人源BCMA 的CAR分子,其结构为经典第二代CAR 分子结构,将BC⁃MA ScFv、CD8 铰链区和跨膜区、CD28 胞内区和CD3ζ胞内区依次串联,具体分子结构见图1。

图1 CAR分子结构示意图
1.3 pMFG-Myc-BCMA-CAR 质粒载体构建 合成BCMA ScFv 序列后,将序列与载体由XhoⅠ/NotⅠ双酶切,凝胶电泳的方式回收酶切后的目的片段与载体并纯化,16 ℃条件下将纯化后的目的片段与载体用T4 连接酶连接1 h。用DH-5α 感受态进行转化,挑取单克隆加入有氨苄抗性的LB 培养基中,37 ℃摇床孵育12~16 h。提取质粒DNA,酶切鉴定正确后进行测序,测序正确的质粒载体被命名为pMFG-Myc-BCMA-CAR。
1.4 T细胞制备及分组转导 抽取3位健康志愿者外周血各20 mL,采用Ficoll 密度梯度离心法分离单个核细胞(PBMC),重悬于AIM-Ⅴ完全培养基(添加10% FBS 和1%青—链霉素溶液),同时加入终浓度为100 ng/mL OKT-3和100 U/mL IL-2刺激T细胞增殖,37 ℃、5% CO2细胞培养箱中无菌培养。收集培养后的细胞即为人原代T 细胞,分为观察组和对照组。观察组将pMFG-Myc-BCMA-CAR 质粒载体包装为逆转录病毒载体并进行转导,对照组不做转导处理。转导48 h 后用Myc-PE 抗体通过流式细胞术检测Myc抗原表达,计算转导效率(即Myc表达率)。转导效率=Myc-PE 阳性细胞数/总活细胞数×100%。
1.5 细胞增殖能力观察 取两组细胞,以提取PBMC 当天记为第 0 天,之后每2 天(48 h)计数传代1 次,维持细胞密度为 1×106/mL、IL-2 终浓度为 100 U/mL。单次生长倍数为计数时细胞密度与上次处理时细胞终密度的比值,生长倍数为单次生长倍数的乘积,第0 天单次生长倍数和生长倍数均定为1。分别计算两组培养0~18 d的生长倍数对数值,并绘制增殖曲线。
1.6 两组细胞与RPMI-8226 细胞共培养时的体外增殖能力观察 采用CFSE 染色的T细胞增殖实验。从液氮中取出并复苏RPMI-8226 细胞,以1×106/mL接种于RPMI 1640 完全培养基(添加10%FBS 和1%青—链霉素溶液),37 ℃、5%CO2细胞培养箱中无菌培养。每隔48 h 计数传代1 次,观察细胞状态,当RPMI-8226细胞存活率达到80%以上时表示细胞状态良好,可以进行后续实验。将RPMI-8226 细胞用AIM-Ⅴ完全培养基(含IL-2)稀释至4×104/100 µL,取100µL接种于96孔板实验孔。取两组细胞,采用CFSE(用AIM-Ⅴ培养基稀释成10 µmol/mL)37 ℃水浴避光染色处理;调整细胞密度为1×104/100µL,取100µL 加在铺有RPMI-8226 细胞的孔中,即效靶比为1∶4。放入培养箱中共培养72 h,上流式细胞仪,CD3-APC染色标记T细胞,以CFSE现染(0 h)的T细胞作为阳性对照。通过CFSE 信号强弱比较两组共培养后的细胞增殖情况,CFSE 信号越弱(左移越明显)表明其增殖能力越强。
1.7 两组细胞对靶细胞的杀伤能力观察
1.7.1 两组细胞对BCMA 阳性肿瘤细胞的杀伤能力观察 ①采用流式细胞术。参照1.6 的方法培养RPMI-8226、K562细胞,用BCMA-BV421抗体通过流式细胞术检测其细胞表面BCMA 阳性率,结果显示分别为44.7%、0.4%,选择RPMI-8226 作为细胞杀伤的靶细胞。将两组细胞制备细胞悬液,参照1.6的方法进行实验铺板,与RPMI-8226 细胞以不同效靶比(1∶4、1∶1、4∶1,4×104/100 µL 靶细胞为 1∶1)共孵育(作为杀伤孔),并以仅有RPMI-8226 细胞的孔作为未杀伤孔;12 h 后300 g 离心5 min,收集细胞。染色缓冲液(含10% FBS 的PBS 缓冲液)冲洗1 遍,CD3-APC染色60 min,冲洗后重悬于配好的Annexin-Ⅴ-FITC缓冲液中,45 min后终止染色。用流式细胞仪检测靶细胞凋亡率,其中APC 阴性(靶细胞)且FITC 阳性(凋亡细胞)区域细胞为凋亡细胞。杀伤效率=杀伤孔靶细胞凋亡率-未杀伤孔靶细胞凋亡率。②采用荧光素酶化学发光实验。将两组细胞制备细胞悬液,参照1.6 的方法进行实验铺板,与RPMI-8226 细胞以不同效靶比(1∶4、1∶1、4∶1,4×104/100µL 靶细胞为1∶1)共孵育(作为实验孔),以仅有RPMI-8226 细胞的孔作为最大释放孔,以只有培养基的孔作为空白孔。12 h 后300 g 离心5min 去除上清,1×PBS缓冲液冲洗掉效应细胞,加入配制好的ONE-GloTM试剂,室温避光放置5 min。设置化学发光模式(LUM)、全白酶标板、震板10 s、PMT=500。计算杀伤效率,杀伤效率=1-(实验孔细胞凋亡率-空白孔细胞凋亡率)/(最大释放孔细胞凋亡率-空白孔细胞凋亡率)×100%。
1.7.2 两组细胞对人BCMA 阳性肿瘤细胞的特异性杀伤能力观察 采用流式细胞术。将K562-cBC⁃MA、K562-hBCMA 细胞接种于 RPMI 1640 培养基(添加10% FBS 和1%青—链霉素溶液),调整细胞密度为1×106/mL,37 ℃、5% CO2细胞培养箱中无菌培养。参照1.7.1 用BCMA-BV421 抗体通过流式细胞术检测K562-cBCMA、K562-hBCMA 细胞表面人BCMA 阳性率,结果显示分别为0.2%、73.9%。将两组细胞制备细胞悬液,分别与K562-cBCMA、K562-hBCMA 细胞以不同效靶比(1∶4、1∶1、4∶1,4×104/100 µL 靶细胞为1∶1)共孵育12 h。参照1.7.1采用流式细胞术检测杀伤效率。
1.8 两组细胞杀伤BCMA 阳性肿瘤细胞后上清IFN-γ 水平检测 采用ELISA 法。将两组细胞与RPMI-8226、K562-hBCMA 两种 BCMA 阳性肿瘤细胞分别共培养12 h,效靶比为4∶1(4×104/100 µL靶细胞为 1∶1)。收集细胞后 300 g 离心 5 min,吸取细胞上清,采用ELISA法检测上清IFN-γ 水平。
1.9 统计学方法 采用GraphPad Prism 8 统计软件。计量资料以±s表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组转导效率比较 观察组和对照组转导效率分别为44.83%、0.03%。见图2。
2.2 两组细胞增殖能力比较 两组培养0~18 d的生长倍数对数值比较差异均无统计学意义(P均>0.05)。见图3。
2.3 两组细胞与RPMI-8226 细胞共培养时的体外增殖能力比较 与对照组比较,观察组FITC 信号明显左移。见图4。
2.4 两组细胞在不同效靶比时对RPMI-8226 细胞的杀伤效率比较 流式细胞术检测结果显示,相同效靶比时,观察组杀伤效率均高于对照组(P均<0.05)。荧光素酶化学发光实验结果显示,效靶比为1∶1、4∶1 时,观察组杀伤效率均高于对照组(P均<0.05);效靶比为1∶4 时,观察组与对照组杀伤效率比较差异无统计学意义(P>0.05)。见表1。

图2 Anti-BCMA-CAR-T细胞与普通T细胞的转导效率图
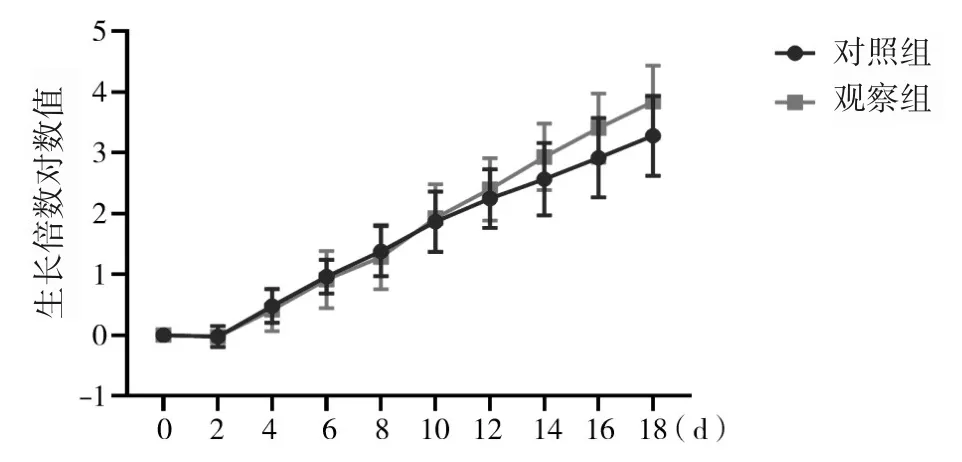
图3 两组培养0~18 d细胞增殖曲线

图4 两组细胞与RPMI-8226细胞共培养时的体外增殖情况
表1 两组细胞在不同效靶比时对RPMI-8226细胞的杀伤效率比较(%,±s)
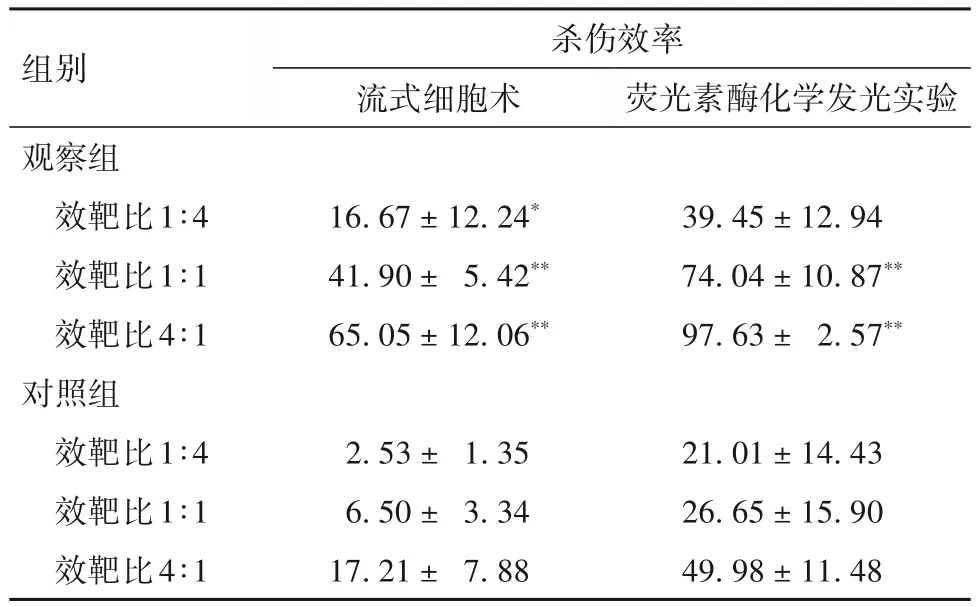
表1 两组细胞在不同效靶比时对RPMI-8226细胞的杀伤效率比较(%,±s)
注:与对照组相同效靶比比较,*P<0.05,**P<0.01。
组别观察组效靶比1∶4效靶比1∶1效靶比4∶1对照组效靶比1∶4效靶比1∶1效靶比4∶1杀伤效率流式细胞术16.67±12.24*41.90± 5.42**65.05±12.06**2.53± 1.35 6.50± 3.34 17.21± 7.88荧光素酶化学发光实验39.45±12.94 74.04±10.87**97.63± 2.57**21.01±14.43 26.65±15.90 49.98±11.48
2.5 两组细胞在不同效靶比时对K562-cBCMA、K562-hBCMA 细胞的杀伤效率比较 效靶比为1∶4时,两组细胞对K562-cBCMA、K562-hBCMA 细胞的杀伤效率比较差异均无统计学意义(P均>0.05);效靶比为 1∶1、4∶1 时,观察组细胞对 K562-hBCMA 细胞的杀伤效率明显高于同组K562-cBCMA 及对照组对K562-hBCMA的杀伤效率(P均<0.05)。见表2。
2.6 两组细胞杀伤RPMI-8226、K562-hBCMA 细胞后上清IFN-γ 水平检测 在杀伤相同BCMA 阳性靶细胞后,观察组上清IFN-γ水平均高于对照组(P均<0.05)。见表3。
表2 两组细胞在不同效靶比时对K562-cBCMA、K562-hBCMA细胞的杀伤效率比较(%,±s)
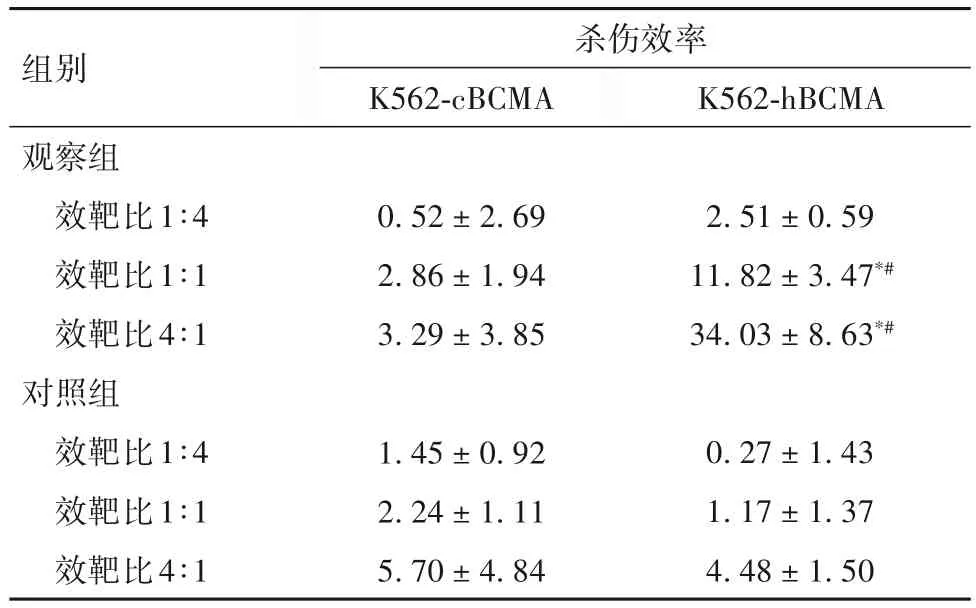
表2 两组细胞在不同效靶比时对K562-cBCMA、K562-hBCMA细胞的杀伤效率比较(%,±s)
注:与同组相同效靶比杀伤K562-cBCMA比较,*P<0.05;与对照组相同效靶比杀伤相同靶细胞比较,#P<0.05。
组别观察组效靶比1∶4效靶比1∶1效靶比4∶1对照组效靶比1∶4效靶比1∶1效靶比4∶1杀伤效率K562-cBCMA 0.52±2.69 2.86±1.94 3.29±3.85 1.45±0.92 2.24±1.11 5.70±4.84 K562-hBCMA 2.51±0.59 11.82±3.47*#34.03±8.63*#0.27±1.43 1.17±1.37 4.48±1.50

表3 两组细胞杀伤RPMI-8226、K562-hBCMA细胞后上清IFN-γ水平(pg/mL,-x± s)
3 讨论
MM 是一种以克隆性浆细胞积聚为特征的恶性肿瘤[1],主要表现为骨髓中浆细胞恶性增生、分泌大量单克隆免疫球蛋白(M 蛋白),并最终导致靶器官损害[12]。近年来,自体造血干细胞移植的方法得到推广,患者生存率也得到了显著提升,但是目前MM仍是一种不可治愈的疾病[13]。几乎所有的MM 患者最终都会复发或产生耐药性,而MM 的药物治疗效果会随着病情的反复而逐渐减弱。随着CAR-T 细胞在急性淋巴细胞白血病治疗中获得成功,其在MM 中的研究也陆续开展。目前运用CAR-T 细胞治疗 MM 的主要靶点有 CD38、BCMA、CS1(SLAMF7)等[14],其中 BCMA 基本上只在浆细胞上表达,是CAR-T 细胞治疗 MM 的理想靶抗原[9]。靶向 BCMA的CAR-T 细胞bb2121 已在MM 的治疗中得到应用[15]。
目前,Anti-BCMA-CAR-T 细胞靶向治疗 MM 已经取得了一定进展[16-17]。本研究采用的CAR 分子结构为第二代结构,共刺激分子为CD28,用逆转录病毒载体进行包装并成功转染人原代T 细胞,成功构建Anti-BCMA-CAR-T 细胞。本研究结果显示,两组培养0~18 d 的生长倍数对数值比较差异均无统计学意义,体外增殖实验结果显示观察组FITC 信号明显左移;提示Anti-BCMA-CAR 在转染T 细胞后对T细胞的增殖没有明显影响,但是与RPMI-8226 细胞共培养时的体外增殖能力明显升高,表明我们构建的CAR分子可以有效增强T细胞的增殖能力。为了验证Anti-BCMA-CAR-T细胞杀伤BCMA阳性肿瘤细胞的能力和特异性,本研究选用了多种BCMA 阳性表达的细胞模型,即RPMI-8226、K562-hBCMA、K562-cBCMA 等。结果显示,效靶比为 1∶1、4∶1 时,观察组对RPMI-8226、K562-hBCMA 细胞的杀伤效率均高于对照组,但两组细胞在相同效靶比时对K562-cBCMA 细胞的杀伤效率比较差异均无统计学意义;提示Anti-BCMA-CAR-T 细胞可特异性杀伤BCMA 阳性肿瘤细胞,且对人BCMA 阳性靶细胞具有杀伤特异性。
T 细胞与肿瘤细胞发生反应的一个关键特征是效应分子的释放,其中就包括促炎症细胞因子IFN-γ 的释放[18]。因此,检测 IFN-γ 的分泌情况可以从侧面验证T 细胞对肿瘤细胞的杀伤效率。本研究结果显示,在杀伤相同BCMA 阳性靶细胞后,观察组上清IFN-γ 水平均高于对照组,观察组上清 IFN-γ 为 200~1 500 pg/mL;说明我们构建的Anti-BCMA-CAR-T 细胞的杀伤能力可以被BCMA抗原激活,并释放大量杀伤性相关细胞因子IFN-γ。
综上所述,本研究成功构建了一种新型靶向人源BCMA 的CAR-T 细胞,该细胞能够有效且特异性杀伤人BCMA 阳性肿瘤细胞,下一步拟进行动物实验验证Anti-BCMA-CAR-T 细胞在体内对肿瘤细胞的杀伤效果。
