黄芩苷局部治疗对大鼠实验性牙周炎的影响①
2021-04-23吴仲蓬森巴特毛吾艾
吴仲蓬,林 静,2,森巴特·毛吾艾,龚 怡,冯 钰,赵 今,2
(1新疆医科大学第一附属医院/附属口腔医院牙体牙髓科,2新疆维吾尔自治区口腔医学研究所,乌鲁木齐830054)
慢性牙周炎(chronic periodontitis,CP)是由口腔细菌菌群和宿主免疫系统之间的共生关系被破坏而导致的[1]。长期以来,CP的治疗一直以牙周基础治疗为主,辅以抗生素治疗,但抗生素的长期应用可能会造成宿主的菌群失调及耐药性。黄芩苷(baicalin,BA)是从黄芩生根中提取的黄酮类化合物,具有抗炎、调节骨代谢及免疫反应、抗病毒以及肿瘤等药理作用,有望成为防治CP的有效药物[2]。本研究旨在观察局部应用不同浓度BA后牙周炎大鼠牙周组织及全身炎症的变化,来评估BA局部治疗CP的潜力。
1 材料和方法
1.1 主要试剂与主要仪器 试剂:黄芩苷(上海源叶);陆眠宁(盐酸塞拉嗪注射液)(吉林华牧);甘油(丙三醇)(天津大茂);苏木素-伊红染色试剂盒(北京中杉金桥);天狼星红染色液(武汉赛维尔);兔二步法试剂盒(北京中杉金桥);兔抗鼠多克隆一抗(RANKL、OPG)(北京博奥森);ELISA试剂盒(VEGF-A、IL-6)(武汉华美)等。仪器:包埋机(德国徕卡);石蜡切片机(德国徕卡);普通光学显微镜(德国徕卡);偏振光显微镜(日本尼康);全波长酶标仪(美国赛默飞世尔)等。
1.2 实验动物及分组 对平均体重(230±20)g的42只SD雄性大鼠(新疆医科大学动物实验中心动物提供)分笼饲养,平均温度22~24℃。1周的适应性喂养后随机将大鼠分为空白对照组(NG组)、阴性对照组(EP组)、甘油溶剂组(TRI组)、阳性对照组(IM组)、低浓度(0.01%)黄芩苷组(BL组)、中浓度(0.1%)黄芩苷组(BM组)以及高浓度(1%)黄芩苷组(BH组),每组6只。
1.2.1 牙周炎模型的建立 除NG组外,其余6组均需要进行牙周炎模型的建立。对大鼠进行肌注麻醉后,用4-0缝线在患牙牙颈部结扎,腭侧打结后并将丝线埋于龈沟。每日检查丝线的结扎情况。
1.2.2 分组处理 NG组:不作任何处理,2周后处死;EP组:单纯结扎造模,2周后处死。其余大鼠均在造模开始的同时对左上第一磨牙进行干预,并在干预后,禁水、食1 h,每天1次,直至2周后处死:TRI组:局部涂抹甘油;IM组:局部涂抹20µL 2%的盐酸米诺环素;BL组:局部涂抹20µL 0.01%的黄芩苷;BM组:局部涂抹20µL 0.1%的黄芩苷;BH组:局部涂抹20µL 1%的黄芩苷。
1.3 实验方法
1.3.1 临床指标的检测 为了确认造模是否成功,处死大鼠前,在EP组及NG组中各随机挑选一只大鼠对其左侧上颌骨进行X线拍摄。由1名不知分组的口腔执业医师负责测量患牙的PD及GI;另一名研究工作人员进行记录。其中,分别在牙齿颊舌面的近中、中央和远中6个位点测量PD值后取其平均值。
1.3.2 标本取材及切片 干预结束,所有大鼠都在麻醉下取腹部主动脉血并离心得到血清后于-80℃冻存。断头法处死大鼠,取左上颌骨置入10%福尔马林溶液中固定48 h,流水冲洗24 h后于10%乙二胺四乙酸中脱钙至针刺无阻力,随后脱水、透明、浸蜡及包埋,最后沿颊舌方向切成5µm厚切片,烤片过夜备用。
1.3.3 HE染色 常规HE染色,最后在普通光学显微镜(LEICA DM3000)下采图并观察。
1.3.4天狼星染色 依照说明书方法进行,最后在偏振光显微镜(Nikon Eclipse Ci-L)下采图并观察。
1.3.5 OPG与RANKL免疫组织化学染色依照试剂盒要求进行(一抗浓度为1:200),最后在普通光学显微镜(LEICA DM3000)下采图并观察。再采用Image-Pro Plus6.0软件对染色情况进行半定量分析,最后通过计算得出其平均光密度值。
1.3.6 ELISA实验 依照试剂盒要求对血清中IL-6及VEGF-A的表达进行检测,使用酶标仪得到其光密度值,最后根据标准曲线计算出IL-6以及VEGF-A的最终浓度。
1.4 统计学分析 采用SPSS23.0统计软件进行分析,结果采用均数±标准差(±s)表示。对同种测量值为连续数值型变量且服从正态分布的组间比较采用单因素方差分析;对不符合正态分布的数据,则采用K个独立样本非参数检验。检验水准:P<0.05表示差异具有统计学意义。
2 结果
2.1 NG组和EP组患牙X线片表现及各组患牙大体观察 整个实验期间,大鼠的身体状况良好,未出现疾病或死亡情况。处死前,每组大鼠体重的变化均不大。X线片可见EP组患牙牙槽骨高度低于NG组,确认造模成功。见图1。大体观察:NG组牙龈无炎症表现;TRI组与EP组牙龈炎症表现明显;BL组可见牙龈炎症稍有逆转;IM组、BM组及BH组可见牙龈几乎已恢复正常。

图1 NG组和EP组患牙X线片
2.2牙周探诊深度与牙龈指数IM组、BM组及BH组的PD以及GI都明显低于TRI组与EP组,见图2。

图2 各组牙周探诊深度与牙龈指数对比
2.3 HE染色结果 NG组:牙龈上皮完整,未见炎症细胞浸润;EP组:龈沟内可见结扎痕迹,其周围大量炎症细胞浸润;TRI组:与EP组差别不大;IM组:牙周袋底周围的炎症细胞明显减少;BL组:沟内上皮明显破坏,但牙周袋底周围的炎症细胞相对减少;BM组:牙周袋底附近的炎性细胞明显减少;BH组:牙周袋底附近的炎症细胞几乎完全消失。见图3。

图3各组HE染色结果(×100)
2.4天狼星红染色结果NG组主纤维束排列致密、规则;EP组胶原量明显减少,甚至断裂;BH组纤维束排列虽稍有紊乱,但排列紧密、附着有力。见图4。

图4 天狼星红染色结果(×400)
2.5免疫组织化学染色结果与NG组相比,TRI组及EP组的RANKL表达明显升高,且差异有统计学意义(P<0.01);与EP组相比,IM组、BM组及BH组的RANKL表达明显降低,且差异有统计学意义(P<0.01)。OPG的表达与炎症程度成反比,但在不同组间OPG表达的差异并不明显:与NG组相比,TRI组及EP组的OPG表达明显降低,且差异有统计学意义(P<0.01);与EP组相比,IM组、BM组及BH组的OPG表达明显升高,且差异有统计学意义(P<0.01)。见表1。RANKL与OPG在牙周膜中的特异性表达见图5。
表1牙周膜中OPG与RANKL的平均光密度值(±s)

表1牙周膜中OPG与RANKL的平均光密度值(±s)
注:MOD为平均光密度值;与NG组相比,P<0.05;与EP组相比,*P<0.05。
组别NG组EP组TRI组IM组BL组BM组BH组n 6 6 6 6 6 6 6 RANKL的MOD 0.26±0.009 0.53±0.009 0.52±0.013 0.27±0.008*0.52±0.005 0.27±0.009*0.26±0.015*OPG的MOD 0.46±0.017 0.32±0.007 0.33±0.009 0.45±0.011*0.34±0.011 0.42±0.014*0.46±0.023*RANKL/OPG 0.56 1.66 1.57 0.60 1.53 0.66 0.57

图5牙周膜中OPG与RANKL表达情况(×400)
2.6 ELISA分析结果EP组中IL-6与VEGF-A的表达较NG组均有明显的升高,且差异有统计学意义(P<0.05),而TRI组与EP组之间的差异无统计学意义(P>0.05);IM组、BM组及BH组的IL-6与VEGF-A的表达水平显著低于EP组,且差异有统计学意义(P<0.05)。见表2。
表2大鼠血清中IL-6与VEGFA的表达情况(±s)
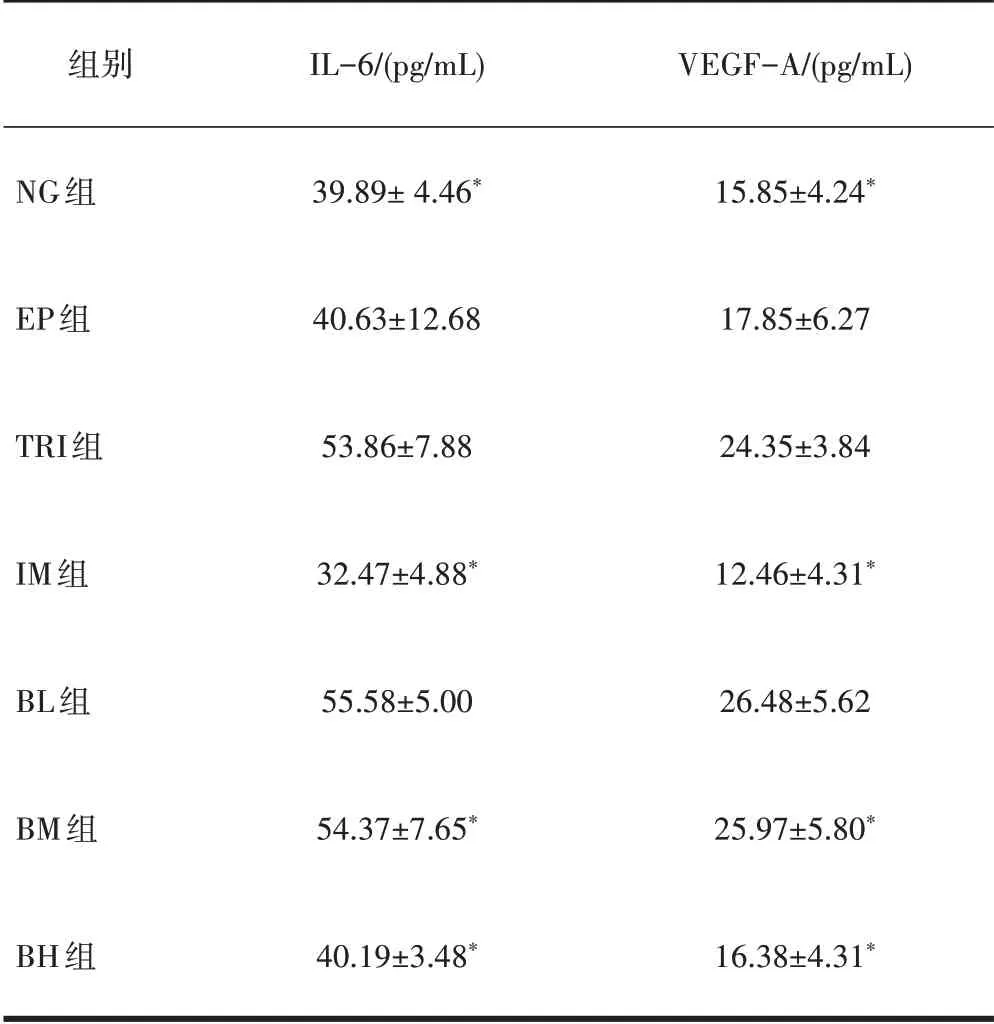
表2大鼠血清中IL-6与VEGFA的表达情况(±s)
注:与EP组相比,*P<0.05。
组别NG组EP组TRI组IM组BL组BM组BH组IL-6/(pg/mL)39.89±4.46*40.63±12.68 53.86±7.88 32.47±4.88*55.58±5.00 54.37±7.65*40.19±3.48*VEGF-A/(pg/mL)15.85±4.24*17.85±6.27 24.35±3.84 12.46±4.31*26.48±5.62 25.97±5.80*16.38±4.31*
3 讨论
CP作为口腔的慢性感染性疾病,被认为是人类的第六大常见病[3],约占世界人口的10%~15%[4],并且其发病率也逐渐趋于年轻化[5]。CP的发生和发展与菌斑的存在紧密相关,细菌及其代谢产物造成了局部牙周组织的炎症反应[6]:血管水肿、扩张以及一系列促炎细胞因子(如VEGF-A、IL-6[7])的释放与浸润,其中RANKL/OPG比值的增加加剧了牙槽骨的吸收[8],最终导致了牙齿的松动、脱落。因此,寻求一种能抗菌消炎并可以保护牙周组织的新型药物是众多学者研究和探索的方向。
中药因其极低的成本及毒性而受到越来越多的学者关注。其中,BA是黄芩干生根中的六种黄酮类化合物之一,是黄芩的主要药用部位[9]。有研究证实了黄芩煎剂对伴放线聚集杆菌等多种牙周致病菌都具有抑制作用[10];而且发现当其与溶菌酶结合时还可以协同提高溶菌酶的抗菌活性[11],因此作出假设:BA是一种很有潜力的治疗细菌性感染的药物。BA还具有广泛的抗炎作用:芍药苷与BA(5µg/mL)联合使用能有效地下调核因子κB的抑制蛋白α及其他促炎细胞因子[12]。一定浓度的BA还具有正向调节骨代谢的作用:当BA浓度处于2µmol/L以上时可以抑制破骨细胞的形成[13],其作用可能与MAPK(ERK)信号通路及其下游因子c-Fos/NFATc1的调控有关。另外,林鹏等[14]发现BA还能够增强正畸保持阶段牙周组织中Runx2的表达,加快牙槽骨的改建,从而抑制正畸牙齿的复发。Cao等[15]的研究还提示BA可以抑制基质金属蛋白酶-1的mRNA水平并且增加人类牙周膜细胞中I型胶原的mRNA水平,这些也都表明BA对牙周膜的胶原纤维或许存在保护作用。
目前关于BA局部治疗CP的研究较少。国内外学者发现BA的灌胃治疗可以达到控制实验性牙周炎的目的,这一过程可能与MAPK信号通路[16]、环氧化酶2与一氧化氮的抑制[17]、Toll样受体2与Toll样受体4[18]的表达有关。可是对于CP来说更好的治疗手段应该是局部用药,因为这样不仅可以通过降低药物浓度来减少全身的不良反应,而且也是最直接、最精准的给药方式[19]。本研究的优点在于从牙周软组织、牙槽骨以及全身炎症三方面的改变来验证了BA局部应用的药效:HE染色与天狼星红染色反映了各组牙周软组织之间的组织学差异;RANKL/OPG比值的变化反映了各组牙槽骨之间的代谢差异;血清中IL-6与VEGF-A的表达水平反映了各组大鼠之间全身炎症的差异。其次,分组设计较为完善,不仅设立了空白对照组、不同浓度的实验组、阳性对照组与阴性对照组还设立了甘油溶剂组,借此来消除甘油溶剂对CP影响的可能。但本实验也有些许不足,例如只证实了BA的局部干预可以起到保护大鼠实验性牙周炎的作用,但其具体的作用机制还有待于进一步研究,而且对于BA的局部应用并未探讨其安全性,后期还应该通过口腔黏膜刺激性试验及局部吸收试验证实其安全性。
综上所述,BA作为一种常用的中药,不仅具有抗炎、抗氧化、抗病毒、抗肿瘤、调节骨代谢及免疫反应等作用,而且可以通过保护牙周膜胶原纤维、抑制牙槽骨的吸收、降低全身的炎症水平有效改善CP。因此BA有望成为临床上防治CP的有效药物。
