LC-MS/MS测定牛奶中氟虫腈及代谢物残留量
2021-04-22王永芳娄婷婷温华蔚周磊
王永芳,娄婷婷,温华蔚,周磊
(1.天津海关动植物与食品检测中心,天津300457;2.天津海关 工业产品安全技术中心,天津300457)
0 引 言
氟虫腈是一种苯基吡唑类农药[1,2]。氟虫腈经水解及光解作用,生成氟虫腈亚砜、氟虫腈砜、氟甲腈[3],相关部门对氟虫腈及代谢物的毒性及对环境友好度进行了评估[4-5],氟虫腈代谢产物的毒性比母体大很多[6],使用不当会损害肝脏、肾脏等,我国于2009年10月1日起禁用氟虫腈,欧盟一些国家也要求禁止使用氟虫腈进行防虫[7-8]。
我国禁止在用于食品加工的动物养殖过程中使用氟虫腈。国际上,牛奶中氟虫腈最大残留限量要求如下:《日本肯定列表》为0.02 mg/kg;欧盟(EU)No750/2010为0.005 mg/kg。国内GB 2763-2019中明确了氟虫腈在生乳中的限量[9],该限量标准对氟虫腈检测的相关标准中未指定生乳的检测方法[10-13],且目前我国未制定乳制品中氟虫腈残留量检测的相关标准。目前检测氟虫腈的文献[14-20]越来越多,其中检测方法涉及到动物源性食品的基质大部分为鸡蛋和禽肉类,牛奶基质较少。本文采用乙腈提取,PEP Plus萃取柱进行净化,能快速准确地测定牛奶中氟虫腈及代谢物的含量。
1 实 验
1.1 材料和仪器
乳制品:牛奶、奶粉(市售);氟虫腈、氟甲腈、氟虫腈砜、氟虫腈亚砜,纯度>98.0%,德国Dr.Ehrensorfer公司;乙腈、正己烷、丙酮,色谱纯级,迪马科技;乙酸铵(>98.0%),氯化钠(>99.5%);国药集团化学试剂有限公司;甲酸(色谱纯)、Cleanert PEP Plus(60 mg/3 m L),博纳艾杰尔;Florisil固相萃取柱(1 g/6 mL),色谱科;C18固相萃取柱(150 mg/3 mL),博纳艾杰尔。
液相色谱串联质谱仪,安捷伦1290-6460;AL204-IC型电子天平,梅特勒-托利多仪器有限公司;Promax-2020型水平往复振荡器,德国Heidolph公司;XH-D型涡旋混合器,上海汗诺仪器有限公司。
1.2 方法
1.2.1标准溶液配制
准确称取10.0 mg标准物质,用乙腈溶解,配制成质量浓度1 mg/mL的标准溶液,于-20℃冰箱进行保存。根据检测需要,用乙腈逐级稀释至所需浓度。
工作液的配制。选择空白牛奶基质,取适量氟虫腈及代谢物混合标准溶液配制成一系列浓度的工作液,现用现配。
流动相配制。10 mmol乙酸铵-0.1%甲酸-水溶液:称取乙酸铵0.78 g,溶解于1 L高纯水中,再加入1 mL甲酸,摇匀,常温保存,现用现配。
1.2.2色谱条件
色谱柱:Eclipse C18,100 mm×2.1 mm,1.7μm;流速为0.3 mL/min;柱温为30℃;进样量为10μL;流动相为流动相A:0.1%甲酸乙腈;流动相B:10 mmol乙酸铵和0.1%甲酸水溶液,梯度洗脱程序:0~1 min,10%A;1~7 min,100%A;7~8 min,10%A。
1.2.3质谱条件
离子化模式:电喷雾离子源,负离子模式扫描;检测方式:多反应监测模式;电喷雾电压:4 000 V;雾化气压力:40 psi;离子源温度:350℃;其他参数如表1所示。
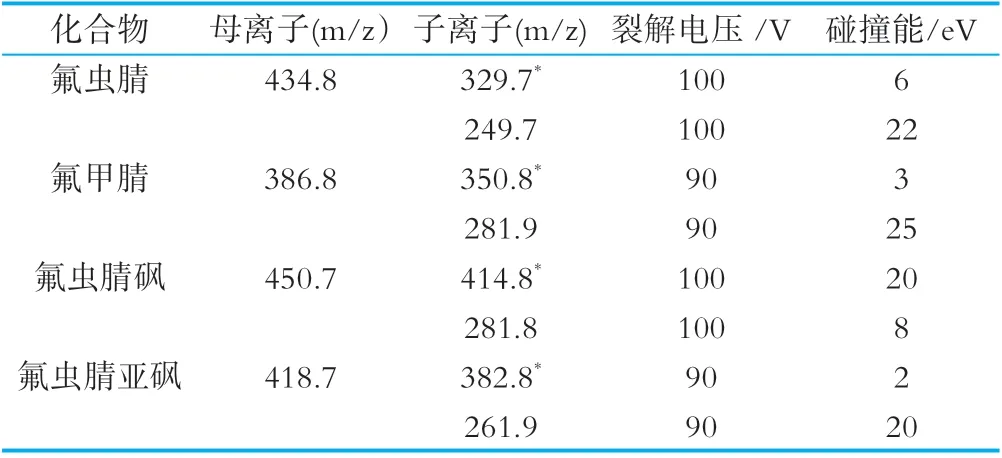
表1 氟虫腈及其代谢物质谱参数
1.2.4样品前处理
1.2.4.1样品提取
取5 g牛奶(精确至0.01 g)试样于50 mL离心管中,加入含1%甲酸乙腈10 mL,加入2 g的NaCl,涡旋混匀后,进行超声提取10 min,转速为5 000 r/min离心5 min,上清液待净化。
1.2.4.2样品净化
取上述待净化提取液2 mL,加入到PEP Plus萃取柱中,前0.5 mL流出液弃去,收集剩余的上样流出液。过0.22μm过滤膜,上机测定。
2 结果与讨论
2.1 前处理方法的优化
本实验牛奶基质中主要成分为水,还含有蛋白质、脂肪、乳糖及矿物质等,其中的蛋白质、脂肪和一些维生素会干扰目标物的提取。关于动物源性食品中氟虫腈残留量的测定的文献[21-22]中提取试剂均选择了乙腈,由于丙酮和乙酸乙酯在提取目标物的同时,会萃取出含量较高的脂肪,不利于下一步净化处理,而乙腈在提取过程中,加入1%甲酸能很好的沉淀蛋白[23],减少脂肪和其他杂质的溶出,能减少基质对氟虫腈及其代谢物的干扰,加入适量NaCl盐析后更好地进行净化。本实验采用含1%甲酸的乙腈作为提取溶剂。
2.2 净化方法的选择和优化
牛奶中含有蛋白质和脂肪等成分,经过乙腈提取后,通过过净化,能更好的去除杂质的干扰,同时减少提取液中杂质对检测仪器的污染。本研究中选择Cleanert PEP Plus固相萃取柱,Florisil固相萃取柱、Waters Oasis PRiME HLB净化柱,氨基石墨复合柱4种净化柱进行试验比较。本研究中Florisil固相萃取柱、Waters Oasis PRiME HLB净化柱,氨基石墨复合柱需进行活化和洗脱,Cleanert PEP Plus固相萃取柱直接对提取液进行净化。从目标物的回收率实验和实验净化所需时间综合分析,氨基石墨复合柱和Cleanert PEP Plus固相萃取柱回收率相当,回收率在80%以上,氨基石墨复合柱需要活化洗脱,所需时间是Cleanert PEP Plus固相萃取柱净化时间的5倍时间,Florisil固相萃取柱、Waters Oasis PRiME HLB净化柱回收率偏低,综上最终选择Cleanert PEP Plus净化柱进行实验。4种净化柱的回收率如图1所示。

图1 不同净化柱对氟虫腈及其代谢物回收率的影响
2.3 液相和质谱条件的优化
氟虫腈及其代谢物的极性为弱极性,查阅相关文献[24-27],比较C8和C18色谱柱,如图2所示,从目标物分离程度及峰形比较,Eclipse C18色谱柱对目标物的分离效果和峰形较好,最终选择Eclipse C18色谱柱,考虑到样品基质中杂质的干扰,为使目标化合物获得较好的分离和峰形,降低基质效应的干扰,对下列几种流动相进行比较:A:0.1%甲酸乙腈-10 mmol/L乙酸铵水溶液(含0.1%甲酸);B:乙腈-水;C:甲醇-水,如图3所示,通过对流动相进行考察,甲醇-水(C),目标物分离程度不如乙腈-水(B)、0.1%甲酸乙腈-10 mmol/L乙酸铵水溶液(含0.1%甲酸)(C)两种流动相,通过相应强度进行比较,0.1%甲酸乙腈-10 mmol/L乙酸铵水溶液(含0.1%甲酸)(A)使目标物相应强度更好,最终选择乙腈-10 mmol/L乙酸铵水溶液(含0.1%甲酸)作为流动相。

图2 氟虫腈色谱

图3 3种不同流动相氟虫腈的色谱
氟虫腈及代谢物的分子结构中有较多的氟、氯等卤代基,在电离过程中,分子中易失去氢质子,形成负离子,所以本方法在电喷雾离子源(ESI)下采用负离子模式进行扫描。选择多反应监测模式进行分析。首先对目标物进行一级质谱分析,确定出4种目标物的母离子,在MS2 SIM扫描模式下优化毛细管出口电压(Fragmentor)参数,按照优化出的参数进行二级质谱分析,通过Product Ion扫描模式进行分析,选取信号最强的两个子离子,通过MRM扫描模式进一步优化,确定为各自的定量参数,见表1。按上述优化的前处理参数和仪器参数进行实验,见图4~5。

图4 空白牛奶样品多反应监测(MRM)色谱

图5 空白基质中添加1μg/kg水平4种化合物的MRM色谱
3 方法验证
3.1 基质效应的考察
在选用质谱进行样品分析时,会存在基质效应(matrix effect,M E)问题。空白基质配制的标准曲线的斜率与溶剂配制的标准曲线的斜率相比,比值越接近1,说明基质效应越不明显,通常采用同一样品的空白基质配制曲线进行校正定量,或者选用稳定同位素内标法等方法减少基质效应的干扰[28]。本方法选择空白牛奶基质,用该空白基质溶液和纯试剂甲醇分别配制一定梯度浓度的标准曲线,斜率比值如表2,通过表2,可以看出,氟虫腈、氟甲腈、氟虫腈砜和氟虫腈亚砜在牛奶基质中的基质效应可以接受,基质效应不是很明显,本实验为降低基质效应的影响,选用相应的空白基质配制曲线,对数据进行处理。

表2 氟虫腈及其3种代谢物在牛奶基质中的基质效应 %
3.2 方法的线性及灵敏度
在空白牛奶基质中,分别添加质量分数为1,2,5,10,20,50μg/kg梯度水平制作基质曲线,氟虫腈及代谢物曲线的线性关系良好,R2均大于0.99,各化合物的定量离子的信噪比均大于10,氟虫腈及代谢物的定量限为1μg/kg,以3倍信噪比确定为定性限,氟虫腈及代谢物的定性限为0.6μg/kg,线性方程、相关系数R2等参数见表3。
3.3 方法的准确度和精密度
在空白牛奶样品,分别添加1,2,5μg/kg 3个质量分数,每个质量分数进行6平行实验,氟虫腈及代谢物的回收率为82.5%~97.4%,变异系数4.0%~10.5%范围内,见表4。其结果符合GB/T 27404-2008《实验室质量控制规范食品理化检测》的相关要求。
3.4 实际样品分析
从超市购买20批次牛奶样品,按照优化的检测方法进行样品处理检测,该20批次牛奶样品中均未检测出氟虫腈及3种代谢物。

表3 氟虫腈及代谢物的线性方程、相关系数、线性范围、检出限、定量限数据
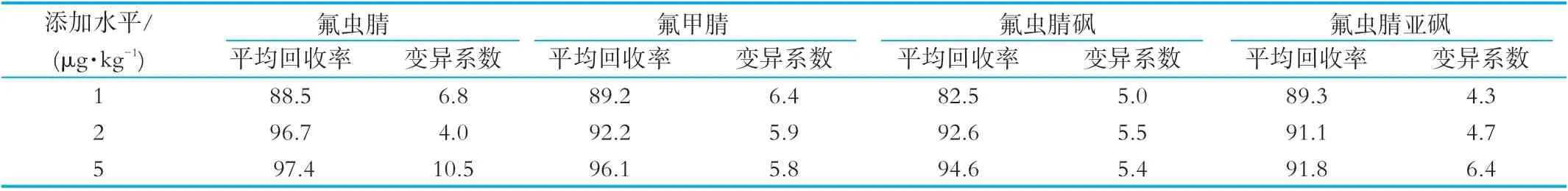
表4 方法的平均回收率和精密度(n=6) %
4 结 论
本研究优化了样品前处理萃取试剂参数,选择酸化乙腈进行提取,优化了净化参数,选择Cleanert PEP Plus固相萃取柱进行净化,优化了色谱及质谱参数,建立了LC-MS/MS法测定牛奶中氟虫腈及其三种代谢物的测定方法。该方法的回收率、精密度、线性、测定低限等均满足相关标准的技术要求,适用于牛奶中氟虫腈及代谢物的快速检测。该研究方法优点:定量限低于国内外牛奶中氟虫腈限量值,完全满足限量检测需求,其次,该方法检测效率高,酸性乙腈提取效率高,净化柱无需活化,优化后的仪器条件等因素大大缩短了检测目标物的时间,便于对大批量牛奶中氟虫腈进行快速筛查。国家强制标准GB 2763-2019中规定了生乳的限量,但没有相关的检测标准,该方法的建立可以为建立相关标准提供数据参考,同时也可以为相关执法部门提供技术支撑,从而保障进出口乳制品的质量。
