腹膜后平滑肌肉瘤侵犯肾静脉、下腔静脉1例报告
2021-04-22黄正楷易小敏邹君杰王增军居小兵
黄正楷,易小敏,邹君杰,顾 民,王增军,居小兵
(南京医科大学第一附属医院/江苏省人民医院,1.泌尿外科,2.血管外科,江苏 南京,210029)
1 病例资料
本院收治1例32岁女性患者,3个月前无明显诱因出现右侧间断性腰痛,可自行缓解,未予以重视。2020年3月28日行B超检查及CT检查均显示,右肾占位,遂收入本院进一步诊治。查体脉搏95次/min,收缩压154 mmHg,舒张压99 mmHg。腹壁柔软,未触及腹部包块,无压痛、反跳痛,双肾区无叩痛。完善腹部MRI显示,右肾门旁肾实质内可见不规则软组织块影,分叶状,大小约7.9 cm×9.3 cm×8.3 cm,邻近肾实质明显受压,肾盂肾盏变形,肾盂有少量积液,病灶以等T1不均质长T2信号为主,扩散加权成象(DWI)上呈高信号,病灶内见斑片状短T1信号,增强CT见肿瘤压迫右肾、下腔静脉。腹主动脉周围无肿大淋巴结,腹腔未见积液,见图1。生化指标显示: 肌酐61.1 μmol/L,尿素氮4.87 mmol/L,乳酸脱氢酶352 U/L,α-羟丁酸脱氢酶259 U/L,磷1.58 mmol/L。
患者2020年4月3日行右肾根治性切除联合下腔静脉(IVC)人造血管移植术。术中右腹膜后扪及一隆起,约10 cm×9 cm×8 cm。术中探查肿瘤位于IVC右侧及前方,呈浸润性生长,包绕侵犯IVC约2/3管径,侵犯IVC壁长约7 cm,无法分离IVC血管壁,右肾静脉被肿瘤完整包裹、不可见。肿瘤前内侧与十二指肠粘连紧密,浆膜层少许受累,肾门及腹主动脉周围未见明显淋巴结肿大。游离结扎离断右肾动脉、腰静脉、输尿管并清扫腔静脉周的淋巴脂肪组织。患者全身肝素化后,无损伤血管阻断钳依次阻断肿瘤下方IVC、左肾静脉、肿瘤上方IVC后,完整切除右肾、腹膜后肿瘤及受肿瘤侵犯之IVC血管壁,残余IVC血管壁呈条索状,不足以行血管修补,遂以涤纶纤维编织人造血管替代缺损段IVC。术中左肾静脉阻断35 min,腔静脉阻断45 min,手术共耗时近5 h,出血约400 mL。术后复查肾功能结果显示,肌酐72.6 μmol/L,尿素氮5.14 mmol/L。
术后病理检查结果提示为梭形细胞恶性肿瘤,约8.5 cm×7.9 cm×7.2 cm,肿瘤位于肾周脂肪囊内,紧靠肾门,肉眼观察与肾脏实质及周围其他结构紧密粘连,结构不清,显微镜下观察其未累及肾脏实质。免疫组化检查结果显示,肿瘤细胞,Desmin(-),SMA(+),Myogenin(-),MyoD1(-),Calponin(+),SMMHC(+),Ki67(80%+),CK-pan(-),CK-L(-),HMB45(-),MelanA(-),SOX10(-),S-100(-),CD34(-),CD117(-),DOG-1(-)。荧光原位杂交技术(FISH)检测结果显示,MDM2基因无扩增(图2)。因此,腹膜后肿物符合平滑肌肉瘤诊断标准,紧靠但未累及肾脏实质。
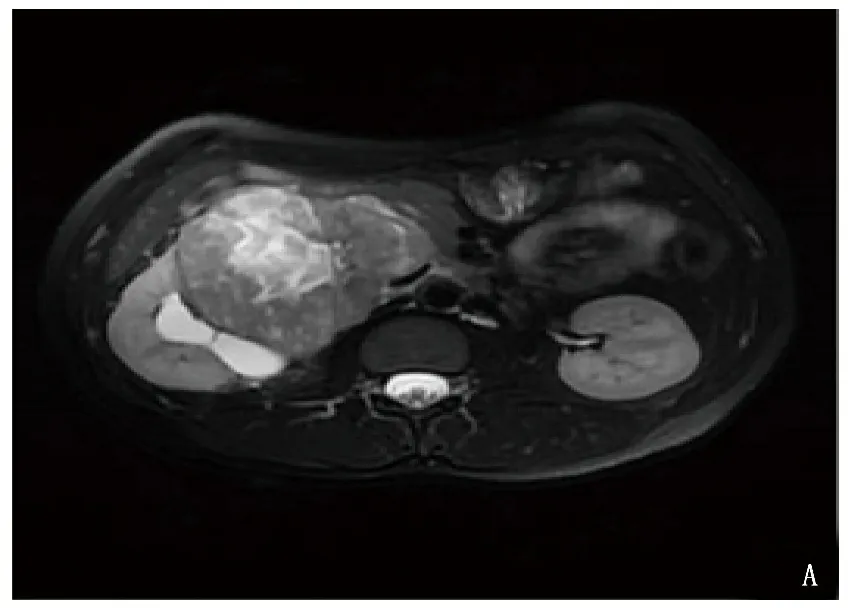
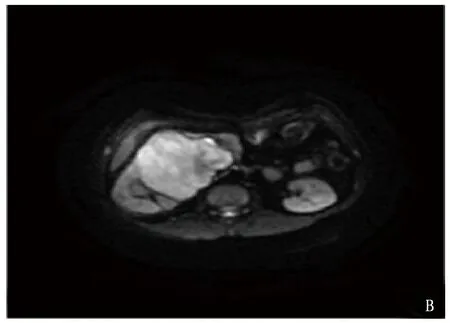
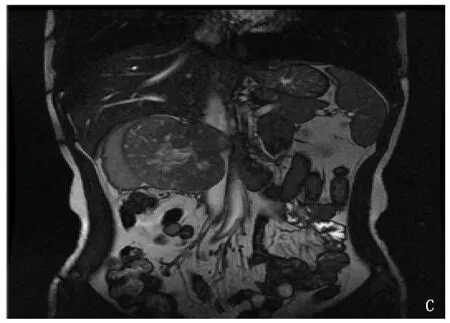

A: MRI T2WI 图; B: MRI DWI图; C: MRI冠状面重建; D: 增强CT图。


A: HE染色(放大倍数40倍); B: 荧光显微镜下FISH检测
术后予以多柔比星40 mg(第1天)、环磷酰胺1g(第1天)联合顺铂40 mg(第1~3天)方案辅助化疗,并采用利伐沙班10 mg/d口服抗凝治疗。术后1个月,复查CT血管成像(CTV)可见IVC左肾静脉分叉下缘水平管腔变细,管腔内偏右侧见片状充盈缺损,上下累及范围约2.7 cm,考虑血栓形成,治疗方案改为利伐沙班20 mg/d口服抗凝治疗,定期复查CTV。随访6个月,患者未见明显不适、无复发转移。
2 讨 论
腹膜后平滑肌肉瘤(RLS)较少见,约占原发性腹膜后肉瘤的28%,来源于腹膜后平滑肌组织、血管或中肾管残留物,肿瘤大小可超过10 cm[1]。中位发病年龄50岁左右,其中女性发病率更高[2-4]。RLS主要表现为大的软组织肿块,临床症状多为腹痛[5],这与腹膜后间隙相对宽大疏松、脏器较少有关,常在体检时偶然发现或发现时肿瘤已经生长较大[6]。文献[7-8]指出,部分RLS来源于IVC或生长侵犯IVC、肾静脉等大血管。这部分病例症状和体征与侵犯IVC的位置有关,侵犯肝上IVC会导致布加综合征,表现为肝脏肿大、黄疸、腹水等; 侵犯中段IVC会阻碍肾静脉血流,导致肾功能不全; 侵犯肾下IVC则会引起下肢水肿[9]。本次报道的年轻女性患者肿瘤直径达9 cm,虽侵犯中段IVC及右肾静脉,但以间歇性腰痛为首发症状,缺乏特异性临床表现。
影像学检查是诊断腹膜后肿瘤的重要手段,但明确提示RLS有一定难度,其影像学表现与肾癌及其他类型腹膜后恶性肿瘤有较大的相似性。CT平扫可见密度不均匀肿块,边界不清,多见中心坏死囊变,钙化少见,增强扫描表现为轻中度或明显强化,呈渐进性强化[10]。MRI表现为T1WI低或等信号,T2WI实性部分为高信号,囊变坏死部分相对肌肉呈高信号,增强扫描强化方式与CT相似[9]。影像学检查不仅提供了外科手术所必须的解剖资料,也帮助发现转移灶,同时也可与脂肪肉瘤、淋巴瘤及淋巴增生性疾病、神经源性肿瘤、恶性纤维组织细胞瘤等腹膜后肿瘤相互鉴别。由于上述肿瘤影像学表现存在部分重叠,因此最终确诊仍依赖术后病理诊断。
外科手术是治疗RLS的主要手段,是否完整切除肿瘤是影响预后的重要因素[11- 12]。RLS通常倾向于膨胀性生长而非浸润周围脏器,但侵犯大血管则不同,如侵犯IVC[13]。侵犯IVC的平滑肌肉瘤5年术后生存率为31.0%~66.7%[14],为了获得最佳治疗效果,此时需完整切除肿瘤及所侵犯血管并重建血管。根据肝静脉和肾静脉的解剖位置,IVC被分为上中下3个节段,侵犯不同节段与不同范围IVC的肿瘤其手术方式也不同,如IVC切除范围较小时采用单纯修补术,非环行切除时采用自体补片修补术,切除范围较大时采用人造血管移植术,中下段IVC切除时的肾静脉成形术等[15-16]。本例患者肿瘤组织完整包裹右肾静脉,且侵犯IVC范围广,极为少见。完整切除肿瘤时IVC缺损大,因此不能单纯修补IVC,由于右肾连同肿物一同切除,因此直接使用人造血管修整匹配缺损段重建IVC。文献[17]表明,人造血管重建后可能出现血栓、移植物折叠等并发症。本例患者术后定期行CTV对重建血管情况进行随访,术后1个月余,发现管腔内血栓形成,因而加强了抗凝药物治疗。目前术后放化疗对RLS的作用尚存争议,加用术后放疗可以降低局部复发风险[6,18-19]。中国研究[20]报道,吉西他滨联合多西他赛治疗复发/转移性RLS疾病控制率达50%,中位无进展生存期为4个月,中位生存期为18个月。近年来也有研究[21]显示,帕唑帕尼作为一种多激酶抑制剂和血管生成抑制剂对治疗平滑肌肉瘤有较大潜力。由于RLS常出现局部复发和远处转移,因此需要综合治疗与定期随访,对复发的病灶也应积极行再次手术治疗。
