青翘水提物对人肠道菌群的影响
2021-04-21薛焕焕元昕唐建开陈廷贵张立伟
薛焕焕,元昕,唐建开,陈廷贵,张立伟
(山西大学 分子科学研究所,化学生物学与分子工程教育部重点实验室,山西 太原030006)
0 引言
肠道菌群具有1000多个不同的物种,其组成结构受到宿主遗传、地理、出生方式、饮食、抗生素以及益生菌的影响,在健康、代谢和营养中起着重要作用[1]。近年来,越来越多的研究证据表明,肠道菌群作为治疗靶点已成为了解疾病发生和发展的新领域。在传统临床应用上,大多数中药是水煎液口服给药。口服后,中药化学成分,特别是对于人体难以吸收的中药成分,可以到达结肠从而与肠道菌群发生相互作用。肠道菌群不仅可以代谢中药化学成分,而且中药化学成分也可以有效地调节肠道菌群的组成及其代谢产物短链脂肪酸(SCFAs),从而改善肠道菌群的功能以及宿主的相关病理状况[2]。中药对肠道菌群的调节机制主要包括两种类型:直接或间接地促进或抑制特定菌的生长[3]。除了胃肠道吸收后对靶向组织或器官的直接影响外,中药对肠道菌群的调节作用也是口服治疗疾病的一种重要机制[2]。
连翘为木犀科植物连翘(Forsythia suspensa)的干燥果实,具有清热解毒、消肿散结和疏散风热的功效。传统上连翘被用于治疗风热感冒、乳痈、瘰疬、丹毒、温病初起、痈疽等症。连翘果实初熟尚带绿色时采收,并经过杀青处理后,晾干得到的果实为青翘[4]。现代药理学研究表明,青翘具有抗炎、抗氧化、抗菌等多种药理作用[5-7]。
目前针对肠道菌群对连翘化学成分的代谢转化研究已比较深入。例如,研究发现连翘主要化学成分连翘酯苷A和连翘苷可以分别被肠道菌群代谢转化为羟基酪醇[8]和连翘脂素[9],并且发现羟基酪醇比连翘酯苷A具有更强的抗菌、抗补体和抗内毒素的生物活性[8]。同时,周祎青等人研究发现连翘可以通过对肠道菌群结构的调节,以及降低肠道致病菌的丰度,从而对岭南湿热模型小鼠有积极的治疗作用[10]。然而,尚未见有关青翘水提物对人肠道菌群结构影响的研究报道。
综上可知,研究青翘对人肠道菌群结构和组成的影响将有助于了解青翘治疗多种疾病的治疗机制。因此,本文采用16S rRNA基因高通量测序,以及气相色谱-质谱联用(GC-MS)技术研究了不同剂量的青翘水提物对人肠道菌群组成和短链脂肪酸(short-chain fatty acids,SCFAs)代谢的影响,从而通过肠道菌群的角度阐释青翘发挥药效的作用机制。
1 实验部分
1.1 材料与试剂
青翘于2018年8月采自山西省平顺县连翘种植基地,由山西大学分子科学研究所张立伟教授鉴定为青翘的果实。磷酸盐缓冲液(PBS)、GAM肉汤培养基、氯化血红素和维生素K1购自北京Solarbio生物科技有限公司。Mag-Bind soil DNA提取试剂盒购自美国Omega生物科技有限公司。乙酸、丙酸、正丁酸、异丁酸、正戊酸和异戊酸购自上海Aladdin生化科技股份有限公司。色谱纯甲醇和乙腈购自美国Fisher科技有限公司。其他化学试剂均为分析纯。
1.2 仪器
Thermo ISQ™LT单四极杆气相色谱-质谱联用仪(美国Thermo Fisher科技有限公司),LAI-3T厌氧培养箱(上海龙跃仪器设备有限公司),TGL-16M高速冷冻离心机(金坛市水北科普实验仪器厂),IKA RV10 Basic数显型旋转蒸发仪(德国IKA仪器设备有限公司),VFD-1000台式冻干机(北京博医康实验仪器有限公司)。
1.3 青翘水提物制备
青翘粉碎后过20目筛,称取20 g加入200 mL蒸馏水加热回流1.5 h,过滤。残渣再加入160 mL蒸馏水提取1 h,过滤。合并两次滤液,减压浓缩,真空冷冻干燥,得青翘水提物,其出膏率为20%。
1.4 青翘水提物与人肠道微生物体外厌氧温孵
按照文献报道的方法[11]进行青翘水提物与人肠道菌群的厌氧温孵。新鲜粪便样本由四名(两名男性和两名女性,22-28岁)没有任何胃肠道疾病,并且在三个月内未服用过抗生素和益生元的健康志愿者提供。首先,将新鲜粪便与无菌PBS缓冲液(0.01 mol/L,pH 7.2)充分混合均匀后,以500 r/min离心5 min,得到10%(W/V)肠道菌液。将GAM肉汤培养基(59 g)与蒸馏水(1000 mL)混合并加热煮沸直至完全溶解,用0.1 mol/L NaOH溶液调节培养基的pH至7.0,并于121°C高压蒸汽灭菌30 min,然后,在每100 mL的培养基中加入0.5 mg氯化血红素和 0.1 mg 维生素 K1。依据 10 g∶240 mL、7 g∶240 mL和4 g∶240 mL(生药/培养基)的比例分别配制含高、中、低剂量的青翘水提物的培养基。将1 mL肠道菌液和9 mL含有不同剂量的青翘水提物的培养基充分混匀,得到肠道菌群温孵体系(高、中和低剂量的青翘水提物的肠道菌群温孵体系分别命名为Gq、Zq和Dq组)。空白对照组K仅含有培养基和肠道菌液。最后,将样品置于厌氧培养箱中,于37°C温孵24 h,每6 h摇动1次,使反应充分进行。温孵24 h后,取出样品并以12 000 r/min离心15 min。上清液用于SCFAs含量的测定。沉淀物放在-20°C保存,用于提取细菌DNA。平行3次实验。
1.5 SCFAs的测定
SCFAs的测定根据文献报道的方法进行,并稍作修改[12],使用Thermo ISQTMLT 气相色谱-质谱联用仪进行分析测定。色谱柱为Thermo TG-Wax(30 mm×0.25 mm×0.25 μm)。气相色谱程序升温条件:初始温度为100°C保持5 min并以5°C/min上升至150°C,再以30°C/min上升至240°C,并在该温度下保持30 min。以高纯氦气(99.999%)为载气,流速为1 mL/min,分流比是75∶1。汽化室温度为240°C。质谱条件为:质谱EI源的轰击电压是70 eV,采用单离子扫描模式,定量离子是60和73 m/z,离子源温度和连接线温度分别是200°C和250 °C。
标准曲线的制作:用乙醚配制质量浓度分别为乙酸108.5 mg/L、丙酸107.0 mg/L、异丁酸81.0 mg/L、正丁酸87.0 mg/L、异戊酸105.5 mg/L、正戊酸102.0 mg/L标准品母液,然后分别取标准品母液1、0.5、0.375、0.25和0.025 mL配制梯度浓度的标准曲线实际检测样品进样检测,以峰面积为纵坐标,浓度为横坐标绘制标准曲线。
样品前处理方法:将厌氧温孵24 h后的样品摇匀之后,加入2 mL的25%磷酸水溶液涡旋混匀2 min,再加入2 mL乙醚低温萃取10 min,并以4 000 r/min离心20 min。重复萃取2次。合并2次萃取液,减压浓缩并定容至2 mL,进样分析。
1.6 人肠道微生物DNA的提取和高通量测序
16S rRNA高通量测序委托上海派森诺生物科技有限公司测定。利用Mag-Bind soil DNA提取试剂盒对温孵24 h后的细菌DNA进行提取。通过0.8%琼脂糖凝胶电泳检测DNA提取质量,同时采用紫外分光光度计对DNA进行定量。选择粪便DNA的16S rRNA基因V3-V4区进行扩增。PCR扩增产物通过质量体积分数2%琼脂糖凝胶电泳进行检测,并对目标片段进行切胶回收。参照电泳初步定量结果,将PCR扩增回收产物进行荧光定量,然后采用Illumina TruSeq DNA制备测序文库。最后上机进行高通量测序,以97%的序列相似度作为OTU(Operational Taxonomic Unit)的划分阈值。选取每个OTU中丰度最高的序列作为该OTU的代表序列。将OTU代表序列与Greengenes数据库的模板序列相比对,获取每个OTU所对应的分类学信息。Alpha多样性和beta多样性分析主要用QIIME和R软件(v3.2.0)进行。
1.7 统计分析
所有实验数据均以平均数±标准差(SD)表示。采用SPSS 25软件,通过单因素方差分析和最小显著性差异(LSD)进行多个样本的比较。P<0.05被认为具有统计学上的显著差异。
2 结果与讨论
2.1 青翘水提物对肠道菌群OTU数的影响
通过16S rRNA高通量测序,研究不同剂量的青翘水提物对肠道菌群结构和组成的影响。在这项研究中,通过Venn图直观地呈现各样本所共有和独有OTU所占的比例,说明各个样本中OTU组成的相似性和特异性。由图1A可见,空白组OTU有1 537种,Dq组OTU有1 381种,Zq组OTU有1 285种,Gq组OTU有999种。空白组与Dq组共有的OTU数为767个,与Zq组共有的OTU数为731个,而与Gq组共有的OTU数仅为481个。该结果表明青翘水提物对肠道菌群的结构有较大的影响,并且不同剂量的青翘水提物对肠道菌群结构的影响具有剂量相关性,其中高剂量组的影响最大。
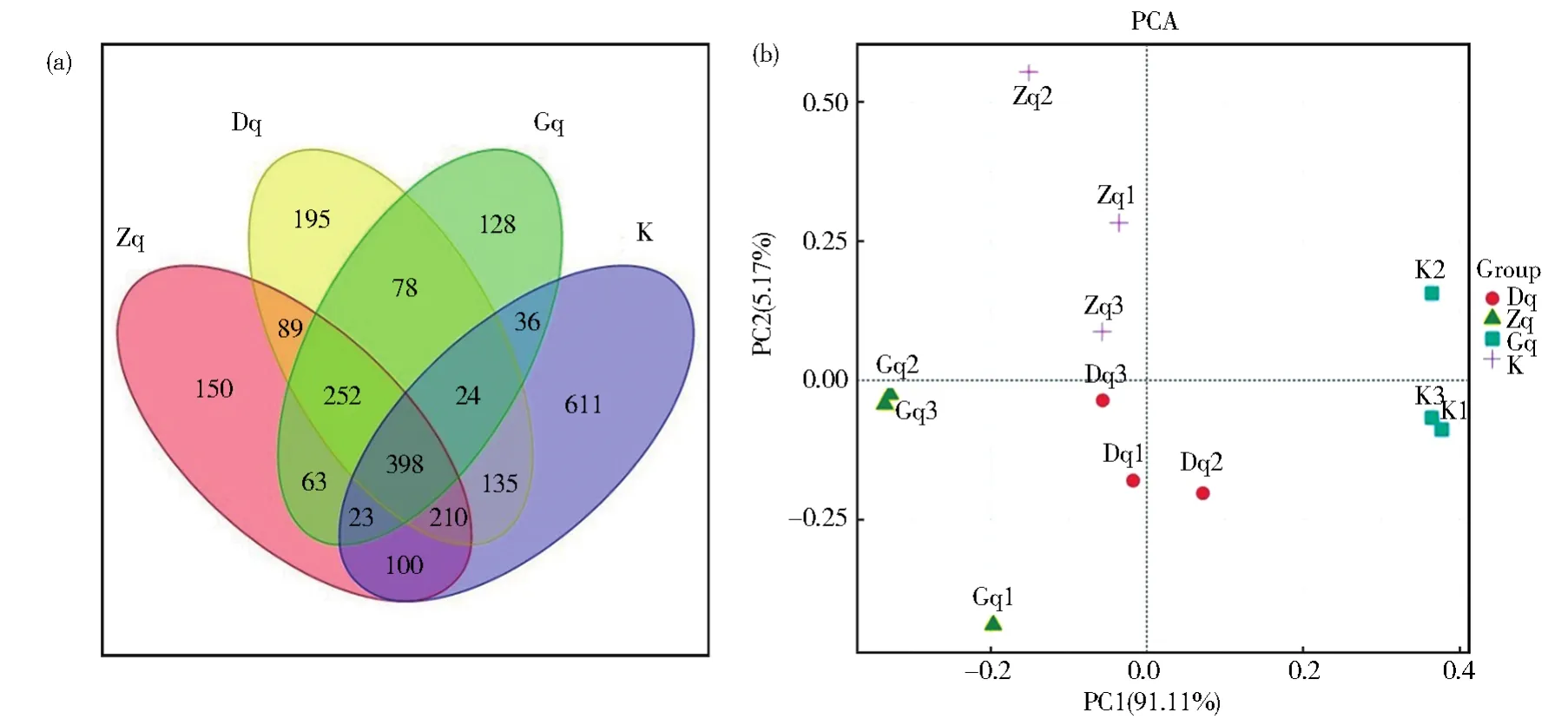
图1 不同组的Venn图(A)以及主成分分析图(B)Fig.1 (A)Venn diagram in different groups and(B)diagram of principal component analysis
2.2 青翘水提物对肠道微生物多样性的影响
Alpha多样性反映了单个样本内部的物种多样性,并通过群落丰富度指数和多样性指数来衡量。Chao1和ACE指数与物种丰富度呈正相关,Shannon和Simpson指数与物种多样性呈正相关。青翘水提物对肠道微生物多样性的影响如表1所示,从Chao1和ACE指数可以看出,只有Gq组与空白组比能显著降低物种丰富度(P<0.05)。同时,青翘水提物呈剂量依赖性降低了Shannon和Simpson指数,该结果表明青翘水提物可降低肠道菌群的多样性,并呈现剂量依赖关系。此外,采用主成分分析法对不同处理组的微生物群落结构的相似性进行分析。结果如图1B所示,第一主成分PC1贡献率为91.11%,第二主成分PC2贡献率为5.17%。在PC1和PC2上Dq组、Zq组和Gq组都能分别与空白组明显分开,说明青翘水提物对人肠道菌群的结构具有显著的调节作用。同时Dq组、Zq组和Gq组彼此之间也能明显分开,说明不同剂量的青翘水提物对人肠道菌群结构的影响也有明显差异。

表1 不同组之间的Alpha多样性Table 1 Alpha diversity among different groups
2.3 青翘水提物对门和属水平肠道菌群组成的影响
不同处理组在门水平的肠道微生物分类学特征如图2A所示,主要由Firmicutes、Bacteroidetes、Proteobacteria和Actinobacteria组成。Dq组对Firmicutes、Bacteroidetes、Proteobacteria和 Actinobacteria没有显著的影响。而Gq组和Zq组都能显著降低Proteobacteria和Actinobacteria的相对丰度,并且能显著增加Firmicutes的相对丰度。不同处理组在属水平的肠道微生物分类学特征如图2B所示,其中Megasphaera、Megamonas、Bifidobacterium、Bacteroides、Collinsella、Faecalibacterium、Dorea、Sutterella、Clostridium、Dialister、Blautia和Coprococcus是主要的属。选择相对丰度排名前50的属进行分析,如表2所示,发现给药组中总共有15个属与空白组相比具有显著性差异。青翘水提物以剂量依赖性的方式增加了Megasphaera和Lactobacillus属的丰度。而与空白组相比,Zq组也能明显增加Parabacteroides和Bilophila属的丰度。据研究报道,Parabacteroides的丰度的降低与溃疡性结肠炎和肠易激综合征的发生密切相关[13],Bilophila是一种可以产生硫化氢(H2S)的细菌,H2S可通过促进微生物生物膜和黏液的产生从而促进结肠炎症的改善[14-15]。因此,Parabacteroides和Bilophila丰度的提高有利于上述炎症性疾病的恢复。同时,与空白组相比,不同剂量的青翘水提物能明显降低Collinsella、Megamonas、Sutterella、Faecalibacterium、Clostridium、Dialister、Dorea、Blautia、Coprococcus和 Ruminococcus属的相对丰度,且Desulfovibrio属的丰度也在Gq组中明显降低。特别是青翘水提物能以剂量依赖性的方式降低了Collinsella、Sutterella和Dorea属的丰度。已有研究证明,Collinsella可增加肠道通透性,诱导IL-17的表达,从而促成类风湿性关节炎疾病的发生[16],Clostridium属的物种可引起假膜性肠炎,破伤风,急性水样腹泻等疾病的发生[17]。此外,Sutterella和 Dialister丰度的升高分别与多发性硬化症[18]和脊柱关节炎疾病相关[19],Dorea、Ruminococcus和Clostridium的丰度增加与肠易激综合症有关[20],而炎症性肠病的发生与Ruminococcus、Clostridium和Blautia属的丰度显著增加有关[21],特别是在急性和慢性溃疡性结肠炎的肠道中Desulfovibrio属的阳性率显著增加[22]。因此,青翘水提物对上述与炎症性疾病相关菌属的显著抑制作用,有助于炎症性疾病的治疗。
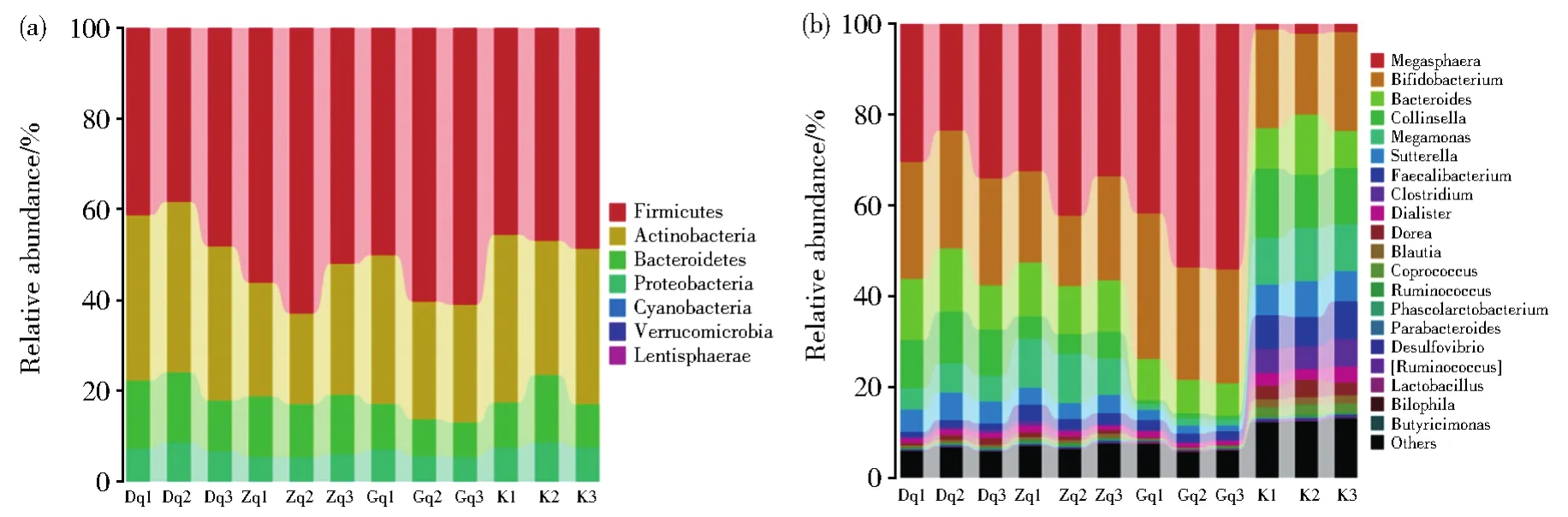
图2 门水平和属水平的微生物群落组成Fig.2 Microbial community composition of phylum level(A)and genus level(B)
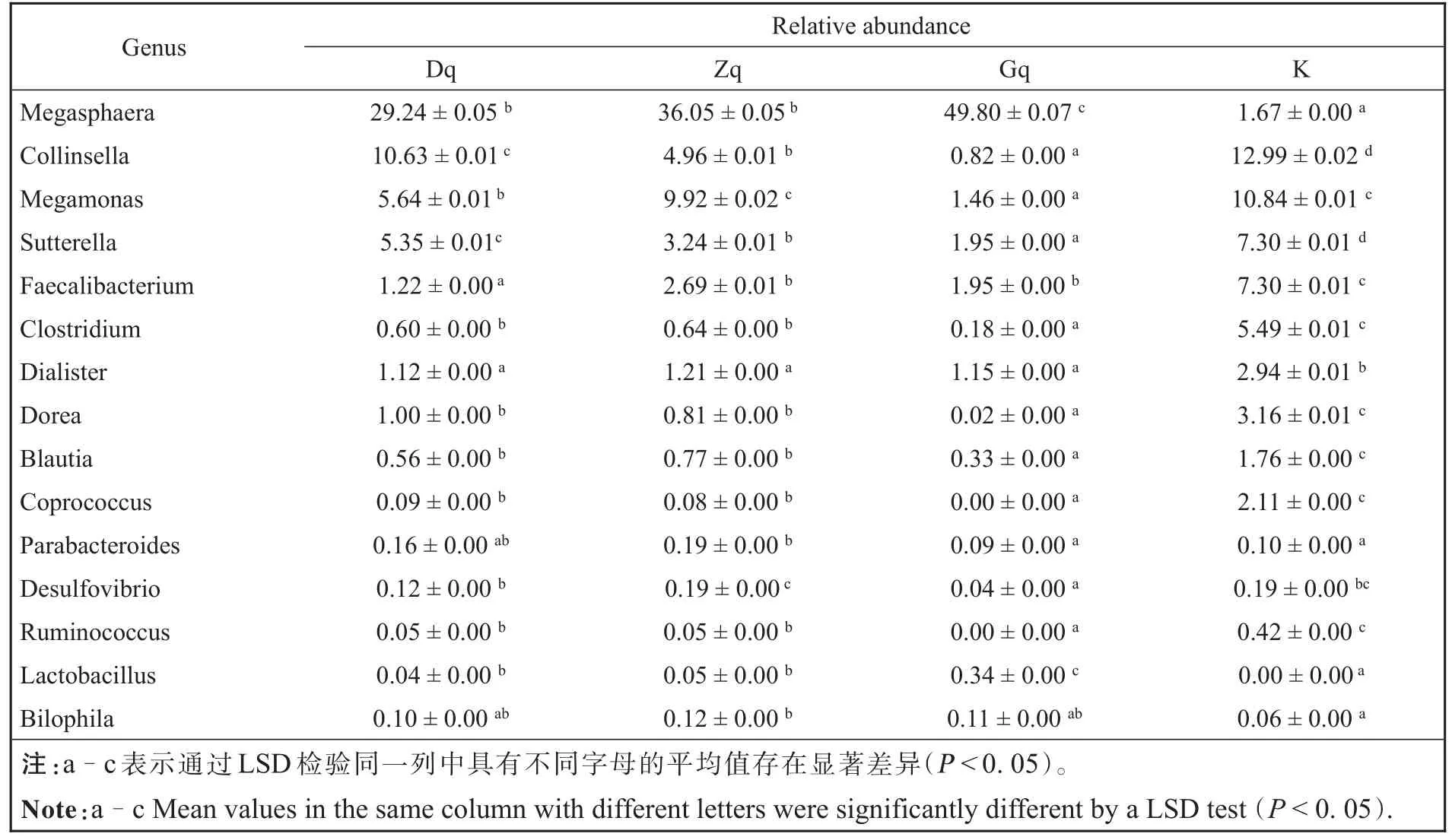
表2 Dq、Zq、Gq和K组中15个属的相对丰度(%)Table 2 Relative abundances(%)of 15 genera in Dq,Zq,Gq and K groups
2.4 青翘水提物对SCFAs产量的影响
利用GC-MS技术测定了不同处理组中SCFAs的含量,其中乙酸、丙酸、异丁酸、正丁酸、异戊酸和正戊酸的线性回归方程分别是

结果表明各个酸在一定浓度范围内与峰面积之间有较好的线性关系,相关系数R2均大于0.99,说明实验的准确性高,分析结果稳定。总酸含量是该6种SCFAs含量之和。SCFAs的含量测定结果如表3所示,与空白组相比,不同剂量的青翘水提物能明显增加丙酸的含量(P<0.05)。正戊酸的含量在Dq组和Zq组中明显高于空白组(P<0.05),而在Gq组中没有显著性增加。异戊酸的含量在Dq组中明显高于空白组(P<0.05),而在Gq组中明显降低(P<0.05)。同时,不同剂量的青翘水提物均明显降低了乙酸、正丁酸和异丁酸的含量(P<0.05),且正丁酸的含量呈剂量依赖性降低。此外,青翘水提物剂量依赖性地降低了总酸的含量,且Zq组和Gq组降低总酸的含量较为显著。研究报道,较高浓度的丙酸可以增强近端结肠屏障功能[23],正戊酸表现出对组蛋白去乙酰化酶(HDAC)的抑制作用,而HDAC的过表达与结肠炎的发生具有密切关系[24]。因此,青翘水提物能促进肠道微生物对丙酸和正戊酸的代谢,有助于预防和辅助治疗炎症性疾病。
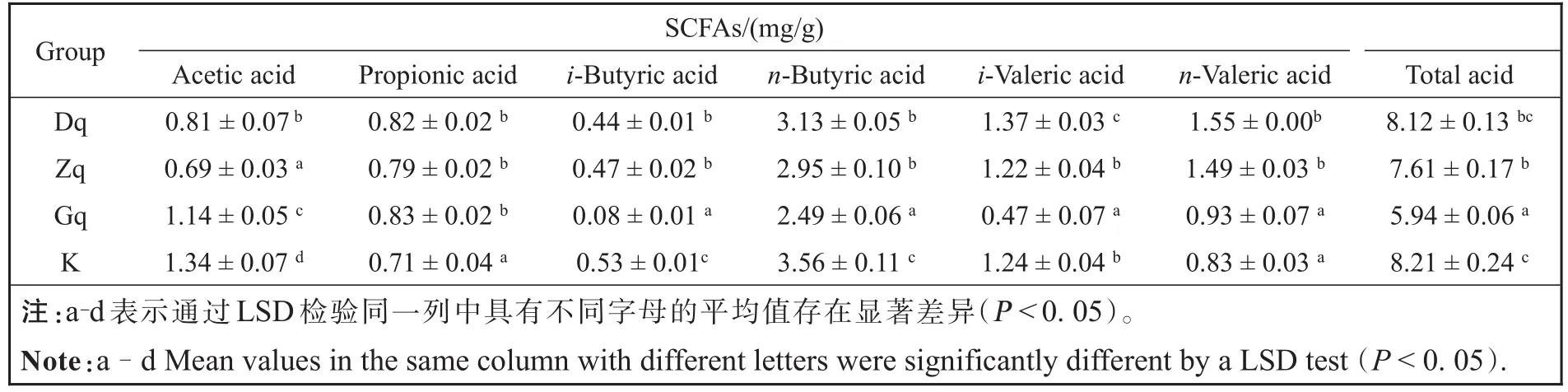
表3 Dq组、Zq组、Gq组和K组中SCFAs的浓度Table 3 Concentrations of SCFAs in Dq,Zq,Gq and K groups
古人云:方剂“贵在用药,妙在用量”,说明用药剂量的合理使用对药物功效的发挥起着重要作用[25]。本研究发现青翘水提物增加了有益菌Megasphaera和Lactobacillus属的丰度,降低了与炎症相关菌属Collinsella、Sutterella和Dorea的丰度,且呈剂量依赖性,该结果对于青翘治疗肠道炎症疾病发挥了积极的作用。但另一方面青翘又以剂量依赖性的方式降低了肠道菌群的多样性以及总酸的浓度。由于肠道菌群的多样性及其代谢产物SCFAs的代谢量与宿主健康密切相关,肠道微生物的多样性和SCFAs的含量越高,对疾病的易感性就越低[26-27]。基于上述结果,推测高剂量的青翘在发挥良好的抗炎作用的同时,可能也会产生一些副作用。
3 结论
连翘味苦、微寒、归肺、心和小肠经,具有清热解毒和消肿散结的功效[4]。现代药理学表明清热解毒的功效与抗炎、解热、抗菌、抗病毒等作用相关[28]。本文的研究结果发现青翘水提物对炎症性疾病相关菌属和SCFAs的显著调节作用说明了青翘具有很好的抗炎作用,这可能是其发挥清热解毒功效的机制之一。特别是,结合青翘水提物对大多数肠道炎症相关菌属的调节作用及其促进肠道菌群对丙酸和正戊酸的代谢,本研究认为青翘水提物对肠道炎症的治疗作用可能更为突出。该结论也与连翘具有治疗DSS诱导的溃疡性结肠炎小鼠的药效作用结果相一致[29]。因此,青翘水提物对肠道炎症疾病的治疗作用值得进行深入研究,且不能忽视高剂量的青翘水提物可能对机体产生的有害影响。由于本研究选用的是健康人的肠道菌群,因而上述结论应进一步应用疾病模型验证。
