绵羊TPT1 基因CDS 区遗传结构及组织表达研究
2021-04-21刘旭莹乔利英刘建华杨凯捷赵弼时刘文忠
刘旭莹,乔利英,刘建华,杨凯捷,赵弼时,王 凤,刘文忠
(山西农业大学动物科学学院,山西太谷 030801)
绵羊肉质细嫩,蛋白质含量高,胆固醇含量低,富含人体必需的各种氨基酸、维生素、矿物质元素等,广受消费者喜欢。脂肪作为维持机体能量代谢平衡的重要组织,可储存机体摄入的过多能量,在能量摄入不足时为机体提供能量储备,但过多的脂肪组织沉积会影响家畜的胴体品质。因此探究脂肪代谢调控关键因子显得尤为重要。
肿瘤蛋白翻译控制1(Tumor Protein,Translationally-Controlled 1,TPT1)又称翻译控制肿瘤蛋白(TCTP)、组胺释放因子(HRF)、P21、P23,TPT1 在小鼠肉瘤细胞中首次发现[1],参与细胞增殖[2]、迁徙[3]、凋亡[4-5]等过程。TPT1 蛋白包含1 个β-折叠,1 个H2-H3 螺旋以及1 个柔性环状结构域[6],可以单体蛋白质形式在细胞内发挥作用[7],也可以二聚体形式作为分泌因子发挥免疫功能[6]。近年来,不少研究表明,TPT1基因参与糖和脂质代谢过程。例如,在猪的前体脂肪细胞增殖分化研究中发现,TPT1基因表达趋势先升后降,抑制TPT1基因表达能引起脂肪分化标志基因表达量升高,促进猪前体脂肪细胞的分化[8]。葡萄糖可诱导TPT1表达量上升并部分转位至线粒体与细胞核[9]。另外,高脂可通过CD36-Fyn-LKB1-AMPK 信号通路使胰岛β细胞中TPT1基因表达水平下降,进而导致β细胞凋亡[10]。研究证实,在人的肝细胞中敲除TPT1基因,肝细胞再生发生障碍,脂质代谢异常[11]。BMP2 介导的间充质干细胞分化为脂肪细胞的过程中,下调TPT1基因表达可抑制脂肪细胞的形成[12]。综上所述,TPT1基因参与糖与脂质代谢过程。因此,克隆绵羊TPT1基因,研究TPT1基因表达与脂质代谢之间的关系,可为改善羊肉品质提供理论依据。
近几年对TPT1基因的研究焦点主要集中在癌细胞上,在家畜中的研究鲜有报道。本课题组前期测序结果表明,TPT1基因在不同品种的绵羊脂肪细胞中表达差异显著[13]。基于上述研究,本实验随机挑选4 头12 月龄的小尾寒羊,提取组织RNA,克隆TPT1基因完整的编码区(Coding Sequence,CDS),采用生物信息分析软件对克隆序列进行生物信息学分析,用实时荧光定量PCR 方法检测该基因在心、肝、脾、肺、肾、肌肉和脂肪组织中的表达水平,为深入了解脂肪发育机制提供分子依据。
1 材料与方法
1.1 实验材料 在屠宰场中随机挑选4 头12 月龄的小尾寒羊,屠宰过程中收集心、肝、脾、肺、肾、脂肪和肌肉组织,分装于2 mL 的冻存管并快速置于液氮中带回实验室,-80℃保存备用。
1.2 主要试剂 RNAiso Plus、PrimeScriptTMRT Master Mix (Perfect Real Time)、TB GreenTMPremix Ex TaqTMII(Tli RNaseH Plus)和pMD18-T 载体均 购自日 本TaKaRa 公司;氯仿、异丙醇和无水乙醇均购自天津宇博精细化工;50×TAE 和琼脂糖均购自北京索莱宝公司;2×Taq Master Mix、限制性内切酶EcoiI和BamH I购自北京百莱博科技有限公司;T4 连接酶购自南京诺维赞生物科技有限公司;DNA 胶回收纯化试剂盒购自美国Omega 公司。
1.3 组织RNA 提取 Trizol 法提取心、肝、脾、肺、肾、肌肉和脂肪组织总RNA;用紫外分光光度计检测所提取的RNA 浓度和OD260nm/OD280nm值。
1.4 引物设计与合成 根据NCBI 上提供的绵羊TPT1基因序列(XM_015098053.2),利用Primer Primier 5.0进行引物设计,并送至Thermo Fisher 公司进行引物合成,引物序列如表1 所示。
1.5 cDNA 的制备 反转录体系为10 μL:5×PrimeScript RT Master Mix 2 μL;RNA 500 ng,然后用RNase-free H2O补足至10 μL。反转录程序:37℃ 15 min;85℃ 5 s。反应完毕,收集产物置于4℃保存备用。

表1 引物信息
1.6 绵羊TPT1基因的克隆及测序 用已提取出的RNA和合成引物进行反转录和PCR 扩增,扩增出TPT1基因CDS 区,经琼脂糖凝胶电泳后,对鉴定正确的PCR产物切胶,根据DNA 胶回收纯化试剂盒说明书对目的片段进行纯化回收。将pMD18-T 载体与回收纯化的目的基因片段按照载体连接说明书操作要求充分混匀后密封,在PCR 仪中16℃连接过夜,连接产物转化大肠杆菌DH5α感受态细胞,12~16 h 后观察平板菌落,筛选单个的阳性克隆菌落至液体培养基中,过夜摇菌并送至Thermo Fisher 公司进行测序。
1.7TPT1基因的生物信息学分析 利用DNAMAN 软件分析TPT1基因的核苷酸序列;利用DNAstar 软件将测序结果与人(NM_001286272.1)、小鼠(NM_009429.3)、大鼠(NM_053867.1)、牛(NM_001014388.1)、猪(NM_214373.1)、山羊(XM_018056766.1)、兔子(NM_001082129.2)这些物 种TPT1基 因mRNA 序列进行同源性比对,并用Mega7.0 构建系统进化树;利用DNAstar 将测序结果翻译为氨基酸序列;利用ProtParam Tool(https://web.expasy.org/protparam/)对TPT1 蛋白质理化性质和蛋白质亚细胞结构进行分析;利用ProtScale(https://web.expasy.org/protscale/)对TPT1蛋白亲疏水性进行分析;利用Net Phos3.0 Sever(http://www.cbs.dtu.dk/services/NetPhos/)软件对TPT1 蛋白进行磷酸化分析;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)软件预测TPT1 的蛋白质二级结构;利用SWISS-MODEL(https://swissmodel.expasy.org/)构建TPT1 蛋白质三级结构模型。
1.8 实时荧光定量PCR 以绵羊各个组织的cDNA 为模板进行荧光定量PCR 反应,反应体系为20 μL:TB Green Premix Ex Taq II 添加量为10 μL,ddH2O 6.4 μL,上、下游引 物(10 μmol/L)各0.8 μL,cDNA 2 μL。反应程序为:95℃ 5 min,95℃ 10 s,60℃ 15 s,72℃20 s,设置43 个循环,95℃ 5 s,65℃ 1 min,升温速率5℃/s,从65℃递增到97℃,反应至40℃结束。
1.9 统计分析 采用2-ΔΔCt方法收集实时荧光定量数据进行分析;采用GraphPad Prism 7.0 软件进行统计学分析,数据以平均数± 标准误表示,P<0.05 为显著性判断标准。
2 结果与分析
2.1TPT1基因的扩增 以2%琼脂糖凝胶电泳检测扩增产物,结果见图1,可见一条约为660 bp 的条带,与理论扩增目的条带长度一致。
2.2TPT1基因的核苷酸序列分析 利用DNAMAN 对测序结果进行分析,结果显示,TPT1基因CDS 区长660 bp,起始密码子为ATG,终止密码子为TAA,A、T、C、G 碱基占比分别为27.0%、25.2%、26.2%、21.7%,AT 含量大于GC 含量。与NCBI 上的绵羊TPT1CDS 区进行序列比对发现,扩增的TPT1基因在185、555 位发生了碱基替换(T →C,A →T)。

图1 TPT1 基因PCR 扩增产物电泳图
2.3TPT1基因同源性与系统进化树构建 如图2 所示,绵羊TPT1基因与山羊的同源性最高,同源性为99.7%;与牛的同源性较高,为99.3%;与猪、兔子、小鼠、大鼠、人的同源性分别是92.3%、91.1%、88.4%、88.3%、92.9%;与哺乳动物的同源性均在88%以上。
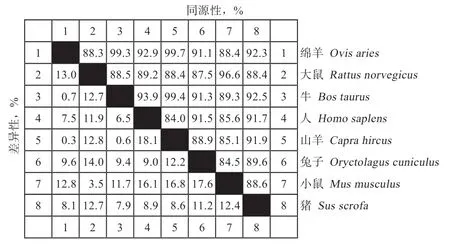
图2 不同物种间TPT1mRNA 序列同源性比对
由图3 可知,绵羊与山羊遗传距离最近,牛次之,与人遗传距离最远,与物种亲缘关系相一致。

图3 不同物种TPT1mRNA 序列进化树遗传距离关系
2.4 TPT1 蛋白理化性质分析 DNAstar 软件分析结果表明,TPT1基因CDS 区编码219 个氨基酸,分子式为C1091H1735N297O327S14,蛋白质分子质量为24 693.41 ku;其中29 个带正电荷的氨基酸(Arg+Lys),32 个带负电荷的氨基酸(Asp+Glu);pI 为5.89,不稳定系数为43.14,属于不稳定蛋白质;总平均亲水性为-0.374。
2.5 TPT1 蛋白亚细胞定位分析 Target P 软件分析结果表明,TPT1 蛋白极有可能含有线粒体靶向肽,存在分泌信号肽的可能性较小。PSORT Ⅱ软件分析结果表明,TPT1 蛋白质定位于线粒体、细胞核、过氧化物酶体以及细胞质的占比分别为78.3%、13%、4.3% 和4.3%。这说明TPT1 蛋白可能作为一种线粒体蛋白发挥作用,在分泌途径中发挥作用较少。
2.6 TPT1 蛋白的亲疏水性和磷酸化分析 Protscale 软件分析结果如图4 所示,可以看出,TPT1 蛋白所包含的疏水性氨基酸比亲水性氨基酸少,说明该蛋白是亲水性蛋白。Net Phos3.1 软件分析结果见图5,TPT1 蛋白共有16 个磷酸化位点,10 个丝氨酸位点,2 个苏氨酸位点和4 个络氨酸位点,这说明TPT1 蛋白可能通过不同位点氨基酸的磷酸化发挥不同的功能。

图4 TPT1 蛋白亲疏水性分析

图5 TPT1 蛋白磷酸化位点
2.7 TPT1 蛋白二级结构和三级结构预测 如图6 所示,TPT1 蛋白二级结构的主要形式为α-螺旋(36.07%)、β-转角(7.76%)、无规则卷曲(37.44%)和延伸链(18.72%)。TPT1 蛋白三级结构的构建采用SWISS-MODEL,结果见图7。

图6 TPT1 蛋白二级结构预测

图7 TPT1 蛋白三级结构预测
2.8 实时荧光定量PCR 结果分析 如图8 所示,TPT1基因在肾脏表达量最高,心、脾表达量最低;以肾脏组织为对照,TPT1基因在各个组织中表达量有着显著差异,肺和脂肪表达量差异不显著,心和脾之间差异不显著。

图8 TPT1 基因在小尾寒羊各组织间的表达情况
3 讨 论
TPT1基因是一种在进化上高度保守的基因,在细胞中发挥抗凋亡作用[4-5,14]。由生物信息学分析结果可知,小尾寒羊TPT1基因的完整编码序列与哺乳动物的同源性均在88% 以上,符合生物进化特征。蛋白质二级结构预测显示,TPT1 蛋白含无规则卷曲与α-螺旋较多,这与猪的TPT1 蛋白预测结果相一致[8]。另外,TPT1 蛋白是一种不稳定的亲水性蛋白,大都在线粒体中发挥功能,这与前人对该蛋白的亚细胞定位研究存在差异[15-16]。研究表明,在HeLa 细胞中,TPT1 蛋白主要定位在细胞核中,但其蛋白序列中并无明显的核定位序列[15];在心肌细胞中,TPT1 蛋白主要定位于细胞核、线粒体、细胞质中[16];这提示TPT1 蛋白可能通过翻译后修饰来调控其在细胞器中的位置。另外,TPT1 蛋白可作为组胺释放因子在免疫应答过程中发挥作用,这与本次预测结果有偏差,推测可能是因为发挥此功能时单体TPT1 蛋白形成二聚体所致[6,17]。
众所周知,当细胞增殖结束进入末端分化时,一些分化调控基因的表达开始上调,细胞增殖相关因子表达量下调,随后细胞周期永久性退出,因而细胞增殖相关因子可作为负调控因子调控前体脂肪细胞的分化。研究证实,miR-1236-3p 靶向TPT1基因可抑制细胞增殖[18],这说明TPT1基因参与调控细胞增殖过程。另外,TPT1基因参与上皮间质转化过程,提示其参与细胞干性的维持[3],这说明TPT1基因可能在前体脂肪细胞分化过程中起着负调控作用。研究表明,经胰岛素处理后的293T 细胞中,TPT1 蛋白的磷酸化位点发生了变化[19],而胰岛素参与调控细胞内的糖脂代谢过程,这说明TPT1 蛋白磷酸化位点的变化参与细胞内的糖脂代谢。另外,在外界葡萄糖的刺激下,细胞质中的TPT1 蛋白可向细胞核中转移,说明TPT1 蛋白在糖脂代谢中可能是通过核质间的位置转变来发挥功能[9]。
本实验结果显示,TPT1基因在绵羊心、肝、脾、肺、肾、肌肉和脂肪组织中均有不同程度表达,其中,在肾中表达量最高,其次是肌肉、肝和脂肪,在心和脾中表达量最低。在人[15]与猪[8]的研究中发现,TPT1基因在肾、肌肉、肝、脂肪中表达量较高,这与本实验结果相一致,反映出TPT1基因在不同组织中均有表达,且在不同组织中发挥着不同的作用。
4 结 论
本研究采用PCR 方法克隆了小尾寒羊TPT1基因的完整编码序列,生物信息学分析表明,TPT1 蛋白属于不稳定水溶性蛋白,在线粒体、细胞核、细胞质中发挥作用。实时荧光定量PCR 结果表明,在不同组织中TPT1基因均有表达。本实验为揭示TPT1基因在前体脂肪细胞分化过程中的调控提供一定基础数据。
