性别控制技术的研究与应用进展
2021-04-21蔡健锋潘淳烨黎文聪陈慧芳张献伟白银山
蔡健锋,潘淳烨,黎文聪,陈慧芳,张献伟,白银山*
(1.佛山科学技术学院生命科学与工程学院,广东佛山 528231;2.温氏食品集团股份有限公司,广东新兴 527439)
性别控制是使动物按照人们所希望的性别繁殖后代的技术[1-2]。随着畜牧业智能化的发展,人类对特定性别的畜禽需求显著增大,因此性别控制技术在畜禽繁殖中有重要的研究价值。根据X、Y 精子DNA 含量的差异,运用流式细胞技术可以有效分离X、Y 精子[3-5]。在奶牛繁育中,运用流式细胞仪分选X、Y 精子进行性别控制,获得的母犊率超过90%,且成活率、体重等与自然交配后代无显著差异,极大地提高了经济效益[6]。研究显示,通过调控X、Y 精子活力的分离方法以及根据X、Y 精子蛋白特异性表达通过免疫学技术分离X、Y 精子的方法,都能获得较好效果[7-8]。这些技术是在配子水平上进行性别控制,不影响基因表达和生殖发育,但目前研究并不完善。
性别差异使畜禽肉品质存在显著不同,根据性别分化规律人为干预性别分化基因的表达,可实现畜禽性别反转,促进肉品质改善,这将成为畜禽生产中有应用前景的技术[9-10]。通过基因编辑技术使性连锁基因缺失也能改变后代性别的比例[11-12],表明通过改变基因表达获得特定性别后代的可行性。本文综述了性别决定基因调控分子机制,探讨了性别反转技术机制及应用前景,汇总了最新的X、Y 精子分离技术的方法并分析其优缺点,以促进性别控制技术的应用和推广。
1 性别分化调控机制
性别分化始于性腺的形成和发育,原生殖细胞(Primordial Germ Cells,PGCs)经迁移与体细胞形成生殖腺,随后向睾丸或卵巢分化[13-14]。该过程依赖于睾丸或卵巢特异性通路的激活,2 个不同的通路激活其中一个则会持续抑制另一通路,如果人为干预来选择特定通路,则会出现性别反转[13]。
1.1 睾丸发育的基因调控SRY(Sex-Determining Region of the Y Chromosome)已被证实为雄性动物Y 染色体中起性别决定作用的主开关,是驱动睾丸发育信号通路的关键基因[13],贯穿整个雄性动物睾丸发育,能激活SOX9(Sry-Related Hmg-Box Gene 9)的表达[15]。它与下游SOX9 调控了包括WT1(Wilms Tumor 1)、NR5A1(Nuclear Receptor Subfamily 5,Group A,Member 1)、MAPK(Mitogen-Activated Protein Kinase)、GATA4(Gata-Binding Factor 4)和DMRT1(Doublesex and Mab-3 Relatated Transcription Factor 1)等基因的表达,促进睾丸发育[13,16]。
当生殖腺开始向睾丸分化时,EMX2(Empty Spiracles Homeobox 2)与LHX9(Lim Homeobox 9)开始表达,LHX9和WT1可以激活NR5A1表达,最重要的是NR5A1与WT1启动了AMH(Anti-Müllerian Hormone)表达,诱导缪勒氏管退化,刺激附睾、输精管和精囊等雄性生殖器发育[17];CBX2(Chromobox Homolog2)不仅能促进性腺形成,也能促进NR5A1、WT1和SRY的转录[13,18]。当进入睾丸发育时期,SOX9的表达开启了睾丸分化。SOX9可以通过睾丸增强子核心序列TESCO(Testis-Specific Enhancer Core)调节自身转录,也可以与FGF9(Fibroblast Growth Factor 9)、PTGDS(Prostaglandin D Synthase)形成彼此促进表达的正向调控循环[19],维持高水平表达状态,取代SRY的调节功能,促进支持细胞谱系分化,诱导睾丸进一步发育[20]。研究显示在睾丸分化的成熟阶段,DMRT1对于维持哺乳动物睾丸后期发育是至关重要的。DMRT1位于减数分裂前的生殖细胞和支持细胞中[21],它可以抑制卵巢发育关键基因FOXL2(Forkhead Box L2)表达以维持睾丸发育,这种抑制作用一直持续到机体成年[16]。此外,DMRT1在鸡胚早期缪勒氏管中表达,参与导管形成的调控[22](图1)。
1.2 卵巢发育的基因调控 卵巢发育是以抑制雄性特异性基因表达为发育基础,通过WNT/CTNNB1 信号通路调控卵巢发育,促进卵巢发育基因的表达,促使雌性动物卵巢发育[13,16,20]。在性腺向卵巢发育时,RSPO1(R-Spondin 1)与WNT4(Wingless Type Mmtv IntegrationSite Family,Member 4)相互协同促进CTNNB1(Catenin Beta 1)表达,激活基因FOXL2抑制SOX9的表达来促进卵巢发 育[20]。FOXL2、RSPO1、WNT4和CTNNB1的 表达能调控多种基因的转录,包括重要的卵巢成分和卵泡抑素基因FST(Follistatin)的表达,促使性腺发育开启卵巢的发育[13,20]。研究发现,FOXL2发挥维持卵巢组织和卵泡发育的主要作用,通过抑制WT1表达来阻止卵巢发育中NR5A1表达,同时在卵巢发育过程阻滞SOX9表达,可防止性别反转。当进入卵巢成熟阶段 时,FOXL2与RUNX1(Runt-Related Transcription Factor-1)相互促进,降低DMRT1表达水平,正向调控芳香化酶基因(Ytochmme P450,Family 19,Subfamily A,Polypeptide 1,CYP19A1)等表达,从而维持和促进卵巢发育[23](图1)。
2 性别反转调控
性别反转是指由于某些原因,后代出现表型与性染色体不符的情况[24],是生物个体从一种性别特征转变为另一种性别的现象[25],发生反转的只是生殖腺及表型性征改变而染色体组型不改变[26]。自然界中一些低等动物随着环境的变化可以改变性别,例如红耳龟在温度过高时产生的为雌性,温度低时则为雄性[27],但高等动物目前只能通过基因和激素调控的方式人为实现反转,这是通过性别分化机制启动性别反转控制的一种方式。早在1991 年,研究者首次把存在SRY的Y 染色体片段导入雌鼠胚胎中,使部分雌性小鼠发育成雄性,证明了性别反转在动物性别控制应用的可行性[28]。性别反转能改变动物的肉品质,公猪性别反转后的母猪不会存在雄烯酮和滑板醇造成猪肉污染的现象[10];但目前性别反转技术大部分用于科学研究,不能用于生产,究其原因是没有简便的技术去敲除或抑制相关性别分化的决定基因,并且性别反转个体产生可育后代的成功率较低、成本过高。

图1 基因在哺乳动物性腺分化中的调控
研究发现,有些性别反转动物也能繁殖后代[10,24]。研究者应用CRISPR/Cas9 质粒显微注射到原核期受精卵的细胞质中,通过破坏兔SRY基因5'侧翼区的Sp1-B 和Sp1-C 结合位点导致雄性动物性反转为雌性[10]。随后将囊胚期胚胎移植后得到12 只性反转兔,暗示具有雌性表型的SRY基因敲除的雄性兔子可能维持怀孕并产下活的幼崽[10]。此外,能产生性别反转后代的B6.XYTIR雄性小鼠与B6 野生型雌鼠交配后,同时产生XX 雌性、XY 雄性以及拥有完整雌性生殖系统的XY 性反转雌性小鼠。其中,根据XY 性反转雌性小鼠在所有XY 小鼠后代的比例,性反转率为47.47%,而后代XYTIR 雄性仍可以继续繁殖并遗传到性反转后代[24]。
SOX9是性别调控的关键基因,调控其表达会造成性别反转。增强子A(Sex Reversal Enhancer-A,ESR-A)、增强子B(Sex Reversal Enhancer-B,ESR-B)以及增强子3(Enhancer Alternate Long-Distance Initiator,EALDI3)参与了SRY激活SOX9表达的进程[15]。研究发现,利用基因组编辑技术将ESR-A同源增强子ENH13(Enhancer 13)敲除后,获得了雄性转雌性的性别反转[29]。同样,运用CRISPR/Cas9 介导的EALDI3缺失小鼠也实现了性别反转[15]。
在鸡胚孵化过程中,通过RNAi 技术敲除早期雄性鸡胚中DMRT1表达,降低SOX9水平,FOXL2水平提高,激活芳香化酶CYP19A1,大量合成雌激素,导致性别反转[30]。有研究将带有外源DMRT1 基因的表达载体转到雌性鸡胚的性腺内,使雌性生殖腺中DMRT1高表达,激活了睾丸发育通路,最终实现雌鸡性反转为雄鸡[31]。也有研究在构建鸭胚性别反转模型时,注射芳香化酶抑制剂能使母鸭性反转,注射雌二醇能使公鸭性反转[32]。研究者将芳香化酶抑制剂Formestane(类固醇型)和Letrozole(非类固醇型)注射孵化7 d 的番鸭胚蛋,其雏鸭雄性率分别为87.5%和86.7%[33]。
3 X 和Y 精子分离技术
X 和Y 精子分离技术是通过利用X、Y 精子之间的差异来进行分离,如精子头部细胞核大小、X、Y 精子重量、精子外膜电荷上的差异、运动速度的差异、耐酸碱差异、抗原性差异及检测Y 精子上特有的F 小体等[34-35]。Lush[36]研究报道,利用精子密度的大小,通过高速离心进行X、Y 精子分离以控制兔子的子一代雌雄,但没有取得显著成功。随后,研究人员运用了X和Y 精子免疫及流式细胞仪分离等方法,但目前还缺乏可靠的抗原,这些方法还并不成熟。近几年,X 精子受体TLR7/8(Toll-Like Receptor 7/8)和性连锁基因如SLXL1(Slx-Like 1)、SLY(Sycp3-Like Y-Linked)的研究促进了X、Y 精子分离技术的发展。
3.1 X 和Y 精子流式细胞仪分离法 流式细胞仪分离法原理是根据X 和Y 精子DNA 含量差异达到分离[37]。Johnson 等[38]用流式细胞仪成功分离兔的X 和Y 精子,并用分离的精子授精产下特定性别的后代,其中,X 精子授精得到94%的后代是雌性;Y 精子授精81%的后代为雄性。流式细胞仪分离法是目前效果最好的方法,具有分离纯度高和准确的特点,但流式细胞仪分离速度较慢,对精子DNA 含量差别要求高,且操作过程复杂,分离的数量有限,价格昂贵,只在一些高价值动物生产中应用[39-40]。近年来,运用腹腔镜子宫角输精技术将精液直接输送到母羊子宫角内减少了精子在子宫颈的运行,直接提高了性控精液的利用率,有效降低成本[41-42];也可以将性别分离精子进行体外受精产生胚胎,再移植生产特定性别的正常后代,但操作仍然非常复杂,不易于推广。
3.2 X 和Y 精子免疫法分离 免疫学方法分离X 和Y 精子是基于X 精子和Y 精子表面存在的不同蛋白质抗原而开发出针对X 或Y 特异性的抗体,再运用磁珠和流式等技术将它们分离的方法。现已发现的一些X 精子和Y 精子特异性抗原,以及表达差异较大的抗原等(如表1 所示)[8,35,43-44]。X、Y 精子特异性抗原和精子膜上差异表达蛋白有望成为精子性别鉴定和X、Y 精子分离的关键的免疫学分离应用蛋白[45-46]。Bryant 等[3]运用H-Y 抗血清免疫亲和柱层析法对人和小鼠的精液进行分离,小鼠分离的H-Y阳性对照精液授精后得到90%的雄性后代。Sills 等[47]研究发现,H-Y 抗原在含X 染色体的精子中也有大量表达;Hendriksen 等[48]用分选的猪精子和牛精子检测7 种抗H-Y 单克隆抗体,这些抗体只能与一部分精子结合(20%~50%),且在X 和Y 精子富集部分的结合方面没有发现差异;Mohammadi等[8]利用雄性增强抗原1(Male Enhanced Antigen 1,MEA1)、雄性增强抗原2(Male Enhanced Antigen 2,MEA2)、SRY 和睾丸决定因子(Testis Determining Factor,TDF)4 种特异性H-Y 精子膜外蛋白制备多克隆抗体,随后将抗体加到猪精液中,使猪Y 精子出现头对头或尾对尾的凝集现象,限制了Y 精子的存活率和活力,最终有效地得到功能性的X精子,显示了在猪繁育性控中的重要应用潜力。与单克隆抗体相比,使用多克隆抗血清具有显著的成本优势[8]。
3.3 调控X、Y 精子活力进行分离技术 近年来,研究人员通过调控X、Y 精子活力达到分离X、Y 精子的目的。Umehara 等[7]研究发现小鼠X 染色体基因编码的TLR7/8 受体与X 精子的活力有关;将TLR7/8 的配体(R848 和R834)加入精子缓冲液后,上层溶液大部分为活跃的Y 精子,活跃度低的X 精子在下层溶液(图2)[7]。TLR7 表达于X 精子尾部,被R848 激活后使糖原合成酶激酶(GSK3α/β)和核因子KB(NFKB)磷酸化从而切断己糖激酶途径,导致糖酵解受抑制减少ATP 的产生。TLR8 表达于X 精子中部,受R837 或R848 激活抑制线粒体活性。有研究表明,线粒体中ATP 的产生调节精子的前进运动,并且该系统独立于糖酵解[49],因此TLR8 通过抑制线粒体活性从而抑制精子运动。随后,研究人员通过收集上层和下层溶液的精子在小鼠中展开了人工授精实验,溶液上层精子后代中雄鼠占90%;下层精子的后代雌鼠占81%[7]。由此证明,运用激活TLR7/8 抑制X 精子达到分离XY 精子效果的方法是简便高效的,可快速筛选出X 精子和Y 精子,比现有分离技术安全度更高,不损伤精子活性及繁殖能力,适合需大剂量精子受精的家畜(如猪等)繁殖。此外,TLR7/8 还能被丙型肝炎、艾滋病毒和寨卡病毒等RNA病毒释放的单链RNA 激活[50],这些病毒通过感染雌性生殖道可能使进入生殖道的X 精子的活性受抑制,从而影响性别比例。
3.4 基因缺失调控后代性别比例 相关的性连锁基因缺失会影响动物的性别比例[11-12]。SLY缺失的雄性与雌性交配产生的后代中雄性远远少于雌性。研究发现,Y 染色体部分缺失小鼠的SLY基因减少使其产生的Y 精子形态扭曲程度比X 精子更严重,这导致Y 精子运动能力受损从而不能到达受精部位参与受精,而X 精子几乎不受影响仍能正常与卵子结合。值得注意的是,虽然Y 精子运动能力受到影响,但依然能穿透卵丘、透明带或卵膜结合、精子卵细胞融合或随后的胚胎发育[12]。还有研究表明,将X 连锁的SLXL1基因完全去除掉,从而调节减数分裂后生殖细胞(圆形精子细胞到细长精子细胞)发育成熟为更多的Y 精子,进而产生更多的雄性后代[11]。

表1 X 精子和Y 精子表面存在的不同蛋白质抗原
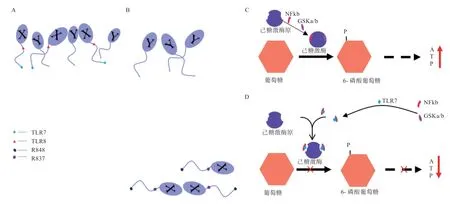
图2 配体加入前后X、Y 精子之间的变化及发生机制
4 问题与展望
高效和准确控制畜禽性别技术一直是现代化畜牧业生产渴望突破的技术,尽管性别控制技术在研究领域已取得了不少突破性进展,但是在实际生产中还存在许多困难和挑战。基于DNA 含量差异的流式细胞法的应用能精准地分离X、Y 精子,在牛羊生产领域的应用取得良好经济价值,但其他物种应用较少,主要因为精子分离过程常常伴随着精子的损伤,分离成本昂贵和分离效率低等问题,制约着性别控制技术的产业化。随着研究的不断深入,一些新的技术应用到性别控制中,新发现的TLR7/8 受体调控方法促使X、Y 精子运动能力呈现差异而进行分离,和H-Y 抗体制备等靶向凝集Y 精子等在实验中都显示出较好的性别控制效果,这些研究和推广将会运用到遗传改良、优质品系的获得、伴性遗传病的规避等领域,促进畜牧业发展。
