三叶青片剂的质量标准研究
2021-04-20周煜恒徐惠龙苏澜余佳敏许文范世明徐伟
周煜恒,徐惠龙,苏澜,余佳敏,许文*,范世明*,徐伟
(1.福建中医药大学药学院,福建 福州 350122;2.福建中医药大学生物医药研发中心,福建 福州 350122)
三叶青为葡萄科崖爬藤属植物三叶崖爬藤(TetrastigmahemsleyanumDiels et Gilg),别名金钱吊葫芦,全草均可入药[1-2],其地下块根又名蛇附子[3]。近年来,关于三叶青的现代药理作用研究较多,其在抗肿瘤[4]、抗炎[5]、抗氧化[6]、降脂[7]、保肝[8]等方面都显示出了良好的作用,并且现代化学研究表明三叶青中的黄酮类成分是主要的活性成分[9],且具有良好的安全性[9],黄酮类成分被作为三叶青质量评价的重要指标性成分[10-14]。
近年来关于三叶青开发利用上,三叶青制剂多为汤剂或散剂[15-17],但汤剂存在需临用前煎煮制备、药液味苦、量大、散剂未经提取纯化口服量大等缺点。中药片剂具有剂量准确、质量稳定、生产成本低、服用和贮运方便等优点,课题组前期针对三叶青开展了其片剂工艺的研究,制备得到的三叶青片剂[18-19],但对三叶青片剂的质量控制尚未建立,也未见文献关于三叶青片剂的质量评价研究。
为了更好地控制三叶青片剂质量,本研究根据《中国药典》2015年版(四部)制剂通则中片剂项下规定对其进行片重差异、崩解时限及硬度检查,利用薄层色谱鉴别其主要黄酮成分,采用紫外分光光度法测定其总黄酮的含量,并采用高效液相色谱测定三叶青片剂中8个主要成分的含量,建立三叶青片剂的质量标准,为三叶青片剂的开发利用提供参考。
1 仪器与试药
1.1 仪器 安捷伦1290高效液相色谱仪(安捷伦公司);Sephadex LH-20(Pharmacia Biotech有限公司);CPA225D 型十万分之一分析天平(德国 Sartorius 公司);KQ-500E 台式超声波清洗器(昆山市超声仪器有限公司);UV-1800 紫外分光光度计(日本岛津公司);TDP-1.5单冲压片机TDP-1.5(上海超亿制药机械设备有限公司);LB-2D型崩解时限测定仪(上海黄海药检仪器厂);YD-200B片剂硬度测定仪(上海铭翔药检仪器有限公司);硅胶G预制薄层板(青岛海洋化工厂分厂,批号:20180612)。
1.2 试药 牡荆素(批号:MUST-160308)、异牡荆素(批号:MUST-150711)、荭草苷(批号:MUST-130705)、异荭草苷(批号:MUST-131009)、牡荆素鼠李糖苷(批号:MUST-130506)、绿原酸(批号:MUST-327979)、新绿原酸(批号:MUST-906332)和隐绿原酸(批号:MUST-905997)均购自成都曼思特生物科技有限公司,HPLC纯度均≥98%。树脂HP20(日本三菱公司),聚维酮K30(PVP-K30)、乳糖、微晶纤维素(MCC)、硬脂酸镁、羧甲基淀粉钠(CMS-Na)、交联聚维酮(PVPP)均为药用级(安徽山河药用辅料股份有限公司)。甲醇、乙腈、甲酸均为色谱纯(Merck公司);三乙胺为色谱纯(阿拉丁试剂上海有限公司),水为Milli-Q Direct 16超纯水机制备(Millipore公司)。三叶青由宁化县益珍农业科技有限公司提供,经福建中医药大学药学院药用植物实验室范世明正高级实验师鉴定为葡萄科崖爬藤属植物三叶崖爬藤(TetrastigmahemsleyanumDiels et Gilg)的全草,药材存放于福建中医药大学药学院标本室。
2 方法与结果
2.1 三叶青片剂制备 依据课题组前期对三叶青提取、纯化和制剂工艺考察[18-19],简述如下:三叶青药材3 000 g,经粉碎机粉碎,过40目筛,得三叶青粉,备用。将三叶青粉置于多功能提取罐中,加入20倍量70%乙醇,回流提取90 min,提取2次,合并滤液浓缩到生药计1 g·mL-1的浓缩液。取HP20树脂,以径高比1∶5装柱,取三叶青浓缩液按照0.5 g生药/g树脂上样量上样后,静置1 h,以流速6 BV·h-1(BV为树脂床体积)的超纯水进行除杂,用量为4 BV。采用50%乙醇4 BV,以流速2 BV·h-1进行富集洗脱,收集富集液浓缩,冷冻干燥24 h,平行制备3批三叶青剂冻干粉。按照三叶青片剂制备,按照处方比例,三叶青冻干粉∶填充剂=1∶2,填充剂为微晶纤维素∶乳糖=1∶1.5,内加5%主药量的崩解剂PVPP∶CMS-Na=1∶1,加入5%主药量的用85%乙醇配制的3%PVP K30黏合剂,以85%乙醇为润湿剂,“握之成团,轻捏即散”软材于20目筛制粒,置于60 ℃烘箱干燥、整粒,加入润滑剂硬脂酸镁为颗粒量的0.6%,压制成片,即得3批三叶青片剂各1 000片(每片折算生药约3 g)。
2.2 性状 3批次三叶青片剂均为棕色片,味微苦,表面光滑,色泽均匀,见图1。

图1 三叶青片剂外观性状
2.3 片剂项下的检查[20]
2.3.1 片重差异 根据《中国药典》2015年版(四部)制剂通则中片剂项下重量差异的检查方法进行检查,3批次的三叶青片剂平均片重分别为0.455 1、0.453 0、0.454 7 g,重量差异均在±5%内,符合规定。
2.3.2 崩解时限 按照《中国药典》2015年版(四部)崩解时限检查法进行检查,3批三叶青片剂崩解时限均在15 min内,符合《中国药典》规定。
2.3.3 硬度检查 片剂应具有适宜硬度,3批三叶青片剂的平均硬度为26~27 N,硬度符合规定。
2.4 薄层鉴别
2.4.1 供试品溶液 取3三叶青片剂适量,研细,称取约0.5 g,精密称定,置具塞三角瓶中,加25 mL甲醇超声处理(功率250 W,频率50 kHz)30 min,放冷,滤过得供试品溶液。
2.4.2 对照品溶液 取牡荆素、异牡荆素、荭草苷、异荭草苷及牡荆素鼠李糖苷对照品适量,精密称定,加入甲醇制成浓度分别为0.465、0.429、0.414、0.499、0.445 mg·mL-1的单一对照品溶液,分别取各单一对照品溶液1 mL置于5 mL量瓶中,摇匀即得混合对照品溶液。

1.荭草苷;2.异荭草苷;3.牡荆素;4.牡荆素鼠李糖苷;5.异牡荆素;6、10.SYQP_ZS001(5、2 μL);7、11.SYQP_ZS002(5、2 μL);8、12.SYQP_ZS003(5、2 μL);9.混合对照品溶液;13.阴性空白图2 三叶青片剂5个黄酮类成分薄层色谱图
2.4.3 鉴别方法与结果 分别吸取荭草苷、异荭草苷、牡荆素、牡荆素鼠李糖苷、异牡荆素对照品溶液各2.0 μL,混合对照品溶液5 μL,供试品溶液各2.0 μL和5.0 μL点于同一硅胶G薄层板上(青岛海洋),以乙酸乙酯∶甲酸∶甲苯∶水=8∶1∶1∶1为展开剂系统展开(温度26 ℃,湿度65%),取出晾干,喷以3%AlCl3显色剂,于105 ℃下加热5 min,365 nm紫外灯下检视。结果表明三叶青片剂供试品薄层色谱中与荭草苷、异荭草苷、牡荆素、牡荆素鼠李糖苷、异牡荆素对照品同一位置上呈现相同颜色的清晰斑点,阴性空白(单纯辅料片剂)无干扰,结果见图2。
2.5 三叶青片剂总黄酮含量测定
2.5.1 供试品溶液制备 取三叶青片剂适量,研细,称取约0.05 g,精密称定,置具塞三角瓶中,加25 mL甲醇超声处理(功率250 W,频率50 kHz)30 min,放冷,滤过得供试品溶液。另取等量空白片剂制备空白阴性溶液。
2.5.2 对照品溶液制备 精密称取牡荆素对照品22.2 mg,加入适量甲醇制得浓度1.10 mg·mL-1的对照品储备液,进一步用甲醇稀释制成浓度46.25 μg mL-1的对照品溶液。
2.5.3 显色方法及检测波长的选择 参考课题组之前建立的三叶青总黄酮测定方法[13],精密吸取牡荆素对照品5 mL于25 mL的容量瓶中,加甲醇至6 mL,加1%三乙胺定容至刻度,摇匀,显色30 min。精密吸取供试品溶液1 mL于25 mL的容量瓶中,加甲醇至6 mL,加1%三乙胺定容至刻度,摇匀,显色30 min。对照品和供试品溶液均以显色剂作为空白对照。在300~500 nm范围内进行扫描。结果显示,对照品与供试品溶液在400 nm处有相同吸收峰,故选择400 nm作为检测波长,见图3。

图3 牡荆素(1)和供试品(2)的紫外光谱图谱
2.5.4 线性关系考察 精密吸取“2.5.2”项下的牡荆素对照品各1、2、3、4、5、6 mL于25 mL容量瓶中,加甲醇至6 mL,按“2.5.3”项下方法显色测定吸光度,以对照品溶液的浓度与吸光度值建立标准曲线,得线性回归方程:A=0.048 4C-0.022 4,r=0.999 3。结果表明,在1.85~11.10 μg mL-1范围内线性关系良好。
2.5.5 精密度试验 精密移取对照品溶液5 mL,供试品溶液1 mL,分别置于25 mL容量瓶中,加甲醇至6 mL,按“2.5.3”项下方法显色测定吸光度,在同一紫外分光光度计上连续测定6次,结果对照品溶液和供试品溶液RSD分别为0.03%、0.10%,表明试验精密度良好。
2.5.6 稳定性试验 精密移取对照品溶液5 mL,供试品溶液1 mL,分别置于25 mL容量瓶中,加甲醇至6 mL,按“2.5.3”项下方法显色后分别在0、8、15、30、60、90、120、240 min测定吸光度。结果表明,对照品和供试品显色产物在室温下30~240 min内稳定,RSD分别为0.67%、2.54%。
2.5.7 重复性试验 精密称取批号为SYQP_ZS001的三叶青片剂6份,按“2.5.1”项下方法制成供试品溶液,精密吸取1 mL,置于25 mL容量瓶中,按“2.5.3”项下方法显色后测定吸光度,计算含量,结果该批次的三叶青片剂中总黄酮含量平均为117.48 mg·g-1,RSD为2.57%,说明重复性良好。
2.5.8 加样回收试验 取重复性试验同批三叶青片剂(SYQP_ZS001)0.025 g,精密称定,加入近似样品总黄酮含量的对照品量(1∶1),按“2.5.1”项下方法制成供试品溶液。精密吸取1 mL置于25 mL量瓶中,按“2.5.3”项下方法显色后测定吸光度,平行6份。结果该方法平均加样回收率为98.43%,RSD为2.46%,见表1。
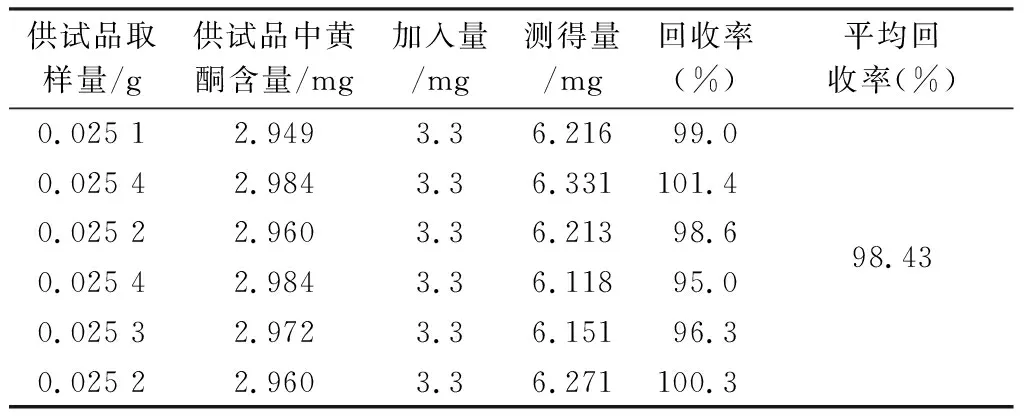
表1 加样回收率试验
2.5.9 样品含量测定 精密吸取“2.5.1”项下的3批次供试品溶液各1 mL,分别置于25 mL容量瓶中,按“2.5.3”项下显色后测定吸光度,计算得制备的3个批次的三叶青片剂中总黄酮含量分别为117.48、124.02、112.56 mg·g-1。
2.6 HPLC-DAD 测定三叶青片剂8个成分的含量
2.6.1 色谱条件 采用Welch Ultimate XB-C18色谱柱(4.6 mm×150 mm,2.7 μm);流动相为0.1%甲酸水(A)-乙腈(B),流速0.4 mL min-1,柱温30 ℃,进样量:5 μL,梯度洗脱:98%A(0~5 min),98%A→90%A(5~15 min),90%A→88%A(15~30 min),88%A→80%A(30~50 min),80%A→98%A (50~65 min);检测波长330 nm,对照品和供试品溶液中8个成分理论塔板数均大于5 000,色谱分离良好,阴性无干扰(见图4)。

1.新绿原酸;2.绿原酸;3.隐绿原酸;4.异荭草苷;5.荭草苷;6.牡荆素鼠李糖苷;7.牡荆素;8.异牡荆素图4 混合对照品(A)和供试品(B)色谱图
2.6.2 供试品溶液的制备 取“2.5.1”项下制备的3批次供试品溶液。
2.6.3 对照品溶液的制备 取新绿原酸、绿原酸、隐绿原酸、异荭草苷、荭草苷、牡荆素鼠李糖苷、牡荆素、异牡荆素对照品适量,精密称定,加入甲醇制备浓度分别为1.273、1.15、1.092、0.66、0.593 6、0.318、0.596 8、0.599 6 mg mL-1的对照品储备液,进一步用甲醇稀释制备浓度为127.30、115.00、109.20、66.00、59.36、31.80、59.68、59.96 μg mL-1的混合对照品溶液。
2.6.4 线性和范围 精密吸取“2.6.3”项下制备的混合对照品溶液,用50%甲醇分别稀释制备得到梯度浓度的混合对照品溶液,精密吸取5 μL进样,并测定峰面积,以浓度X(μg·mL-1)对峰面积Y进行线性回归,得回归方程和相关系数,并稀释不同浓度对照品得各个化合物的定量限(S/N为10)和检测限(S/N为3),结果见表2。

表2 8个待测物的回归方程、线性范围及定量限和检出限
2.6.5 精密度试验 精密吸取同一份对照品混合溶液5 μL,一天内连续进样6次,连续进样3 d,记录8个成分的峰面积,其峰面积日内精密度和日间精密度的RSD范围均在1.39%~2.01%,表明精密度良好。
2.6.6 稳定性试验 制备一份供试品,取该供试品溶液分别于0、2、4、6、10、12和24 h进样分析,记录8个成分的峰面积,其峰面积的RSD范围均在0.86%~1.46%,表明供试品溶液在24 h内稳定。
2.6.7 重复性试验 精密称取同一批三叶青样品6份,制备成供试品溶液进样测定峰面积,计算8个成分的含量,其含量RSD范围均在1.39%~2.94%,表明方法重复性良好。
2.6.8 加样回收率试验 精密称取已知含量的样品(SYQP_ZS001)0.025 g,平行6份,精密加入近似1∶1的8个对照品,制备成供试品溶液进样测定峰面积,计算含量,见表3,得到平均回收率为96.88%~99.25%,RSD为1.94~2.47%。

表3 8个待测物的加样回收率试验结果
2.6.9 样品含量测定 取“2.5.1”项下供试品溶液,进样5 μL,测定峰面积,根据标准曲线计算其含量,结果见表4。
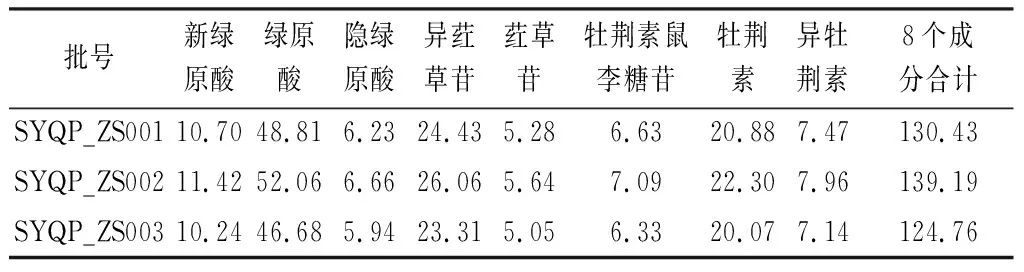
表4 三叶青片剂中8个待测物的含量(mg·g-1)
3 讨论
3.1 薄层鉴别条件的优化 在考察不同点样量的试验过程中,发现点样量为5.0 μL时,斑点较大,拖尾严重,供试品不易分离;点样量为2.0 μL时,分离效果较好,斑点清晰。在考察不同展开剂的试验过程中,发现分离5种黄酮成分,使用展开剂为乙酸乙酯∶甲酸∶甲苯∶水=10∶1∶1∶1或乙酸乙酯∶甲酸∶甲苯∶水=8∶1.2∶1∶1时,斑点不易分离,拖尾,以乙酸乙酯∶甲酸∶甲苯∶水=8∶1∶1∶1为展开剂时,斑点清晰,分离较好。在考察使用不同显色剂显色时发现,使用10%硫酸-乙醇显色黄酮成分时,斑点不灵敏,用3%AlCl3溶液显色斑点清晰,因此选择3%AlCl3溶液作为显色剂。另外,三叶青中还有含量较高的绿原酸、隐绿原酸和新绿原酸的,其鉴别采用乙酸乙酯∶甲酸∶甲苯∶水=17∶2∶2∶0.8为展开剂系统,发现可以较好地区分绿原酸,但是新绿原酸和隐绿原酸分离不好,暂时不列入标准。
3.2 总黄酮含量测定 紫外分光光度法测总黄酮含量时,常用方法有NaNO2-Al(NO3)3-NaOH法、AlCl3-KAc法和三乙胺法显色法[13],用NaNO2-Al(NO3)3-NaOH法和AlCl3-KAc法,发现牡荆素成分在光谱上均未见明显红移,而采用三乙胺显色法测定时,牡荆素和供试品在波长400 nm下均有最大吸收波长,特异性较好,显色条件经优化采用1%三乙胺,显色时间为30 min即可稳定。
3.3 色谱条件的优化 用高效液相色谱测定三叶青片剂中8个主要成分,在选择色谱柱时,通过比较不同厂家不同粒径色谱柱分离效果,最终选择Welch UHPLC Ultimate XB-C18色谱柱(4.6 mm×150 mm,2.7 μm)。在选择流动相系统时,通过比较不同的流动相系统:乙腈-0.1%甲酸水,甲醇-0.1%甲酸水,乙腈-水,甲醇-水。试验结果表明,使用乙腈-0.1%甲酸水为流动相,8个成分的分离度最好。且在光谱扫描中,在330 nm下,8个成分均有最大吸收波长,因此选择330 nm下检测,经过含量测定发现3个批次三叶青片剂中,含量最高的成分为绿原酸,含量达到46.68~52.06 mg·g-1,其次是牡荆素和异荭草苷,含量均大于20 mg·g-1,其次是牡荆素和异荭草苷,8个成分的总和达到124.66~139.17 mg·g-1。
本文研究了三叶青片剂的质量标准,通过性状、片重差异、崩解时限及硬度检查对三叶青片剂进行检查,符合《中国药典》2015年版(四部)制剂通则中片剂项下规定;采用薄层色谱法鉴别三叶青片剂中5种黄酮成分(异荭草苷、荭草苷、牡荆素鼠李糖苷、牡荆素、异牡荆素),用紫外分光光度法测定三叶青片剂总黄酮含量,采用高效液相色谱法测定三叶青片剂中8个主要成分含量,为三叶青片剂的质量控制与研究开发提供试验依据。
致谢:感谢澳门大学中华医药研究院陆金健博士课题组对三叶青制剂及质控合作研究中的协助。
