全反式维A酸对肺腺癌H1299细胞放射敏感性研究
2021-04-20宣爱丽汪庚明周咏春徐洪波何泽来周育夫
孙 谦,宣爱丽,汪庚明,周咏春,徐洪波,何泽来,周 燕,周育夫,江 浩
2015年世界卫生组织统计,癌症是91个国家70岁前人群的主要死亡原因。全球癌症的发病率及死亡率呈迅速增长之态。目前全世界肺癌的发病率(11.6%)及死亡率(18.4%)均排第一位[1],是对人群健康和生命威胁最大的恶性肿瘤。目前对中晚期肺癌治疗主要采取综合治疗,放疗是肺癌综合治疗中重要的治疗方法之一。在不同期别肺癌中均可应用放疗,但总体治疗效果较差,治疗失败主要原因是局部未控及远处转移。非小细胞肺癌尤其是腺癌对放疗不敏感,为提高放疗敏感性,放射增敏剂是有效解决该难题的重要方法之一。
研究[2-3]发现全反式维A酸(all-trans retinoic acid,ATRA)作为维生素A的主要代谢产物,主要参与调控细胞的增殖分化,诱导肿瘤细胞凋亡,是一种诱导分化剂。研究[4]发现ATRA能够增加胃癌细胞的凋亡及放射敏感性,可能与抑制细胞周期G2/M期的阻滞作用、下调Bcl-2与survivin mRNA表达、上调NF-κB与Bax mRNA表达有关。李明等[5]研究发现ATRA联合放疗具有协同诱导脑胶质瘤细胞凋亡的作用,其分子机制可能与凋亡相关基因p38及MAPK蛋白表达上调、NF-κB蛋白表达下调有关。本研究探讨ATRA对肺腺癌细胞株H1299放射敏感性的影响,为肺癌放射增敏提供依据。
1 材料与方法
1.1 材料 肺腺癌H1299细胞购买于ATCC细胞库。RPMI 1640培养基、胎牛血清购自HyClone公司,ATRA、MTT试剂盒购自Sigma公司,细胞周期试剂盒及细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司,survivin、NF-κB、GAPDH抗体购自Anbo公司,辣根过氧化物酶标记山羊抗兔IgG购自北京中杉公司。
1.2 方法
1.2.1 细胞培养 肺腺癌H1299细胞培养于含10%胎牛血清及双抗的RPMI 1640培养基中,置于37 ℃、5% CO2培养箱中培养。当细胞生长至80%融合时,加入0.25%胰蛋白酶消化进行传代,取对数生长期的细胞进行后续实验。
1.2.2 MTT法检测ATRA及射线照射对肺腺癌H1299细胞存活率的影响 取对数生长期的H1299细胞,调整细胞密度为104/mL,接种于96孔板中,每孔200 μL,贴壁后,分别加入终浓度为0(对照组)、0.1、0.25、0.5、1.25、2.5、5、10 μmol/L的ATRA,每组6个复孔,继续培养24、48、72 h,加入20 μL MTT试剂,继续培养4 h,用酶联免疫检测仪测490 nm处检测吸光度(A),细胞生长抑制率=(对照组A值-实验组A值)/对照组A值×100%。根据ATRA对H1299细胞增殖抑制的结果,选择合适的刺激浓度,考察ATRA联合射线照射和单独ATRA相比,抑制H1299细胞增殖的效果。
1.2.3 平板克隆形成实验 将处于对数生长期的H1299细胞,接种于60 mm的培养皿中,每皿约150个细胞的浓度,实验分2组:(1)放射组给予不同剂量X射线照射;(2)ATRA+放射组以10 μmol/L ATRA处理24 h后给予不同剂量X射线照射。使用6 mV的X线照射,照射剂量分别为0、2、4、6、8 Gy,将培养皿置于20 cm×20 cm照射野内,源皮距为100 cm。照射后,更换无药培养液继续培养14 d。用无水乙醇固定,结晶紫染色,计数克隆数及放射敏感性参数D0、Dq及N值。
1.2.4 流式细胞术检测细胞凋亡和细胞周期 实验分为4组:对照组、ATRA组(2 μmol/L)、2 Gy照射组及ATRA(2 μmol/L)+2 Gy照射组,将4组细胞处理后更换无药培养液培养24 h后制备单细胞悬液,细胞凋亡及细胞周期分分布情况,分别经AnnexinV-PE/7-AAD双染和PI单染后上机检测。
1.2.5 Western blotting检测各组细胞survivin与NF-κB蛋白表达 实验分3组:对照组、2 Gy照射组及ATRA(2 μmol/L)+2 Gy照射组,操作按文献[5]进行,用quantity one软件分析各组光密度值。蛋白相对表达量=目的蛋白光密度值/相应内参GAPDH光密度值。
1.3 统计学方法 采用t检验、方差分析和q检验。
2 结果
2.1 MTT法检测ATRA及射线照射对肺腺癌H1299细胞存活率的影响 不同浓度ATRA对肺腺癌H1299细胞均有抑制作用,浓度为10 μmol/L时最佳(P<0.01),72 h时其抑制率达到最大值(见表1)。相对单独ATRA处理,10 μmol/L ATRA联合不同剂量的射线照射后,细胞生长抑制率明显增加(P<0.01)(见表2)。
2.2 ATRA及ATRA联合射线照射诱导H1299细胞凋亡 ATRA作用和射线照射后的细胞凋亡增多(P<0.01),ATRA联合射线照射作用后的细胞总凋亡率明显高于单纯射线照射(P<0.01)(见图1、表3)。
2.3 ATRA及ATRA联合射线照射对H1299细胞周期的影响 与对照组、放射组、ATRA组相比,ATRA+放射组细胞G0/G1期比例明显增加(P<0.01)(见表4)。
2.4 ATRA对H1299细胞放射敏感性影响 与放射组相比,ATRA+放射组的细胞存活分数(SF2)值降低,ATRA可以增加肺腺癌H1299细胞放射敏感性,增敏比为1.406(见表5)。
2.5 各组H1299细胞中survivin与NF-κB的蛋白表达情况 对照组、放射组、ATRA+放射组细胞中survivin与NF-κB的蛋白表达水平呈下降的趋势,且ATRP+放射组细胞中survivin与NF-κB的蛋白表达水平明显低于对照组和放射组(P<0.01)(见图2、表6)。
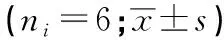
表1 ATRA抑制H1299细胞生长

表2 射线单独照射和10 μmol/L ATRA联合射线照射对H1299细胞存活的影响
3 讨论
放射治疗在肺癌的根治性和姑息性治疗中均起关键作用。在局部晚期[6]和早期[7]非小细胞肺癌中均得到证实。但肺癌总体预后较差,治疗失败主要原因局部未控及远处转移。在局部晚期非小细胞肺癌中经放射治疗后多数肿块无法完全消失,为提高肿瘤局部控制率,近年来关于如何增加放射敏感性研究越来越多。
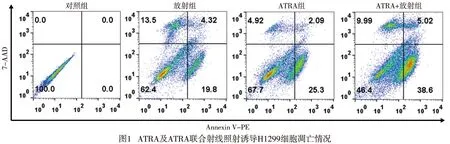

表3 ATRA及ATRA联合射线照射诱导H1299细胞凋亡情况

研究[8-10]发现ATRA可以促进肿瘤细胞凋亡、抑制肿瘤血管生成及转移,增加化疗药物敏感性[10]。王艳萍等[4]研究发现ATRA能够增加胃癌细胞SGC-7901的凋亡及放射敏感性,在肺腺癌H1299细胞中是否存在放射增敏作用,目前尚未发现相关研究结果。本研究通过MTT法、平板克隆形成实验、流式细胞术方法研究ATRA对肺腺癌H1299细胞存活率、放射敏感性、细胞周期的作用;同时应用Western blotting检测细胞中survivin与NF-κB的蛋白表达情况。结果显示,与放射组相比,ATRA+放射组细胞survivin与NF-κB蛋白表达被明显抑制。平板克隆形成实验也显示,ATRA+放射组的D0、Dq、N及SF2均明显低于放射组,表明放疗敏感性增强。细胞周期实验结果显示,与对照组、放射组、ATRA组相比,ATRA+放射组G0/G1期比例明显增加,与研究[11]结果相符。研究[12]发现survivin是凋亡抑制蛋白家族的新成员,具有肿瘤特异性,只表达于肿瘤和胚胎组织,且与肿瘤细胞的分化增殖及浸润转移密切相关。SANDUR等[13]研究发现在结直肠癌细胞中放疗增加NF-κB表达,出现放疗抵抗,加入姜黄素后NF-κB表达明显下降,放射敏感性明显增加。李晓波等[14]在肺癌细胞中也得到相同结果。李明等[5]应用替莫唑胺、ATRA联合放疗抗脑胶质瘤U251细胞研究发现,联合组细胞凋亡数明显增高,联合组与对照组、放疗组及药物组比较p38MAPK表达明显上调,联合组与对照组、放射组及药物组比较,NF-κB表达明显下调。本研究结果显示,与对照组及放射组相比,ATRA+放射组细胞中survivin与NF-κB的蛋白表达量均明显降低,提示ATRA可能通过下调survivin与NF-κB表达增加H1299细胞放射敏感性。

表4 ATRA及ATRA联合射线照射对H1299细胞周期的影响
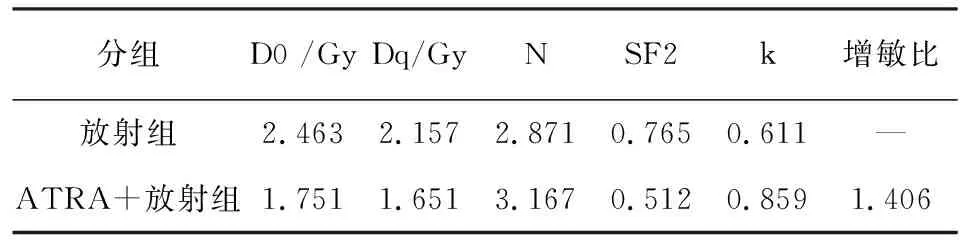
表5 ATRA对H1299细胞放射敏感性影响

表6 各组H1299细胞survivin与NF-κB的蛋白表达情况
综上所述,ATRA对肺腺癌H1299细胞具有放射增敏作用,其机制可能与ATRA直接抑制H1299细胞增殖、促进H1299细胞凋亡,下调survivin及NF-κB蛋白表达有关。
