大鼠carabin腺病毒干扰载体构建及功能鉴定
2021-04-20程阔菊罗健华魏谭军周殿儒
程阔菊,吴 庆,罗健华,魏谭军,周殿儒,肖 成,黄 河,罗 云,王 毅
carabin是2007年在人T细胞中发现的一个新的钙调磷酸酶(calcineurin,CaN)结合蛋白,主要表达于脾脏及血液中[1],同时可与Ras结合,基于其与CaN和Ras均能相互作用的特性,将其命名为carabin[1]。前期研究[1-4]表明,carabin作为CaN的内源性负反馈抑制蛋白,通过CaN和Ras信号通路负反馈抑制T细胞及B细胞的持续活化,在机体免疫中发挥着重要作用。最近研究[5-6]表明,carabin在心肌细胞中亦有表达,可通过负性调节CaN和Ras信号通路抑制心肌细胞的肥大,并有可能成为诊治心衰引起心肌肥厚的靶点。我们的前期研究[7]发现,carabin在小鼠梗死心脏及经缺血/缺氧处理的人心室肌细胞株AC16中表达均显著下调,提示carabin在心肌梗死及缺血中可能起到一定的作用,但目前尚无相关研究报道。本研究拟采用腺病毒载体系统,设计针对大鼠carabin基因的干扰序列,构建carabin腺病毒干扰载体(Ad-carabin-shRNA),感染H9C2心肌细胞筛选针对大鼠carabin基因干扰效果最佳的Ad-carabin-shRNA,为进一步观察carabin信号通路在心肌梗死及缺血中的作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞及载体质粒 细胞株293A、293T及H9C2购自中国科学院细胞库,ADV4-U6-CMV重组穿梭质粒和pGp-Ad-pac载体骨架质粒购自吉玛基因。
1.1.2 主要试剂与仪器 RNA引物合成及DNA测序(美国,Invitrogen公司)。限制性内切酶EcoRI(NEB,R0101M)、BamHⅠ(NEB,R0136S),T4 DNA连接酶(NEB,M0202L),RNAi-Mate转染试剂(吉玛基因,G04001),Polybrene(Sigma,H9268)、carabin抗体(Abcam,ab77625)、β-actin抗体(Abcam,ab115777)、山羊抗兔IgG(碧云天,WSA0208)。二氧化碳培养箱(SANYO,MCO-15AC),生物安全柜(上海上净净化设备有限公司,BSC-ⅡA2),荧光显微镜(Motic,AE31-252B)。
1.1.3 引物设计及合成 针对大鼠carabin基因,设计3对carabin-shRNA寡核苷酸序列(carabin-shRNA-1:5′-GAC CTT ACA CTG GGA GAA GAC-3′;carabin-shRNA-2:5′-GTC TAC CTC CCT GGC TAC TAT-3′;carabin-shRNA-3:5′- AGC TGC AGG AAG AGG TCT TCA -3′),分别插入ADV4-U6-CMV穿梭质粒的EcoRⅠ与BamHⅠ酶切位点,由上海生工生物工程技术服务有限公司合成3对寡核苷酸,规格为2A。
1.2 方法
1.2.1 ADV4-U6-CMV-carabin-shRNA重组穿梭干扰质粒的构建及筛选 将3对carabin-shRNA寡核苷酸退火形成双链,EcoRⅠ与BamHⅠ酶切寡核苷酸和ADV4-U6-CMV穿梭质粒,T4 DNA连接酶连接酶切后的寡核苷酸和ADV4-U6-CMV穿梭质粒。将3组连接产物转化至DH5a化学感受态细胞,接种于含氨苄西林的培养基平板,次日挑选阳性单克隆菌群,药液培养过夜,菌液送上海生工生物测序,将序列无误的质粒分别命名为ADV4-U6-CMV-carabin-shRNA-1、ADV4-U6-CMV-carabin-shRNA-2、ADV4-U6-CMV-carabin-shRNA-3。
1.2.2 AD-carabin-shRNA包装、收毒及扩增 将制备的ADV4-U6-CMV-carabin-shRNA腺病毒穿梭质粒与pGp-Ad-pac载体骨架质粒经高纯度无内毒素抽提后,用转染试剂RNAi-Mate进行共转染293A细胞,转染后6 h更换为完全培养基,培养2周,每7 d左右补充一次新鲜培养基,然后收集细胞和上清液置于离心管中,冻融3次,2 000 r/min离心5 min,取上清即为病毒液初代原液。连续三代反复扩增收集病毒后,行病毒的大量扩增,然后对其纯化和浓缩后得到高滴度的腺病毒浓缩液。
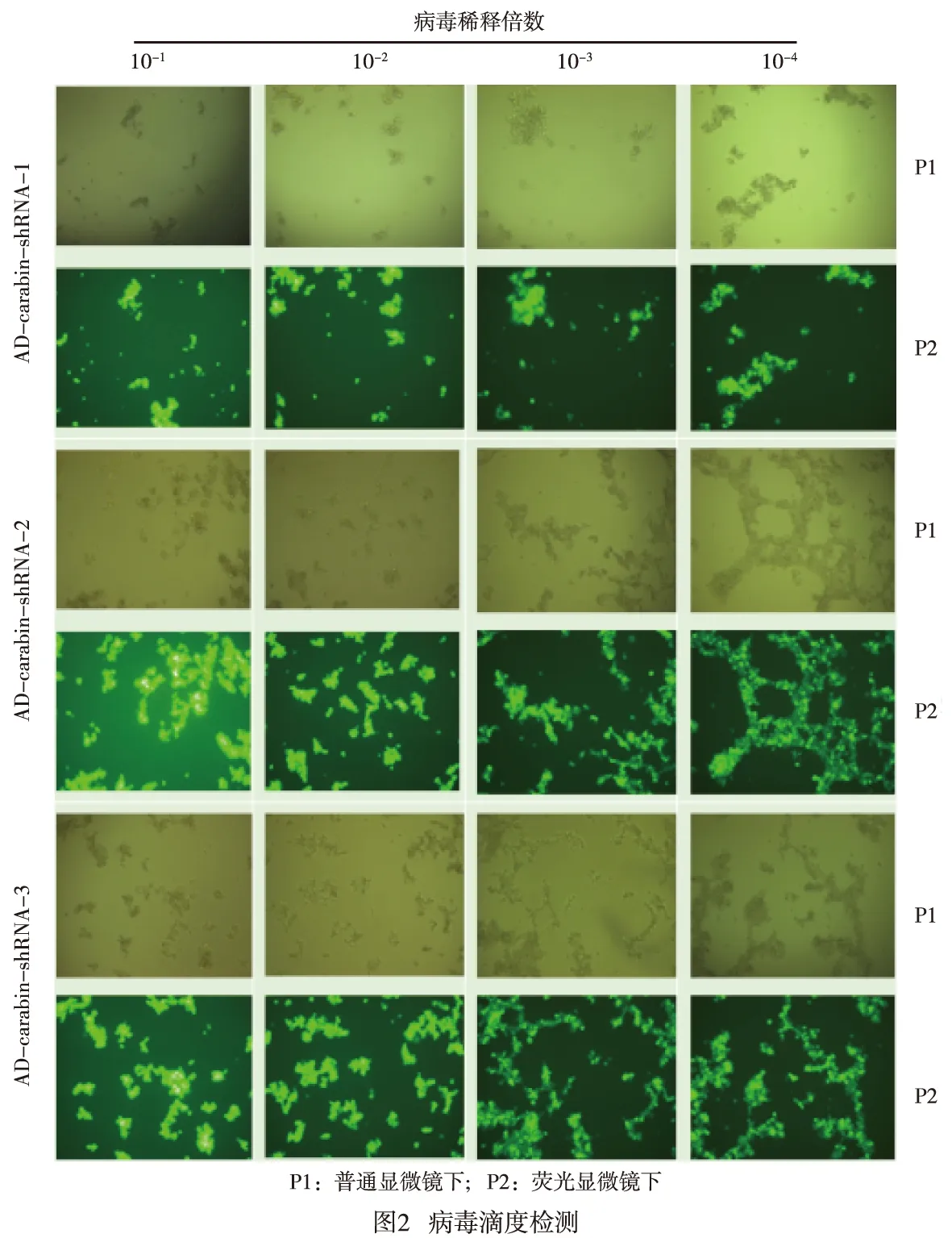
1.2.3 AD-carabin-shRNA滴度测定 参考复旦大学遗传学研究所方法[8],在293T细胞中测定并标定病毒滴度,采用微量全细胞病变法检测病毒滴度。取96孔板,每孔加入0.5×104~1×104293T细胞,48 h后弃去培养液,每孔加入100 μL经10倍梯度稀释的病毒液(每排8孔为一稀释梯度),继续培养72 h后观察荧光表达情况。正常情况下,荧光细胞数随稀释倍数增加而相应减少,计数最后2排含有荧光细胞的孔中的荧光细胞个数,将得到的数值除以各自相应的稀释倍数,即可计算出病毒原液的滴度值。病毒滴度=(X+Y×10)×1 000/2V (X、Y分别为最后两排有荧光的荧光细胞克隆数,V为病毒液的含量)。
1.2.4 AD-carabin-shRNA功能鉴定 H9C2心肌细胞传代至108时接种于6孔板中,当细胞生长至90%融合时,每孔加入含1×105病毒的100 μL病毒液,孵育4 h后更换培养基,44 h后检测H9C2心肌细胞的carabin RNA及蛋白表达。采用实时荧光定量PCR及Western blotting检测carabin mRNA和蛋白表达。其中3孔弃去培养液后,每孔按1 mL/10 cm2加入分离试剂tripure isolation reagent,按照说明书提取总RNA,接着按照Transcriptor First Stand cDNA Synthesis Kit试剂盒将RNA反转成cDNA,然后用LightCycler 480 PCR仪对carabin进行实时荧光定量PCR扩增。扩增条件为:95 ℃预变性10 min,95 ℃ 10 s~60 ℃ 10 s(荧光检测),40个循环。carabin引物序列,上游引物:5′-GGT GCA GCA AGG AGC CTG-3′,下游引物:5′-TGA GTC GGA CCC TAG AGA GC-3′,产物长度118 bp。内参β-actin引物序列,上游引物:5′-GGA GCA ATG ATC TTG AT-3′,下游引物:5′-CCT TCC TGG GCA TGG AGT C-3′,产物长度202 bp。另外3孔弃去培养液后,每孔加入500 μL细胞裂解液RIPA,超声裂解细胞收集蛋白,加入SDS煮沸变性蛋白,然后进行SDS-PAGE电泳、转膜、孵育一抗、孵育二抗、显色、成像,观察carabin蛋白表达,内参为β-actin。
1.3 统计学方法 采用方差分析和q检验。
2 结果
2.1 ADV4-U6-CMV-carabin-shRNA重组穿梭干扰质粒的构建 DNAMAN比对分析ADV4-U6-CMV-carabin-shRNA重组穿梭干扰质粒的基因测序结果,挑选与设计的3对carabin-shRNA寡核苷酸序列一致者,分别命名为ADV4-U6-CMV-carabin-shRNA-1、ADV4-U6-CMV-carabin-shRNA-2、ADV4-U6-CMV-carabin-shRNA-3(见图1)。

2.2 Ad-carabin-shRNA包装、收毒、扩增及滴度测定 将制备的ADV4-U6-CMV-carabin-shRNA腺病毒穿梭质粒与pGp-Ad-pac 载体骨架质粒共转染293A 细胞后,2周左右时显微镜下观察细胞出毒情况,待出现明显噬斑、细胞大部分病变从底部脱落时进行收毒。采用微量全细胞病变法检测病毒滴度,以倒数第二列(10-3)含有荧光细胞孔中的荧光细胞个数计算,病毒滴度为9×108TU/mL(见图2)。
2.3 Ad-carabin-shRNA功能鉴定 与对照组相比,Ad-carabin-shRNA-1和Ad-carabin-shRNA-2均可明显干扰carabin mRNA及蛋白表达(P<0.01)(见图3、表1)。
3 讨论
经结构鉴定,carabin蛋白含有一个CaN 结合区域和一个Ras结合区域:CaN结合区域位于羧基端,其最小结合区域为羧基末端的41个氨基酸残基(aa 406~446);Ras结合区域为氨基端的89位到294位氨基酸序(aa 89~294)[1]。经在体和离体实验的功能鉴定:(1)CaN 结合区域,carabin的转录和表达依赖于CaN信号通路的活化,而产生的carabin可与CaN结合,进而抑制CaN信号通路,因此carabin是作为CaN的负反馈抑制蛋白来发挥其调节作用的;(2)Ras结合区域,具有Ras GAP活性,可特异性地抑制Ras/ERK1/2信号通路。前期研究[1-4]表明,在T细胞及B细胞中carabin作为CaN的内源性负反馈抑制蛋白通过CaN-NFAT和Ras/ERK1/2信号通路负反馈抑制T细胞及B细胞的持续活化,在机体免疫中发挥着重要作用。

表1 Ad-carabin-shRNA在H9C2心肌细胞内的干扰效应
最近研究[5-6]表明,carabin在心肌细胞中亦有表达,可抑制心脏肥厚,并有可能成为诊治心衰的新靶点。我们的前期研究[7]显示,在小鼠冠状动脉左前降支结扎诱导的心肌梗死动物模型中,术后7 d及14 d梗死区域carabin的mRNA及蛋白表达水平均显著下调(约7倍),同时经缺血/缺氧处理的人心室肌细胞株AC16中表达均亦显著下调。那么下调的carabin在心肌梗死中是否会起到一定的作用呢,目前尚无相关研究报道。 carabin为一新发现的蛋白,目前尚未发现其特异性抑制剂,鉴于此,本研究利用RNA干扰(RNA interference,RNAi)技术,针对carabin蛋白构建相应干扰载体,以达到特异性抑制carabin的作用,为carabin的研究奠定基础。
RNAi技术是一种由外源性或内源性双链DNA介导的转绿后基因沉默技术。短发夹RNA(short-hairpin RNA,shRNA)是根据小干扰RNA(small interfering RNA,siRNA)技术设计的类似双链结构的RNA。相比于siRNA,shRNA随载体进入细胞后具有更高的内在稳定性,并且shRNA根据其特性可以在细胞内快速合成大量的shRNA,其沉默作用更加持久[9]。目前,用于目的基因转移的病毒载体主要包括腺病毒、腺相关病毒、慢病毒和逆转录病毒载体。与其他病毒载体系统相比,腺病毒载体具有遗传毒性低、不整合基因组、寄主范围广、感染效率高、可感染分裂期和静止期细胞、理化性质稳定及包容量大等优点,在分子生物学领域应用广泛[10]。因考虑后期研究涉及动物及细胞实验,对干扰效率要求高,因此本研究采用腺病毒载体构建carabin干扰载体。
在Ad-carabin-shRNA 构建过程中,我们首先合成3对carabin-shRNA寡核苷酸,退火形成双链后定向克隆至ADV4-U6-CMV穿梭质粒,经测序验证后与pGp-Ad-pac Vector骨架质粒共转染 293A 细胞,培养2周后收集病毒原液,再连续三代反复行病毒扩增。病毒滴度测定后,感染H9C2心肌细胞行Ad-carabin-shRNA功能鉴定,鉴定结果表明,AD-carabin-shRNA-1和AD-carabin-shRNA-2具有干扰效果。
