Ac-SDKP 对实验性矽肺纤维化模型中肺泡Ⅱ型上皮细胞衰老信号激活的调节作用
2021-04-19李雅倩张诗汇张乙靳馥宇李田杨欣雨刘舒鹏徐洪杨
李雅倩张诗汇张 乙靳馥宇李 田杨欣雨刘舒鹏徐 洪杨 方
(华北理工大学基础医学院;河北省器官纤维化重点实验室;河北省慢性病基础医学重点实验室,河北唐山 063210)
尘(矽)肺病目前已经成为世界重大职业卫生安全问题,其病因明确,可控可防,但缺乏有效治疗手段。课题组前期研究发现,内质网应激信号在实验性矽肺大鼠模型中激活,并介导肺泡II 型上皮细胞的凋亡和上皮间质转化进程;而N-乙酰基-丝氨酰-天冬氨酰-赖氨酰-脯氨酸(N-acetylseryl-aspartyl-lysyl-proline, Ac-SDKP)治疗能通过保护肺泡II 型上皮细胞,拮抗上皮间质转化进程,进而抑制胶原沉积,延缓实验矽肺大鼠模型的肺纤维化病程进展[1-2]。最近研究认为,细胞衰老与慢性肺疾病发生、发展关系紧密,其代表性信号因子,如毛细血管扩张性共济失调突变激酶(ataxia telangiectasia-mutated gene, ATM)、毛细血管扩张性共济失调 Rad3 相关激酶(ataxia telangiectasia and Rad3-related kinase, ATR 和 p53 蛋白的依次激活,引起 p16INK4a 信号、p21CIP1 信号活化,导致细胞周期阻滞[3-5]。然而,衰老相关信号在矽肺纤维化过程中是否激活,且Ac-SDKP 对衰老相关信号的作用仍未所知。因此本研究拟观察Ac-SDKP 能否通过对肺泡II 型上皮细胞衰老相关信号的调节从而发挥拮抗矽肺纤维化的作用及其机制。
1 材料和方法
1.1 实验动物
SPF 级,3 周龄 Wister 雄性大鼠(80±10)g30 只购于北京维通利华动物技术有限公司[SCXK(京)2016-0008],置于华北理工大学实验动物中心[SYXK(冀)2020-0007]饲养,温度为 20 ℃ ~26℃,相对湿度为40% ~70%,12 h 进行一次昼夜交替,动物自由取食饮水。本实验经华北理工大学动物伦理委员会批准(LX2019035)。并且在实验过程中严格按照3R 对实验动物给予人道的关怀。
1.2 主要试剂
SiO2粉尘购于美国Sigma 公司;Ac-SDKP 购于瑞士Bachem AG 公司;细胞培养用胎牛血清、培养基等购自以色列BI 公司;天狼星红染色试剂盒购于中国贝索公司;荧光二抗购于美国Novex 公司;含DAPI 封片剂购于美国abcam 公司;免疫印迹总蛋白提取试剂盒由中国英文特生物提供;p21 购于BD Pharmingen 公 司; 表 面 活 性 蛋 白 C 前 体(prosurfactant Protein C, proSP-C) 购于美国millipore 公司;Col I、ATM、ATR 由中国武汉博士德公司提供;p-ATM、p-ATR 由美国 Affinit 公司提供;p-p53-s15、p16 购于中国 ABclonal 公司;p53 购于中国 arigo 公司;二抗购买于美国KPL 公司;ECL 发光试剂由中国庄盟国际公司提供。
1.3 实验方法
1.3.1 实验性矽肺模型的建立
大鼠实验分组(每组10 只)为:(1)对照组:置于染尘柜,吸入纯净气3 h/d,每周5 天,16 周后腹腔内埋入含0.9%生理氯化钠溶液200 μL 微量缓释胶囊至24 周结束;(2)矽肺模型组:置于染尘柜,吸入50 μg/m3SiO2,每周5 天,16 周后腹腔内埋入含0.9%生理氯化钠溶液200 μL 微量缓释胶囊至24 w结束;(3)Ac-SDKP 治疗组:造模条件同矽肺模型组,腹腔内埋入含800 μg/kg·d Ac-SDKP 的0.9%生理氯化钠溶液200 μL 微量缓释胶囊至24 周结束[1-2,6]。实验结束后,4%多聚甲醛固定右下肺,将其余肺组织-80℃保存备用用于下游实验。
1.3.2 细胞培养
肺泡Ⅱ型上皮细胞株 MLE-12 细胞培养在37℃、体积分数为5%的CO2孵育箱中,用含10%胎牛血清和1%双抗的DMEM/F12 培养基培养,采用第3 代细胞进行实验,同步化24 h 后分为4 组:(1)对照组;(2)SiO2诱导组:0.05 g/L SiO2;(3)Ac-SDKP 组:10-8mol/L Ac-SDKP;(4)SiO2+Ac-SDKP组:先给予 Ac-SDKP 处理 30 min,再给予 SiO2诱导[7]。
1.3.3 天狼星红染色
石蜡切片脱蜡至水,铁苏木素染核1 ~2 min,滴加天狼星红染液室温染色1 h,弃去染色液,95%乙醇脱色,无水乙醇脱水,二甲苯透明,中性树胶封片。计数胶原面积分布百分比。
1.3.4 免疫荧光染色
石蜡切片脱蜡至水,H2O2封闭内源性过氧化物酶,高压修复,一抗 p21(1 ∶200)、proSP-C(1 ∶200)4℃过夜;二抗37℃ 孵育30 min,用含DAPI 封片剂封片,镜下观察。
1.3.5 免疫印迹
提取组织/细胞总蛋白,BCA 法测定蛋白浓度,以每个泳道15 μg 上样,常规进行电泳及电转。一抗 Col I、p-ATM、ATM、p-ATR、ATR、p-p53-s15、p53、p21、p16,1 ∶1000 稀释 4℃过夜;二抗 1 ∶5000 稀释 37℃孵育40 min,ECL 发光试剂显色。采用 Image-Pro-plus 6.0 图像处理软件对条带进行分析,计算经内参蛋白及对照组均衡后作目的蛋白的相对表达量。
1.4 统计学方法
2 结果
2.1 Ac-SDKP 抑制矽肺大鼠胶原沉积
各组动物无死亡,其中对照组大鼠饮食、饮水及活动情况正常,矽肺模型组以及Ac-SDKP 治疗组大鼠饮食、饮水情况尚可,但活动量明显减少。如图1 所示,经动式染尘24 周的矽肺模型组大鼠肺内可见多个矽结节且伴有胶原沉积,而Ac-SDKP 治疗组矽结节数量和矽结节面积均较矽肺模型组减少(表1)。
免疫印迹如图2 所示,和对照组相比,矽肺模型组大鼠COL I 蛋白表达显著上调,而与矽肺模型大鼠相比,Ac-SDKP 治疗组COL I 蛋白的表达明显下调(表2)。以上结果经方差分析,差异具有统计学意义(P<0.05)。
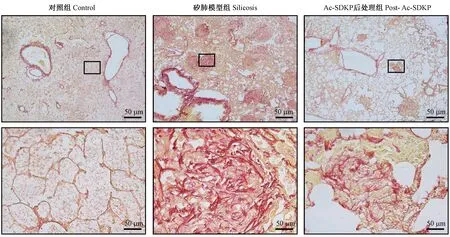
图1 Ac-SDKP 对矽肺大鼠模型胶原沉积的调节作用(天狼星红染色)Figure 1 Effect of Ac-SDKP on collagen deposition in rats exposed to silica (Sirius red staining)
2.2 Ac-SDKP 抑制细胞衰老
免疫荧光化学染色结果如图3 所示,采用proSP-C 标记肺泡Ⅱ型上皮细胞,可见在对照组中肺泡Ⅱ型上皮细胞多位于肺泡连接处,在矽肺模型组及Ac-SDKP 治疗组中可见肺泡Ⅱ型上皮细胞分布于矽结节周围,并均可见proSP-C 和p21 阳性共表达细胞。
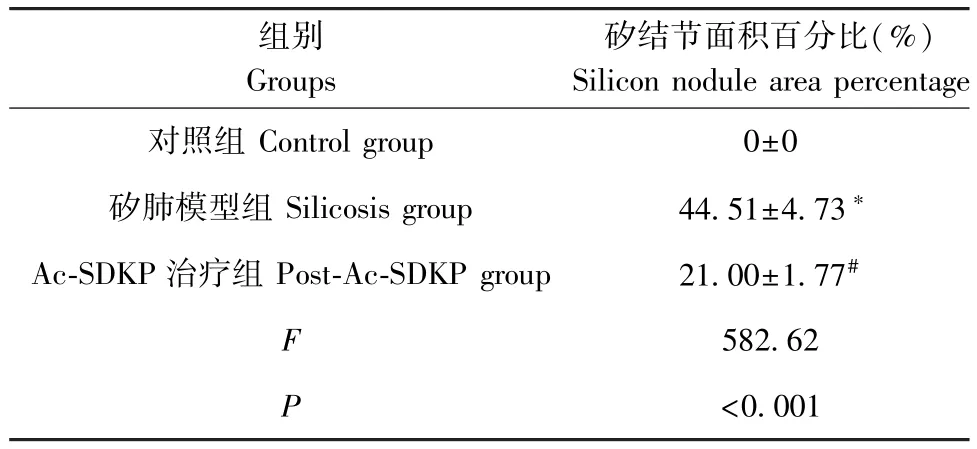
表1 Ac-SDKP 抑制实验性大鼠胶原沉积(%, n=10)Table 1 Ac-SDKP inhibits collage deposition in rats exposed to silica
表2 Ac-SDKP 对矽肺大鼠模型胶原沉积的调节作用( ±s)Table 2 Regulation of Ac-SDKP on collagen deposition in silicosis rat model

表2 Ac-SDKP 对矽肺大鼠模型胶原沉积的调节作用( ±s)Table 2 Regulation of Ac-SDKP on collagen deposition in silicosis rat model
注:与对照组比较,∗P<0.05;与矽肺模型组比较,#P<0.05。Note.Compared with the control group, ∗P<0.05.Compared with the silicosis group, #P<0.05.
组别Groups Col I对照组 Control group 1.86±0.55矽肺模型组 Dust group 6.68±1.26∗Ac-SDKP 治疗组 Post-Ac-SDKP group 3.85±0.63#F 26.00 P<0.001
免疫印迹结果如图4 所示,和对照组相比,矽肺大鼠模型组中的 Col I、p-ATR、p-ATM、p-p53、p21 及p16 蛋白表达显著增加,和矽肺大鼠模型组相比,Ac-SDKP 后处理组大鼠各蛋白水平明显下调(表3)。以上结果经方差分析,差异具有统计学意义(P<0.05)。
2.3 Ac-SDKP 抑制 SiO2 介导的 MLE-12 细胞细胞衰老
取3 代细胞进行实验,镜下观察细胞状态良好,细胞密度为80%时按照实验设计进行诱导。细胞免疫荧光染色结果如图5 所示,p21 在SiO2诱导的MLE-12 细胞中高表达,而Ac-SDKP 处理组中 p21的表达减弱。
细胞免疫印迹结果如图6、表4 显示,与对照组相比,SiO2诱导的 MLE-12 细胞中 Col I、p-ATR、p-ATM、p-p53、p21 及 p16 蛋白表达显著上调。与SiO2诱导组相比,Ac-SDKP 治疗组各蛋白的表达明显下调,以上结果经方差分析,差异具有统计学意义(P<0.05)。
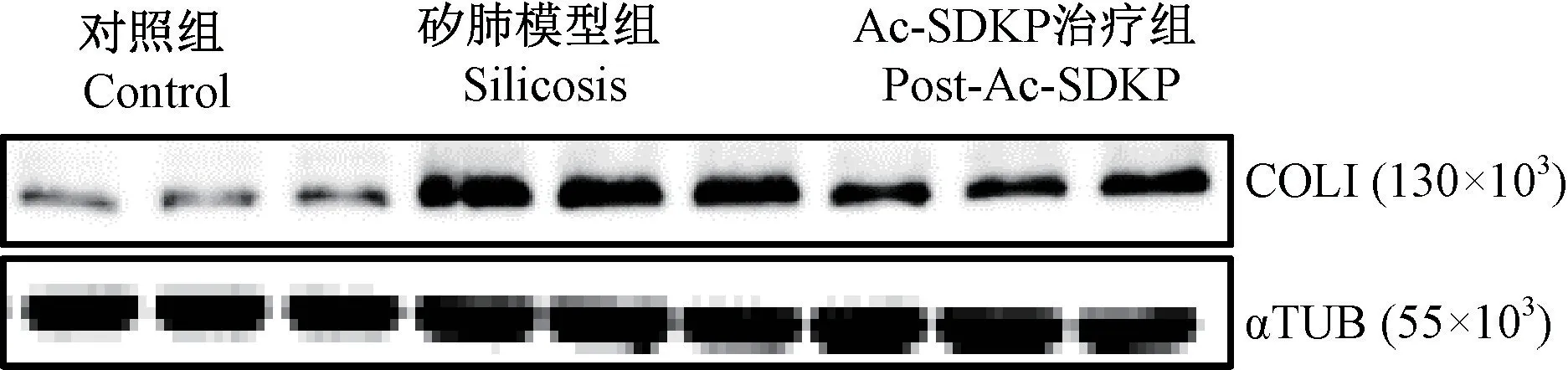
图2 Ac-SDKP 对矽肺大鼠模型胶原沉积的调节作用Figure 2 Regulation of Ac-SDKP on collagen deposition in silicosis rat model
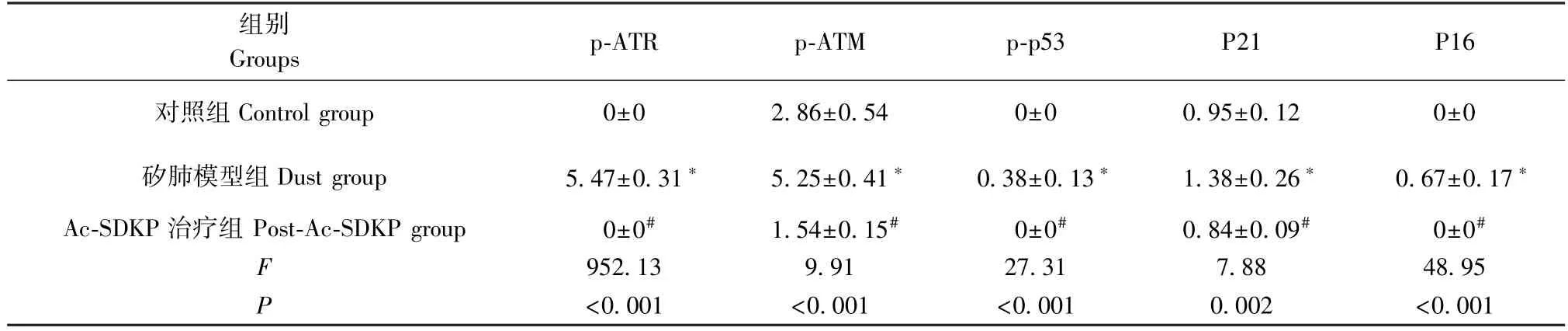
表3 Ac-SDKP 对染尘的矽肺大鼠 p-ATR、p-ATM、p-p53、p21 及 p16 蛋白水平的影响Table 3 Effects of Ac-SDKP on the protein levels of p-ATR, p-ATM, p-p53, p21 and p16 in SiO2-induced silicosis rats
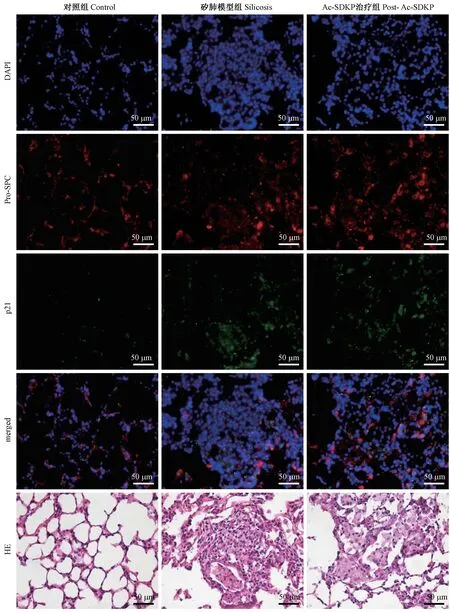
图3 p21 与pro-SP-C 在大鼠肺组织中的共表达(免疫荧光化学染色)Figure 3 The co-expression of p21 and pro-SPC in rats (Immunofluorescence staining)
表4 Ac-SDKP 对 SiO2 诱导的 MLE-12 细胞 Col I、p-ATR、p-ATM、p-p53、p21 及 p16 蛋白水平的影响( ±s)Table 4 Effects of Ac-SDKP on the protein levels of Col I, p-ATR, p-ATM, p-p53,p21 and p16 in SiO2-induced MLE-12

表4 Ac-SDKP 对 SiO2 诱导的 MLE-12 细胞 Col I、p-ATR、p-ATM、p-p53、p21 及 p16 蛋白水平的影响( ±s)Table 4 Effects of Ac-SDKP on the protein levels of Col I, p-ATR, p-ATM, p-p53,p21 and p16 in SiO2-induced MLE-12
注:与对照组比较,∗P<0.05;与SiO2 诱导组比较,#P<0.05。Note.Compared with the control group, ∗P<0.05.Compared with the SiO2 induced group, #P<0.05.
组别Groups Col I p-ATR p-ATM p-p53 P21 P16对照组 Control group 0.98±0.15 0.31±0.13 0.98±0.49 0.89±0.22 0.34±0.05 1.37±0.02 Ac-SDKP 组 Ac-SDKP group 0.94±0.03 0±0 0.67±0.13 0.62±0.08 0.17±0.01 1.12±0.06 SiO2 诱导组 SiO2induction group 1.54±0.15∗ 1.00±0.17∗ 1.05±0.14∗ 1.45±0.10∗ 1.09±0.14∗ 1.87±0.16∗SiO2+ Ac-SDKP 组 SiO2+Ac-SDKP group 1.28±0.09# 0.11±0.13# 0.59±0.13# 0.89±0.18# 0.85±0.06# 1.13±0.26#F 16.71 38.57 9.91 14.86 84.44 15.21 P 0.242 <0.001 <0.001 <0.001 <0.001 <0.001
3 讨论
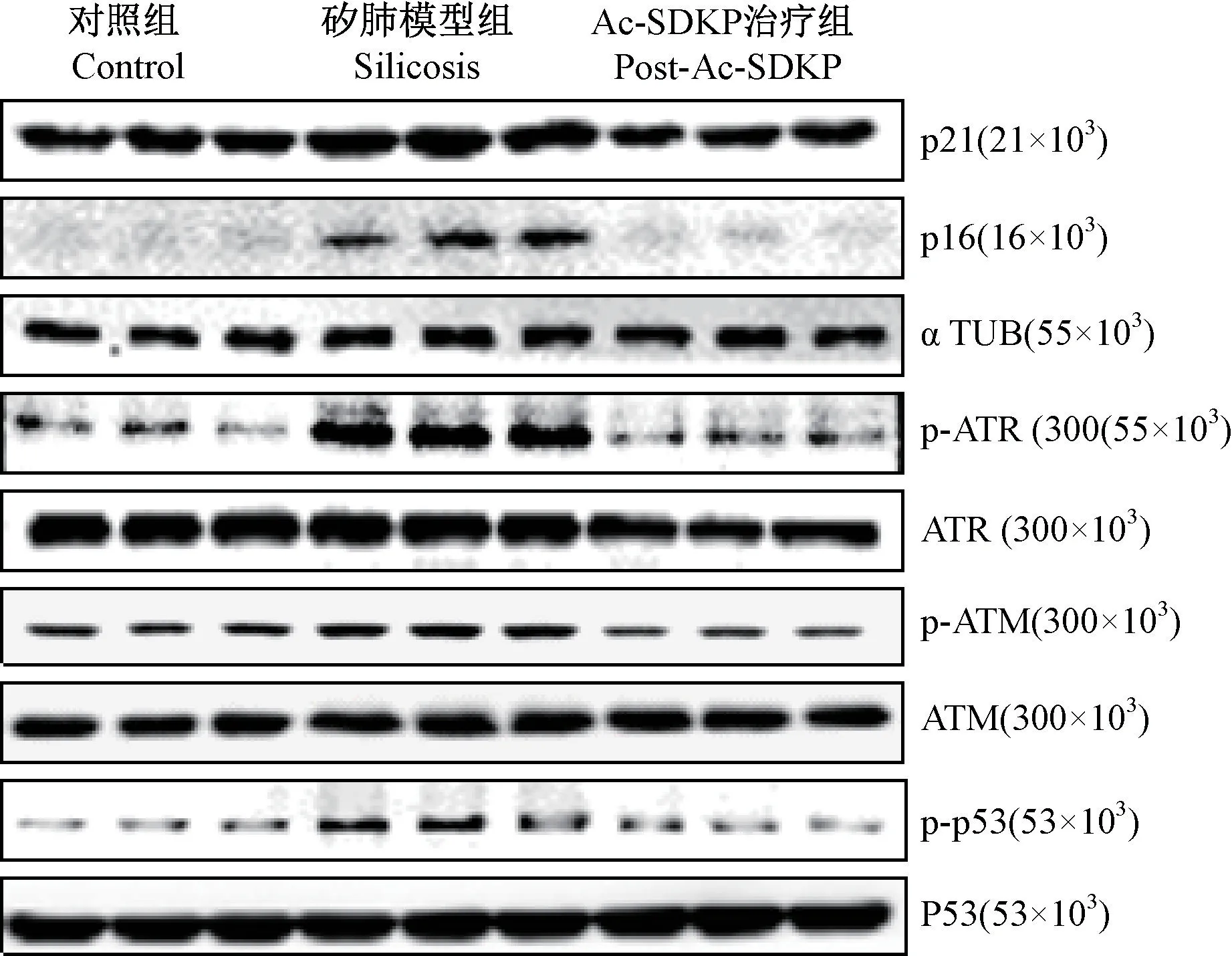
图4 Ac-SDKP 对染尘的矽肺大鼠p-ATR、p-ATM、p-p53、p21 及 p16 蛋白水平的影响Figure 4 Effects of Ac-SDKP on the protein levels of p-ATR,p-ATM, p-p53, p21 and p16 in SiO2-induced silicosis rats
研究表明,内质网应激、线粒体功能失调和端粒缩短是细胞衰老的重要分子生物学基础,在多种慢性肺部疾患中起到了重要调控作用,促进了特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)、慢性阻塞性肺疾病等疾病的进展[3-5]。在尘(矽)肺纤维化研究领域,尘肺病患者发病工龄与接尘年龄呈反比,及接尘年龄越高,其罹患尘肺的周期越短,提示尘(矽)肺的发生与老龄因素有关8]。在实验性矽肺大鼠模型的研究中也发现,内质网应激标记物磷酸化组蛋白H2AX(phosphorylated histone H2AX,γH2AX)和衰老标记物p21 在大鼠肺组织中,随着染尘月数的增加而增加[1];在实验性矽肺小鼠模型中,也具有类似的表现[9]。而炎症、内质网应激和自噬,能够驱动p53 及其下游靶蛋白的活化,或介导肌成纤维细胞分化,或促进上皮间质转化,参与对了肺纤维化形成的调控[10-11]。提示实验性矽肺模型中可能伴随着衰老信号的活化。为了证实衰老信号在矽肺纤维化进展中是否激活,在本研究中首先检测了应激性衰老的相关指标,发现p-ATR、p-ATM、p-p53、p21 及 p16 蛋白水平在矽肺模型组中显著上调,提示在实验性染尘模型中存在着衰老相关信号的活化。进一步采用肺泡II 型上皮细胞标记物proSP-C 与衰老标记物 p21 免疫荧光双标实验发现,在矽肺大鼠模型肺组织中,细胞衰老主要存在于肺泡II 型上皮细胞中。
肺泡II 型上皮细胞作为肺内干细胞,能够向肺泡I 型上皮细胞分化,并具有重要的肺水转运和免疫功能,因此肺泡II 型上皮细胞发生衰老,是肺纤维化重要的驱动因素[12]。体外予以博来霉素诱导,能够促进肺泡II 型上皮细胞衰老,伴随着p21、p16蛋白表达水平的上调[13]。而SiO2能够在体外诱导肺泡上皮细胞和支气管上皮细胞发生DNA 双链断裂,进而激活ATM,从而引起了炎症反应和DNA 损伤的积聚[14]。因此在本研究中,采用较低剂量的SiO2诱导,细胞活力未见明显改变,但 p-ATR、p-ATM、p-p53、p21 及 p16 蛋白水平显著上调,提示 50 μg/mL 剂量的SiO2能够诱导MLE-12 细胞发生细胞衰老,伴随着I 型胶原蛋白水平的上调。上述结果提示,肺泡II 型上皮细胞的衰老可能与矽肺纤维化的发生、发展关系密切。
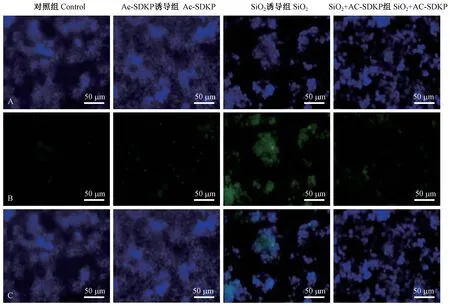
注:A:DAPI;B:p21;C:merged。图5 p21 在MLE-12 细胞中的表达(免疫荧光化学染色)Note.A, DAPI.B, p21.C, merged.Figure 5 Expression of p21 in MLE-12 cells (Immunofluorescence staining)
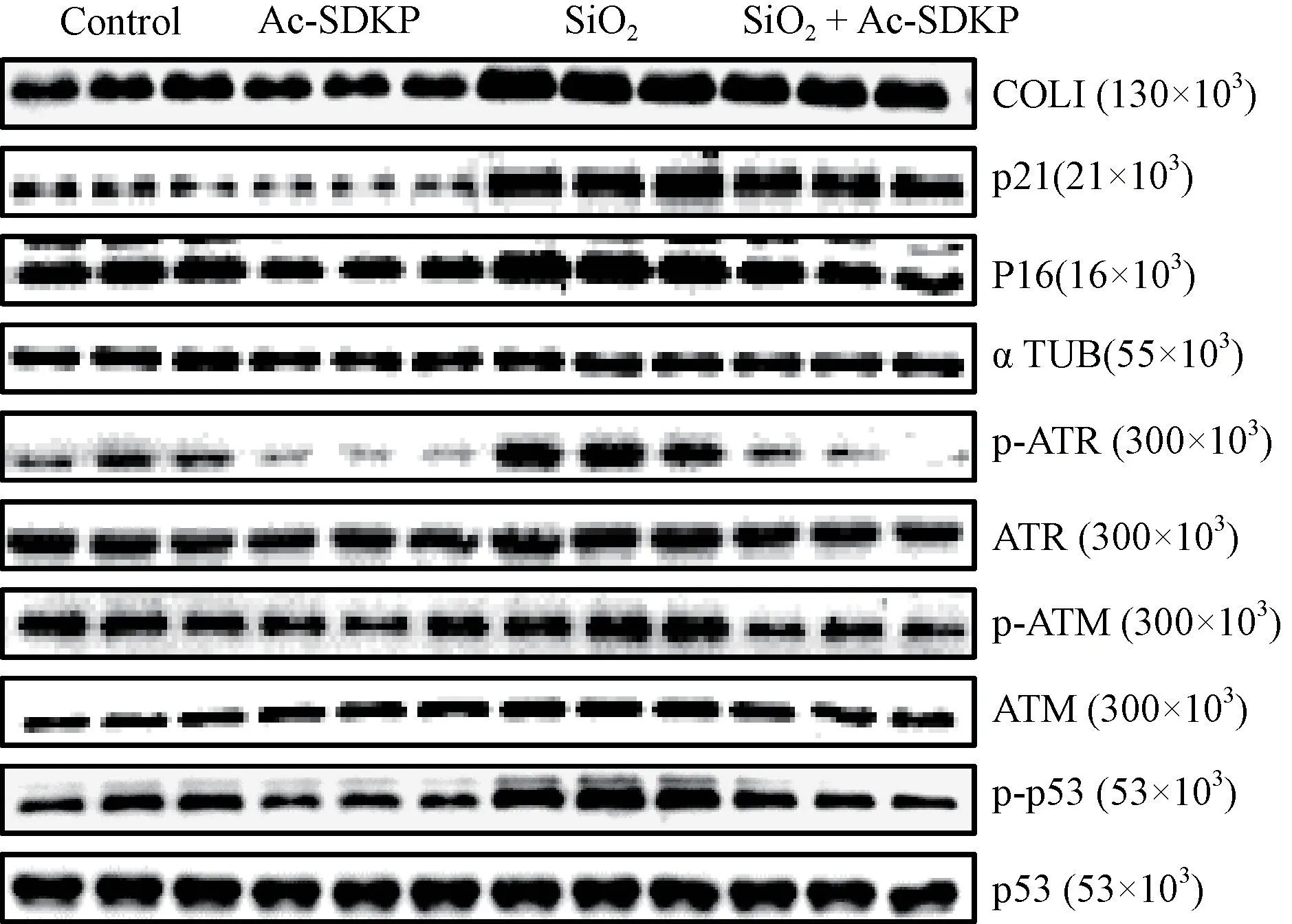
图6 Ac-SDKP 对 SiO2 诱导 MLE-12 细胞 Col I、p-ATR、p-ATM、p-p53、p21 及 p16 蛋白水平的影响Figure 6 Effects of Ac-SDKP on the protein levels of Col I,p-ATR, p-ATM, p-p53, p21 and p16 in SiO2-induced MLE-12
Ac-SDKP 是一类具有抗炎和抗矽肺纤维化作用的短肽,在多种纤维化模型中均发现其能够拮抗器官纤维化进展,具有很好的临床转化基础[12,15]。最近课题组研究结果也显示,Ac-SDKP 可通过调节肾素血管紧张素系统,从而参与对实验性矽肺纤维化的阻抑效应[7,16-17]。在本研究中,进一步完善和补充了Ac-SDKP 的抗器官纤维化作用机制,即Ac-SDKP 能够显著抑制SiO2介导的肺泡II 型上皮细胞的衰老,从而拮抗了矽肺纤维化的发生与发展。
