癫痫动物模型的研究进展
2021-04-19董博思邱湘苗赖婉琳李宛凌彭安娇陈
董博思邱湘苗赖婉琳李宛凌彭安娇陈 蕾
(四川大学华西医院神经内科,成都 610041)
癫痫是一种常见的由多种病因所致的发作性神经系统疾病,为了了解其复杂的生理病理机制,探究相关遗传因素及开发抗癫痫药物(antiepileptic drugs, AEDs),人们建立了癫痫动物模型。最初的模型是Jackson 等人于1869 年在狗身上建立的[1],在此基础上各种理化因素诱导的动物模型根据不同的研究目的被建立。本文将目前已有的癫痫动物模型的诱发方式、优缺点、主要应用、改良方式等做一总结。
1 常见癫痫模型的行为学特征及优缺点
常用癫痫建模方法及应用见表1。
1.1 化学药物
常用的化学点燃方式可通过直接在动物脑内注射低剂量的兴奋剂,或通过反复系统应用阈下浓度的惊厥剂来诱发癫痫。由于点燃可以精确地确定癫痫发作的时间、癫痫发作的部位,故可提供癫痫倾向性、反复癫痫发作对大脑的影响、不同结构在调节癫痫持续时间和扩散中的作用、不同区域相对易感性等大量信息。当然它也有一定的缺点:局部刺激可能无法预测其他部位的后果;在正常动物中进行的癫痫可能与癫痫动物的发作结果不同,且不同品系、年龄、性别动物对这些化学致痫剂及AEDs 反应存在差异[2];点燃也是一个昂贵和耗时的过程,包括植入物丢失、损坏的风险。此外,许多化合物在全身给药时也能产生急性全面性起源发作,如3-巯基丙酸、β-咔啉、美解眠等。这些模型的共同优点是制作简单,虽然致痫机制稍有不同,但药物的选择通常主要取决于研究者的熟悉程度[3]。该类模型对我们了解从刺激性癫痫到癫痫持续状态的转变有哪些变化,癫痫在什么时候加重并导致脑损伤,以及如何预防等问题至关重要。
1.1.1 戊四氮(pentylenetetrazol, PTZ)
化学药品中最经典的便是通过阻断GABA 传递致痫的PTZ,可用于建立急、慢性癫痫动物模型。在啮齿类动物中以阈值剂量注射PTZ 可导致急性肌阵挛和紧张性扩张;而以较低的阈下剂量重复给药可引起点燃现象,其最初的非惊厥剂量可降低实验动物的死亡率,同时大多数动物都能诱发癫痫活动,如无需后续药物干预的改良window-PTZ 点燃法[4],但少见明显苔藓纤维发芽及自发性癫痫发生[5]。此外,低剂量 PTZ(20 ~30 mg/kg)可引起失神发作,适合于相关AEDs 筛选[6]。
1.1.2 红藻氨酸(kainic acid, KA)
KA 是一种从红藻中提取的L-谷氨酸神经毒类似物,对海马具有特别突出的毒性作用,并呈剂量依赖性,故以中小剂量常用[7]。脑内注射KA 可用于研究致痫灶对周围和正常脑组织的影响,而全身注射KA 通常用来研究大脑多个区域对癫痫发生的易感性和药物研究。在此基础上的KA 快速点燃法可节约时间、药品成本且具有永久性[8],KA 模型在潜伏期、行为症状、潜伏期持续时间以及潜伏期和慢性期的脑电图特征等方面与人类相似[9],有助于我们更好地了解颞叶癫痫过程,开发更有效的靶向治疗药物。此外,用KA 靶向注射小鼠腹侧海马可建立一个在癫痫发作和认知表型与标准背侧海马模型相似的颞叶癫痫模型,但具有明显的情感特征,可用于进一步研究颞叶癫痫的重要共病[10]。
1.1.3 匹罗卡品
毛果芸香碱(匹罗卡品)诱导癫痫的能力可能取决于M1 受体的激活,并可在癫痫发作后可引起海马谷氨酸水平升高及NMDA 受体激活,从而维持癫痫发作[11]。该模型具有反复自发性发作、典型海马硬化、苔藓纤维发芽等特点[12]。匹罗卡品模型相较于上述药物发作更加持久,更可靠、实验时间更短及成本最低。虽然其脑电图特征和神经病理学改变与KA 相似,但全身应用匹罗卡品后,可观察到丘脑、黑质、大脑皮质等更广泛的形态学病变,但须考虑到系统性使用KA 也可能会导致海马外区域损伤,且颞叶癫痫患者也会有海马外神经元损伤的表现。此外,锂-毛果芸香碱模型不仅可减少匹罗卡品剂量,也显示出与人类持续性癫痫非常相似的表现,杏仁核电刺激代替锂预处理也可得到类似效果[13]。
1.1.4 金属
通过损伤皮层制备癫痫模型应用最为广泛的便是植入金属,其中最具有代表性的是涂抹铝乳膏的动物模型。该模型发作间期和发作期脑电图与临床局灶性癫痫相似,偶尔会进展为继发性全面强直阵挛性发作,且该模型对标准AEDs 的反应也与局灶性癫痫患者相同[14]。虽然植入金属模型是慢性局灶性癫痫的良好模型,但制备难度大、成本高。另外,铁离子导入蛛网膜下腔动物模型与皮层或杏仁核注射相比,虽不适合作为人类难治性癫痫的药物及发病机制研究,但其早期诱发出癫痫强烈,成功率高(95%),且能模拟人类蛛网膜下腔出血所产生的癫痫,操作起来也相对容易[15]。
1.1.5 青霉素
低剂量青霉素诱导局灶性癫痫模型适用于研究癫痫发作活动扩散的分析[16],但青霉素模型更常用于模仿具有抗药性的失神发作,且PTZ、光刺激和GABA 能激动剂可加剧发作。但给啮齿动物肌注时,不会持续产生与猫相似的双边同步棘慢波发放(spike wave discharges, SWDs),相反地会产生多灶性尖峰。不过用青霉素预处理大鼠后,可增加其他化学药物诱导SWDs[17],对研究与棘慢波发放相关的细胞机制与在产生棘慢波爆发时皮质对皮质下结构的作用非常有用。
1.1.6 AY-9944
AY-9944 是一种抑制7-脱氢胆固醇降解为胆固醇的化合物,是目前唯一永久性的不典型失神模型,其诱导机制尚不完全清楚,不过为胆固醇在抑制癫痫发生的作用提供思路。另外AY 结合抗有丝分裂剂(methylazoxymethanol acetate, MAM)可模拟伴有脑发育不全的难治性不典型失神发作[18]。该模型在可靠性、自发性、复发性和诱发癫痫的慢性发作方面比遗传模型相更具优势,但在识别和量化实验性失神发作所需脑电图监测方面要求更高。
1.1.7 γ-羟基丁酸盐(γ-hydroxybutyrate, GHB)
GHB 模型是公认的失神发作模型,可观察到双侧同步的与行为停止、面部肌阵挛和颤动抽搐有关的SWDs[19]。使用有生物活性的GHB 前体(GBL)可产生与GHB 完全相同的脑电图和行为效应,但其效应相对更持续和迅速。
1.2 物理方法
1.2.1 电刺激
一种局灶性癫痫发作模型是通过直接电刺激皮质产生的,重复电脉冲会导致脑急剧放电[20]。另一种更常用的是通过电点燃数周后,动物可表现出自发癫痫发作。对于电刺激参数,通常认为电刺激间隔时间才是关键变量,在波宽1 ms, 频率60 Hz,刺激时间为1 s 的标准条件下,间隔15 min 到7 d都能引出点燃,但间隔15 ~30 min 需要更多次刺激才能点燃[21]。在此基础上一种快速电点燃模型可使苔藓纤维发芽发展更快,减少动物痛苦[22]。
由于电点燃法需要先进的外科手术和脑电图技术,6 Hz 角膜点燃法成为了一种简单有效的替代方法。该模型在显性表现和脑电图模式上与精神运动性癫痫具有高相似性;也被认为是耐药性癫痫潜在治疗药物的筛选工具[23]。然而,电点燃与海马硬化症无关,损伤与颞叶癫痫也不相似,自发癫痫相对药物发生较少。
最大电休克(maximal electroshock, MES)是目前研究全面性发作最透彻、最适宜使用的模型。因为MES 和PTZ 制备方法简单,且有比较高的筛选AEDs 的效率,故MES 模型和PTZ 模型通常是作为初次筛选癫痫药物的金标准。但MES 模型对作用于离子型通道的药物有偏向性,易导致其他AEDs(如氨基己酸、噻加宾等)被忽略[24]。
此外Hunter 等[25]人的研究显示刺激内丘脑可产生类似失神表现和脑电图,但是由于需要长期置入电极需不断刺激,且死亡率相对较高,而很少使用于制造失神模型。
1.2.2 低温
低温损伤模型是一种不需要将外源性药物注入体内也可以引起局灶性癫痫的模型。这种液氮探针可造成致痫病灶伴随脑水肿发生,发作可持续数天,具有可重复性,死亡率较低(<5%),可发生自发性癫痫,但动物年龄、系统给药对该模型惊厥阈值的影响还不清楚[17]。
1.3 遗传模型
一些神经元烟碱乙酰胆碱受体基因(CHRNA4,CHRNB2,CHRNA2)和KCNT1 引起常染色体显性遗传性夜间额叶癫痫和LGI1 与具有听觉特征的常染色体显性遗传性癫痫的啮齿类动物模型[26]使得遗传因素在局灶性癫痫中的重要作用现已得到充分证实。而利用遗传性模型来研究人类全面发作也被认为是目前最有希望的途径之一[3],主要有光敏性狒狒Papio Papio 模型、遗传性癫痫易感鼠听源性模型、个体差异较大的癫痫易感沙土鼠(MG)等模型。此外,遗传因素在失神发作的发病机制中也发挥着重要作用,但大多数品系的小鼠与在WAG/Rij大鼠身上观察到的相反,并没有自发的SWDs,而当观察到SWDs 时,通常伴发其他神经系统疾病,如嗜睡小鼠(l h/l h)、Tottering 鼠、Stargazer 鼠、Ducky 鼠等[27]。研究人员还发现一些品系还具有其他特性,适宜用来研究癫痫与抑郁等其他疾病的关系,并有助于制定治疗这些共病的新治疗策略[28]。然而,自然界发现的癫痫动物不能确保一定是研究所筛选的基因引起的,目的性地敲除或过表达所要研究的基因、制作出特定的小鼠基因模型越来越受欢迎(见表2)。但特定的基因表达可能导致任何年龄的动物死亡,如果转基因DNA 随机插入基因组,在多达5%的转基因品系中会发生中断或干扰内源性基因的表达,而这种插入突变产生的潜在表型是不可预测的,明显干扰了研究对转基因本身表达产生癫痫的解释。
1.4 新生儿惊厥模型
新生儿惊厥动物模型有助于研究自发性发作的潜伏期和降低癫痫发作阈值,有望用于探究预防癫痫发作的方法,也适宜进行细胞培养用于体外研究。目前主要有缺氧缺血(hypoxia-ischemia, HI)和热性惊厥(febrile seizures, FSs)模型成功复制了新生儿惊厥发作的一些结构异常和认知功能障碍。现快速缺血缺氧模型可没有明显脑损伤,且各品系之间差别微小[29]。但FS 不涉及明显的神经元丢失[30],且动物癫痫发作是由高温引起的,这些都与人类的疾病过程不同;而HI 模型在更年幼(P5)和成年(P60)大鼠通常不会发作[31],这其中可能涉及其他机制。
此外,上述药物或技术可联合使用以实现各种模型优势互补。有研究发现苯环定(phencyclidine,PCP)对125 mg/kg NMDA 引起癫痫表现没有干扰,但可大大降低动物死亡率[32];联合镇静剂与感觉刺激可产生无人工制品使用和脑损伤的模型,用于研究反射性癫痫产生和传播机制,以及评价AEDs[33];还有在应用基因工程技术增加动物癫痫易感性的基础上,用点燃等方式诱发癫痫来研究遗传机制等。

表1 常见动物模型制备Table 1 The summary of models of seizures and epilepsy

续表1

续表1

续表1
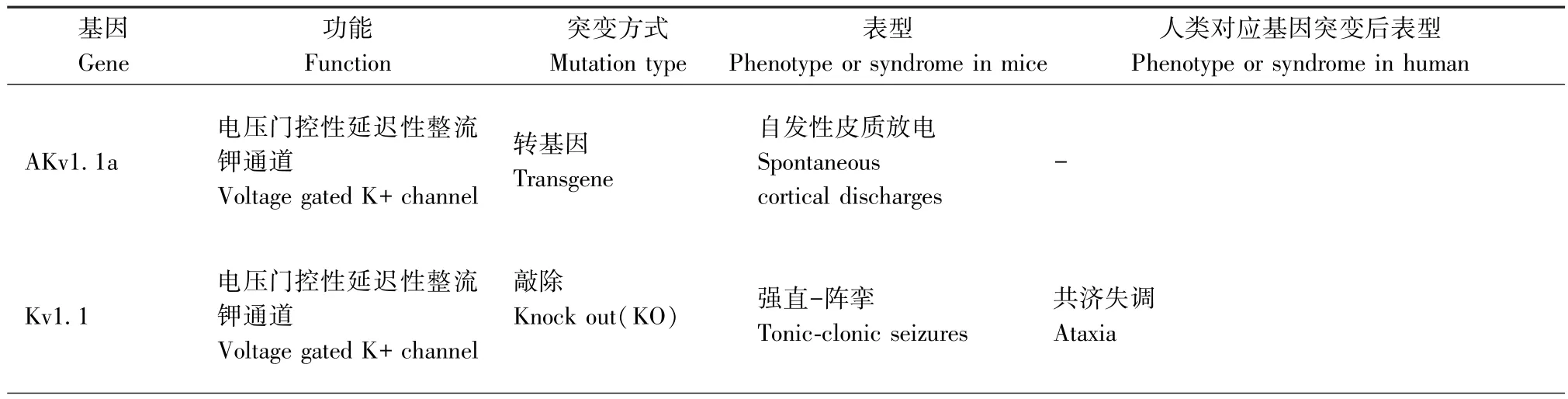
表2 基因小鼠模型Table 2 The summary of genetic models
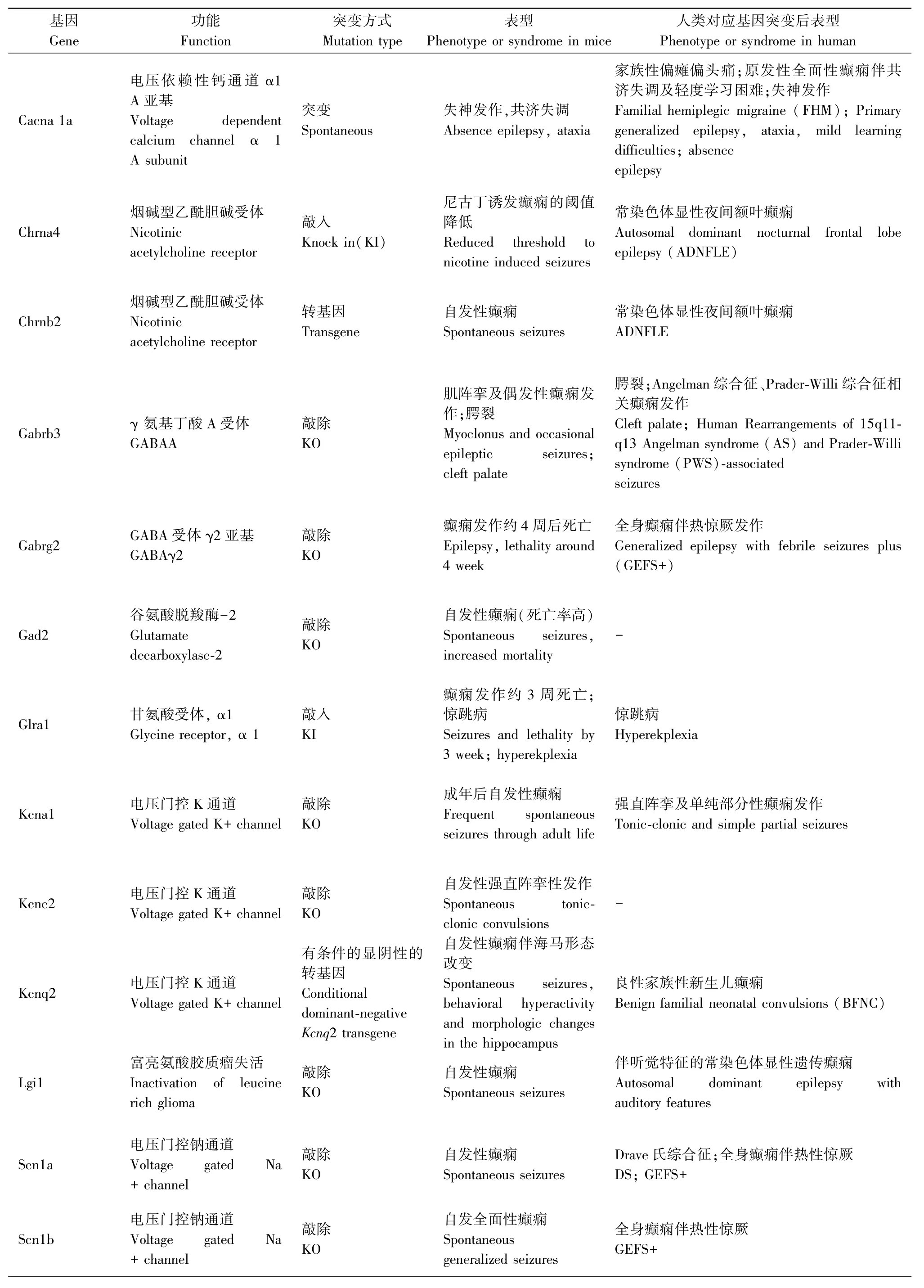
基因Gene功能Function突变方式Mutation type表型Phenotype or syndrome in mice人类对应基因突变后表型Phenotype or syndrome in human Cacna 1a Chrna4 Chrnb2电压依赖性钙通道 α1 A 亚基Voltage dependent calcium channel α 1 A subunit烟碱型乙酰胆碱受体Nicotinic acetylcholine receptor烟碱型乙酰胆碱受体Nicotinic acetylcholine receptor突变Spontaneous敲入Knock in(KI)转基因Transgene失神发作,共济失调Absence epilepsy, ataxia尼古丁诱发癫痫的阈值降低Reduced threshold to nicotine induced seizures自发性癫痫Spontaneous seizures家族性偏瘫偏头痛;原发性全面性癫痫伴共济失调及轻度学习困难;失神发作Familial hemiplegic migraine (FHM); Primary generalized epilepsy, ataxia, mild learning difficulties; absence epilepsy常染色体显性夜间额叶癫痫Autosomal dominant nocturnal frontal lobe epilepsy (ADNFLE)常染色体显性夜间额叶癫痫ADNFLE Gabrb3 γ 氨基丁酸 A 受体GABAA Gabrg2 GABA 受体 γ2 亚基GABAγ2敲除KO敲除KO肌阵挛及偶发性癫痫发作;腭裂Myoclonus and occasional epileptic seizures;cleft palate癫痫发作约4 周后死亡Epilepsy,lethality around 4 week腭裂;Angelman 综合征、Prader-Willi 综合征相关癫痫发作Cleft palate; Human Rearrangements of 15q11-q13 Angelman syndrome (AS) and Prader-Willi syndrome (PWS)-associated seizures全身癫痫伴热惊厥发作Generalized epilepsy with febrile seizures plus(GEFS+)Gad2谷氨酸脱羧酶-2 Glutamate decarboxylase-2敲除KO自发性癫痫(死亡率高)Spontaneous seizures,increased mortality-Glra1 甘氨酸受体, α1 Glycine receptor, α 1 Kcna1 电压门控K 通道Voltage gated K+ channel Kcnc2 电压门控K 通道Voltage gated K+ channel Kcnq2 电压门控K 通道Voltage gated K+ channel敲入KI敲除KO敲除KO有条件的显阴性的转基因Conditional dominant-negative Kcnq2 transgene癫痫发作约3 周死亡;惊跳病Seizures and lethality by 3 week; hyperekplexia成年后自发性癫痫Frequent spontaneous seizures through adult life自发性强直阵挛性发作Spontaneous tonicclonic convulsions自发性癫痫伴海马形态改变Spontaneous seizures,behavioral hyperactivity and morphologic changes in the hippocampus惊跳病Hyperekplexia强直阵挛及单纯部分性癫痫发作Tonic-clonic and simple partial seizures-良性家族性新生儿癫痫Benign familial neonatal convulsions (BFNC)Lgi1 Scn1a Scn1b富亮氨酸胶质瘤失活Inactivation of leucine rich glioma电压门控钠通道Voltage gated Na+ channel电压门控钠通道Voltage gated Na+ channel敲除KO敲除KO敲除KO自发性癫痫Spontaneous seizures自发性癫痫Spontaneous seizures自发全面性癫痫Spontaneous generalized seizures伴听觉特征的常染色体显性遗传癫痫Autosomal dominant epilepsy with auditory features Drave 氏综合征;全身癫痫伴热性惊厥DS; GEFS+全身癫痫伴热性惊厥GEFS+
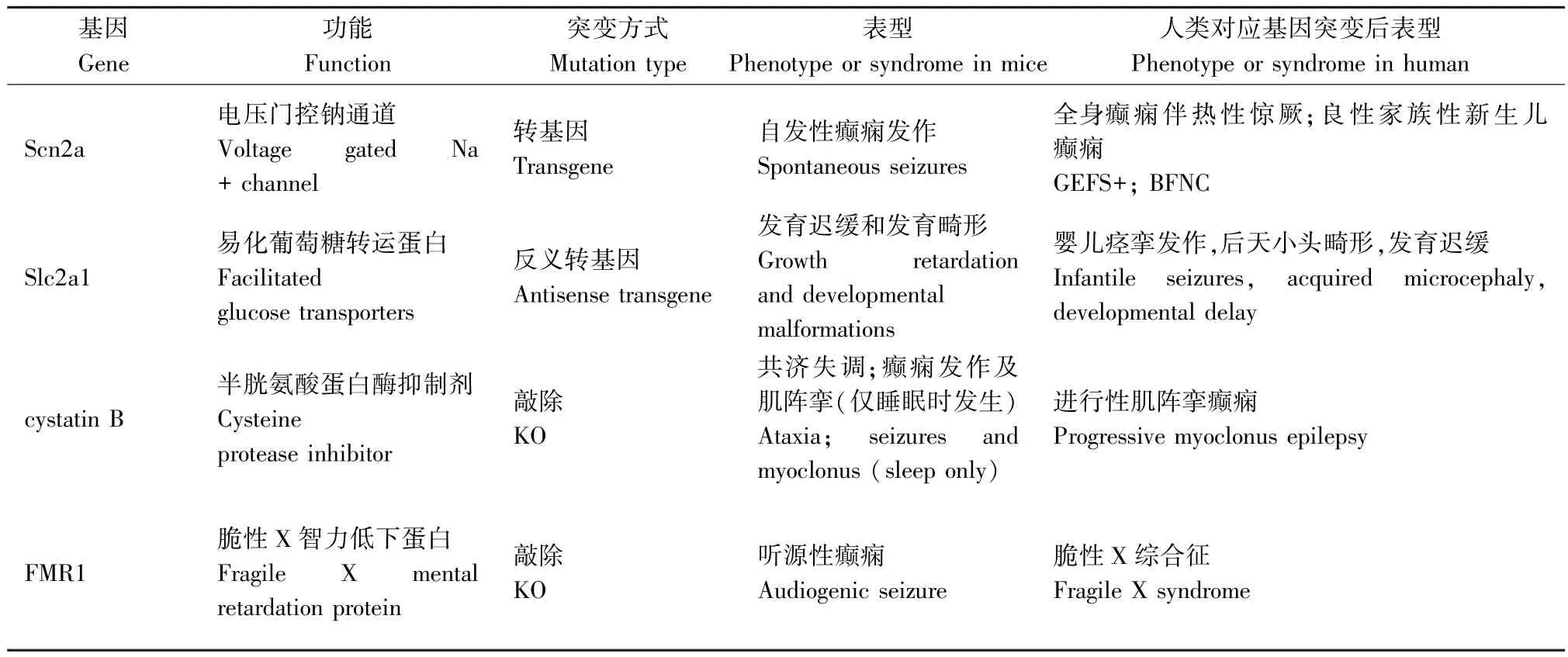
续表2
2 模拟特殊病因模型的行为学特征及优缺点
2.1 外伤
目前创伤后癫痫动物模型都是模仿创伤后晚期癫痫发作,即初始损伤后超过一周发生癫痫,主要用于探究创伤后癫痫发病机制、认知缺陷与细胞死亡、治疗等方面。流体冲击损伤是创伤后癫痫最广泛使用和研究最深入的模型,可模仿创伤性脑损伤相关的组织病理学,且在伤后1 年内表现出持续的神经运动和认知缺陷,但该模型缺乏对治疗药物有效性的预测;控制性皮质撞击可模仿急性硬膜下血肿、轴突损伤、血脑屏障功能障碍等,数周后癫痫易感性增加,表现为与颞叶癫痫相关的特征,但需要复杂的技术装置;加速冲击模型相对制造简单且造成损伤严重程度易控制,但再现可靠率低,死亡率高,不能产生自发性发作[62]。
2.2 微生物感染
虽然病毒、寄生虫等感染模型有炎症和神经元死亡、高兴奋性和行为性癫痫的证据,可用于相关脑炎治疗药物的检测,但因模型的高死亡率和癫痫活动的变异性,不适于AEDs 的检测。
2.3 脑肿瘤
癫痫发作频率和发生率与肿瘤的位置、病理特征和病变进展有关,故而了解肿瘤性癫痫的病因是准确有效治疗的前提。目前通常将鼠C6 胶质瘤细胞移植到稳定转染绿色荧光蛋白(GFP)基因的大鼠的皮质中进行造模,在组织学上类似于人类胶母细胞瘤的弥漫性侵袭性胶质瘤[17]。
2.4 脑卒中
脑卒中后痫性发作模型是确定发作关键步骤或途径并制定预防卒中后痫性发作干预策略的关键,目前尚无标准的动物模型,主要因为技术要求高、病变的大小和分布不一、死亡率高。近年来光血栓模型备受关注,其痫性发作发生在光血栓形成数周后,在海马区可发现苔藓状纤维,死亡率相对较低[63]。
3 展望
动物模型除了应用于探究癫痫机制及AEDs外,当代社会一些环境对癫痫患者发作的影响也值得探究制作相关的癫痫动物模型来进行研究。有研究发现在一次严重的空气污染事件中,癫痫的急救呼叫明显增加[64];居民暴露于道路交通噪声和空气污染与高热惊厥的风险增加有关[65];睡眠紊乱和低氧状态也可以导致航空飞行中癫痫发作[66];基础实验也有发现噪声暴露下的豚鼠神经递质GABA及下丘的电生理发生改变[67],提示噪声暴露会导致中枢听觉相关通路的损伤;妊娠期小鼠暴露在空气细颗粒物下不仅影响胚胎神经发育,而且通过干扰神经发生/胶质形成事件、髓鞘形成和突触发生,干扰小鼠出生后大脑的生长和成熟[68]。这些都提示一些特殊环境下的癫痫模型制备有重要的研究意义。
综上所述,在揭示癫痫发生的基本机制、确定药物治疗特定癫痫类型和预防癫痫发展的疗效等方面,这些动物模型发挥了关键的作用。但我们很难设计一个能概括癫痫所有特征的动物模型,而且目前的模型都不完美,故应意识到各种模型的局限性。但需要强调的是,动物模型应该是复杂系统的简单表示,模拟疾病的特定方面,而决不是试图复制具有人类疾病的所有复杂性。因此,无论何时使用动物模型,定义一个特定的问题并确保所选模型符合目的,根据目的制造和选择模型才是至关重要的。
