转化生长因子-β1、Clara 细胞分泌蛋白 16、Ⅱ型肺泡细胞表面抗原6 与支气管肺发育不良的相关性研究
2021-04-19贺成光朱筛成陈大业
贺成光朱筛成陈大业
(1.盐城市妇幼保健院 小儿胸心外科, 江苏盐城 224000; 2.盐城市妇幼保健院儿童心脏内科, 江苏 盐城 224000)
支气管肺发育不良( bronchopulmonary dysplasia, BPD)好发于早产儿中,该病是由因急性呼吸窘迫而进行较长时间的机械通气干预以及辅助氧疗导致的肺泡和肺内血管发育受阻的慢性呼吸系统疾病,其病死率较高,即使经治疗存活幼儿也极易承受反复呼吸到感染、肺动脉高压、哮喘、神经系统发育障碍、生长迟缓以及喂养困难等合并多种并发症,给患儿家庭以及社会带来沉重负担[1]。由于该病的病理机制较为复杂,尚未完全阐明,因此BPD 成为国际上新生儿科的一个巨大的挑战。研究表明[2]大量的肺泡上皮细胞的异常凋亡致使肺泡结构破坏是BPD 患儿肺损伤的基本病理改变。Zhang 等[3]研究表明抑制肺泡上皮细胞的凋亡能明显改善急性肺损伤大鼠的肺损伤病理。Shah 等[4]研究证实多种蛋白因子参与BPD 肺泡上皮细胞的细胞凋亡。杨敏等[5]研究发现BPD 患儿支气管灌洗液中转化生长因子β1 (transforming growth factorβ1, TGF-β1)、克拉拉细胞分泌蛋白 16(clara cell secretory protein, CC16)、肺泡Ⅱ型细胞表面抗原-6(krebs yon denlungen-6, KL-6)存在异常的现象,可能参与患儿肺损伤的修复以及上皮细胞的凋亡。但未阐明 TGF-β1、CC16、KL-6 的表达与肺组织细胞的凋亡的机制。本研究通过建立新生大鼠BPD 模型,通过动态监测其肺组织中 TGF-β1、CC16、KL-6的表达,以及肺组织细胞的凋亡情况,来探讨TGF-β1、CC16、KL-6 的表达对肺组织细胞凋亡的影响,从而为BPD 的临床研究提供实验数据支撑。
1 材料和方法
1.1 实验动物
SPF 级新生 SD 雄性大鼠,1 日龄,体重 6.35 ~9.05 g,共计48 只,由江苏神龙药业有限公司提供[SCXK(苏)2017-0007],饲养于扬州大学[SYXK(苏)2019-0024]。本研究中所有动物实验操作均在3R 原则的指导下给与动物人道主义关怀,本研究经本院实验动物管理伦理委员会审核批准(2020-079)。
1.2 主要试剂与仪器
TGF-β1、CC16、KL-6 抗体(德国 Rebstock 公司);兔抗大鼠磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH) 抗体(美国Santa公司);免疫组化试剂盒(南京建成生物有限公司);苏木精-伊红染色(hematoxylin-eosinstaining,HE)试剂盒(上海碧云天生物技术公司);脱氧核糖核苷酸末端转移酶介导的缺口末端标记(TdT-mediated dUTP nick labeling, TUNEL) 染色试剂盒(德国Roche 公司)。
LIOOS600T 生物显微镜(日本尼康公司);-80℃深冷冰箱(德国维根斯公司);Leica RM2135 组织切片机(德国Leica 公司);高速低温离心机(北京六一仪器厂);OM-25ME 数字测氧仪(美国OMEGA公司);LVEM5 低电压台式透射电镜(加拿大Delong America 公司)。
1.3 实验方法
1.3.1 BPD 模型构建和分组处理
按随机数字表法将新生鼠随机分为对照组、模型组,每组24 只。BPD 的造模方法[6]:将新生鼠置于自制的密封的玻璃氧箱中,温度在22℃~26℃,湿度在50%~60%,钠石灰平铺箱底以吸附CO2,平铺变色硅胶以吸收水分,以数字测氧仪控制氧气维持在80%~85%之间。模型组的氧箱每日定点开箱1 h,以更换钠石灰以及变色硅胶。对照组新生鼠置于空气中。所有新生鼠均由母鼠喂养,所有母鼠每日以干净水源、标准饲料喂养;为防止母鼠在高氧环境中中毒死亡,每日定时交换模型组和对照组母鼠。记录两组新生鼠的体重、进食、死亡情况。每组在 7 d,14 d,21 d 时(简称为 7 d 模型组、14 d 模型组、21 d 模型组)随机选出8 只新生鼠,诱导麻醉处死,留取血5 mL,打开胸腔无菌取出其肺部组织,置入深冷冰箱,待测。
1.3.2 ELISA 检测各组新生鼠的血清中TGF-β1、CC16、KL-6 的水平
采用ELISA 试剂盒检测各组新生鼠的血清中TGF-β1、CC16、KL-6 的水平,采用迈瑞全自动酶标仪MR-96 A 进行分析。
1.3.3 HE 染色观察各组新生大鼠肺组织病理学改变
取出各组20%第7、14、21 天处死的大鼠肺脏组织,采用10%的甲醛固定24 h 切片,HE 染色观察,光镜下观察病理改变。使用图像分析软件分析辐射状肺泡计数(radial alveolar count, ROC),肺泡平均截距(mean linear intercept, MLI)[7]。
1.3.4 电镜观察各组新生大鼠肺组织超微结构改变
取出10%第7、14、21 天处死的大鼠肺组织,制成超薄组织切片:采用2.5%聚甲醛预固定15 min,1%锇酸固定20 min,环氧树脂浸透包埋切片,醋酸双氧铀(uranyl acetate)及枸橼酸铅(lead citrate)染色,制成50 nm 切片,干燥后载与铜网上,电镜观察新生大鼠肺组织超微病理结构改变。
1.3.5 TUNEL 染色检测各组新生大鼠肺组织中的细胞凋亡
取出10%第7、14、21 天处死的大鼠肺组织,固定,冰冻切片,二甲苯浸洗,梯度乙醇浸洗,风干后3%双氧水-甲醇浸泡,清洗,依次采用0.1%TritonX-100,0.1%缓冲液浸泡,清洗后,加入TUNNEL 反应液,暗湿盒反应,漂洗,脱水,透明,封片,荧光显微镜进行观察。
1.3.6 免疫组化检测各组新生大鼠肺组织中TGF-β1、CC16、KL-6 的表达
取出20%第7、14、21 天处死的大鼠肺组织,10%多聚甲醛固定,石蜡包埋并切片,脱蜡,PBS 缓冲液修复。双氧水浸泡,室温下孵育,封闭,PBS 冲洗3 次,加入一抗(1∶500),4℃过夜孵育,次日冲洗干净,分别加入二抗(1∶500),室温孵育。显色,苏木素轻度复染,乙醇梯度脱水,二甲苯浸泡,中性树胶封片,镜检观察,在显微镜下目标蛋白被染成棕黄色颗粒[8]。
1.3.7 Western blot 检测各组新生大鼠肺组织中TGF-β1、CC16、KL-6 的表达水平
取出20%第7,14,21 天处死的大鼠肺组织,采用常规方法提取目标蛋白 TGF-β1、CC16、KL-6,经BCA 试剂盒测定蛋白浓度后,准确量取50 μg,电泳将蛋白分离,转膜,脱脂奶粉封闭,以(1 ∶1500)比例稀释后,维持4℃过夜孵育,次日,加入辣根过氧化物酶(horseradish peroxidase, HRP)标记的二抗,经显色,曝光、显影、定影后,以GAPDH 为内参来表示蛋白的表达水平。
1.4 统计学方法
数据统计采用SPSS 16.0 软件,作图工具采用Graphpad5.01,组间比较采用t检验,P<0.05 表示具有统计学意义。
2 结果
2.1 两组新生鼠一般情况比较
对照组新生鼠精神状态良好,断奶后能够自主进食,呼吸正常,皮毛浓密且富有光泽,未有死亡鼠出现,存活率100%,体重明显增加。模型组新生鼠精神状态不加,容易烦躁,反应速度较慢,进食较少,皮毛粗糙,暗淡,呼吸急促,体重增加量明显比对照组少(P<0.05),有新生鼠因高氧而死亡,存活率为(60.35±3.42)%,见图1。
2.2 两组新生鼠肺组织损伤病理学改变
HE 染色结果如图2 所示,正常组新生大鼠肺组织结构完整,细胞排列规整,未见充血、扩张、出血以及纤维增生现象,肺泡腔结构清晰,肺泡壁厚度均匀,无水肿、增宽、渗出等现象,随着日龄增长,肺泡大小趋向一致,肺泡间隔以及各级支气管管腔内均未内未发现水肿、炎性细胞浸润、分泌物渗出等现象。7 d 模型组新生大鼠肺组织纤维增生明显,间质水肿明显,肺泡腔明显变小,肺泡壁厚度不均一,间隔明显增宽,腔内出现炎性细胞填充;14 d模型组新生大鼠肺组织正常结构呈现实质性灶点破坏,肺泡腔内的炎性细胞明显增多,肺间隔进一步加宽;21 d 模型组新生大鼠肺组织灶点性实变增多,局部呈现片状病变,肺泡结构的损伤进一步加重,小肺泡数量锐减,肺间质内胶原沉积增多。两组大鼠的RAC 和MLI 比较如图3 所示,与正常组相比,模型组大鼠肺组织在7 d,14 d,21 d 的RAC 明显减少(P<0.05),MLI 明显增加(P<0.05)。
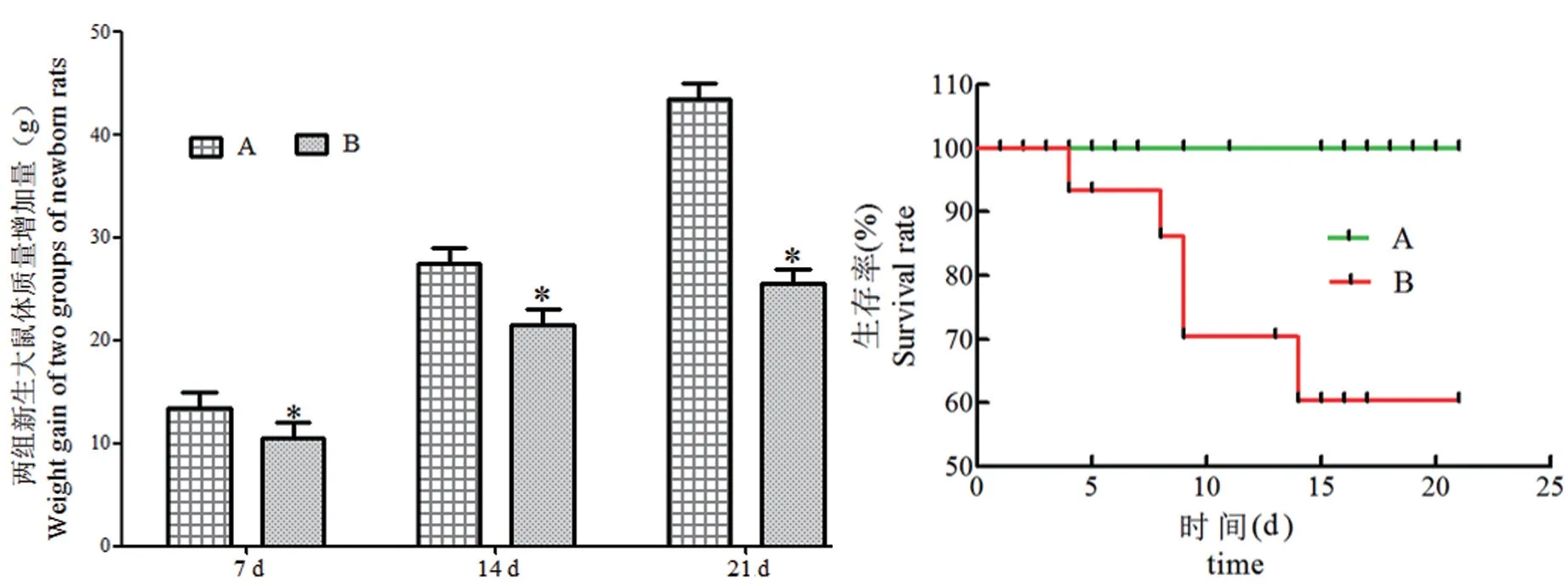
注:A:正常组;B:模型组。与正常组相比,∗P<0.05。图1 两组大鼠体重以及存活率比较Note.A, Normal group.B, Model group.Compared with normal group, ∗P<0.05.Figure 1 The comparison of body weight and survival rate of two groups of rats
2.3 两组新生鼠肺组织超微结构损伤改变
电镜观察结果如图4 所示,正常组新生大鼠肺组织上皮细胞形状规则,排列规整,Ⅱ型肺泡细胞板层小体清晰可辨,上皮细胞微绒毛结构规整,随着日龄的增加,成熟肺泡数量明显增多;7 d 模型组新生大鼠肺组织的板层小体出现排空,上皮细胞的微绒毛结构或缺失或破损;14 d 模型组新生大鼠的板层小体出已经基本排空,线粒体空泡样变性明显,嵴结构出现损伤;21 d 模型组新生大鼠的板层小体基本消失,上皮细胞微绒毛结构损伤更加严重,数量骤减,线粒体空泡样变性加剧,嵴结构明显减少,或缺损,或消失。
2.4 TUNEL 染色检测各组新生大鼠肺组织中的细胞凋亡
TUNEL 染色结果如图5 所示,与正常组相比,模型组新生大鼠肺组织的细胞凋亡率随日龄的增加明显增加(P<0.05)。
2.5 各组新生大鼠新生鼠的血清中 TGF-β1、CC16、KL-6 的水平
ELISA 检测结果如图6 所示,与正常组相比,模型组新生大鼠血清中TGF-β1、KL-6 的含量随日龄增加而明显增加(P<0.05),CC16 的含量随日龄增加而明显降低(P<0.05)。
2.6 免疫组化Western blot 检测各组新生大鼠肺组织中 TGF-β1、CC16、KL-6 的表达
免疫组化结果如图7 ~9 所示:与正常组相比,模型组大鼠肺组织TGF-β1、KL-6 的阳性细胞比例随日龄增加明显升高(P<0.05),CC16 的阳性细胞比例明显降低(P<0.05)。
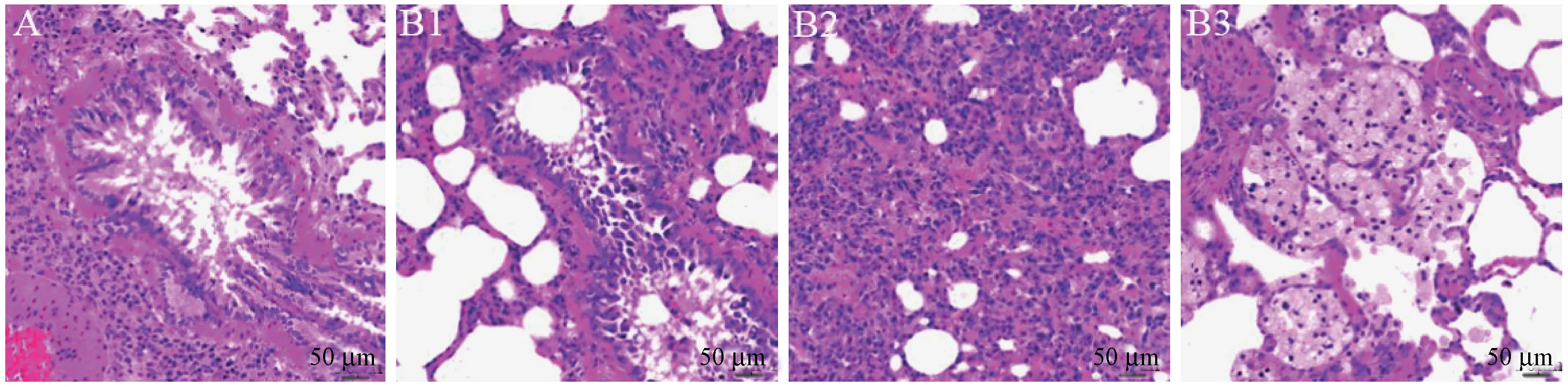
注:A:正常组;B1:7 d 模型组;B2:14 d 模型组;B3:21 d 模型组。图2 HE 染色结果Note.A, Normal group.B, Model group.B1, 7 d model group.B2, 14 d model group.B3, 21 d model group.Figure 2 The results of HE staining
2.7 Western blot 检测各组新生大鼠肺组织中TGF-β1、CC16、KL-6 的表达水平
Western blot 结果如图10 所示:与正常组相比,模型组大鼠肺组织TGF-β1、KL-6 的表达随日龄增加明显升高(P<0.05),CC16 的表达明显降低(P<0.05)。
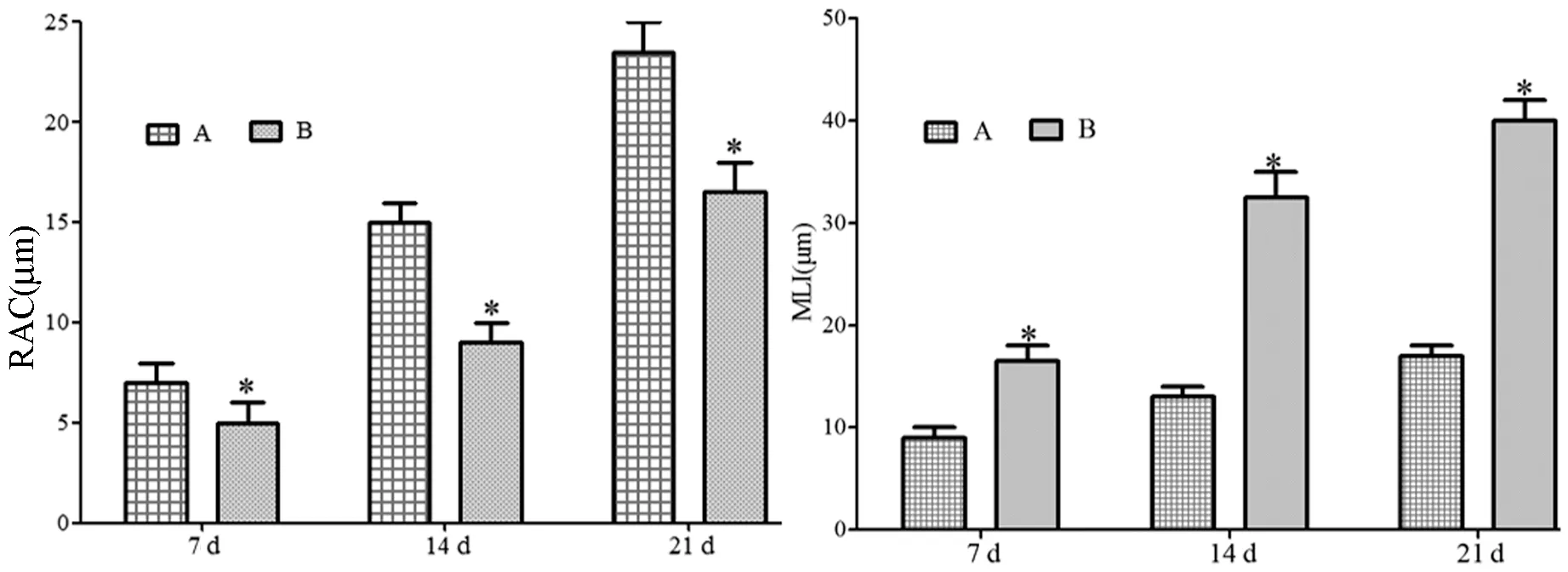
注:A:正常组;B1:7 d 模型组;B2:14 d 模型组;B3:21 d 模型组。与正常组相比,∗P<0.05。图3 P 两组新生大鼠RAC 和MLI 比较Note.A,Normal group.B,Model group.B1,7 d model group.B2,14 d model group.B3,21 d model group.Compared with normal group,∗P<0.05.Figure 3 The comparison of RAC and MLI of two groups of newborn rats
2.8 模型组肺组织中 TGF-β1、CC16、KL-6 的表达与其肺组织细胞凋亡率的相关性
模型组新生鼠肺组织中 TGF-β1、KL-6 的表达与肺组织的细胞凋亡率呈正相关(r=0.977、0.970,P均=0.000),CC16 的表达与细胞凋亡率呈现负相关(r=-0.982,P=0.000),见图11。
3 讨论
作为一种在低胎龄产儿中最常见的慢性肺部疾病,BPD 的主要临床病理[9]改变表现为肺泡数量减少,体积增加,肺泡次级间隔缩短等肺泡结构破坏致使肺泡和肺微血管发育障碍,肺功能异常。尽管近来的围生医学,氧疗技术,新生儿的管理技术的不断提高以及机械通气策略的改进,但是BPD 仍无根治性治疗措施,在新生儿中具有较高的致残率和致死率[10]。因此深入研究BPD 的发病机制,对临床上BPD 的治疗以及远期预后影响深远。
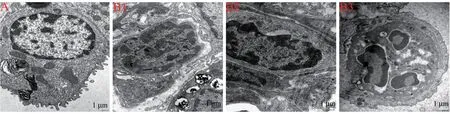
注:A:正常组;B1:7 d 模型组;B2:14 d 模型组;B3:21 d 模型组。图4 电镜观察结果Note.A, Normal group.B, Model group.B1, 7 d model group.B2, 14 d model group.B3, 21 d model group.Figure 4 The observation results under electron microscope
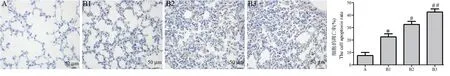
注:A:正常组;B1 ∶7 d 模型组;B2:14 d 模型组;B3:21 d 模型组。与正常组相比,∗P<0.05;与 7 d 模型组相比,#P<0.05;与 14 d 模型组相比,##P<0.05。下同。图5 TUNEL 染色结果Note.A, Normal group.B, Model group.B1, 7 d model group.B2, 14 d model group.B3, 21 d model group.Compared with the normal group,∗P<0.05.Compared with the 7 d model group, #P<0.05.Compared with the 14 d model group, ##P<0.05.The same as below.Figure 5 The results of TUNEL staining
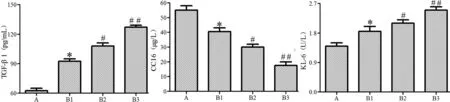
图6 各组新生大鼠血清中 TGF-β1、CC16、KL-6 的水平Figure 6 The levels of TGF-β1, CC16 and KL-6 in serum of newborn rats in each group

图7 免疫组化检测大鼠肺组织中TGF-β1 的表达Figure 7 Immunohistochemical detection of the expression of TGF-β1 in the lung tissues of rats
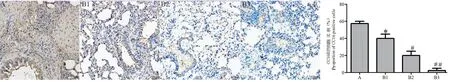
图8 免疫组化检测各组大鼠肺组织中CC16 的表达Figure 8 Immunohistochemical detection of the expression of CC16 in the lung tissues of rats
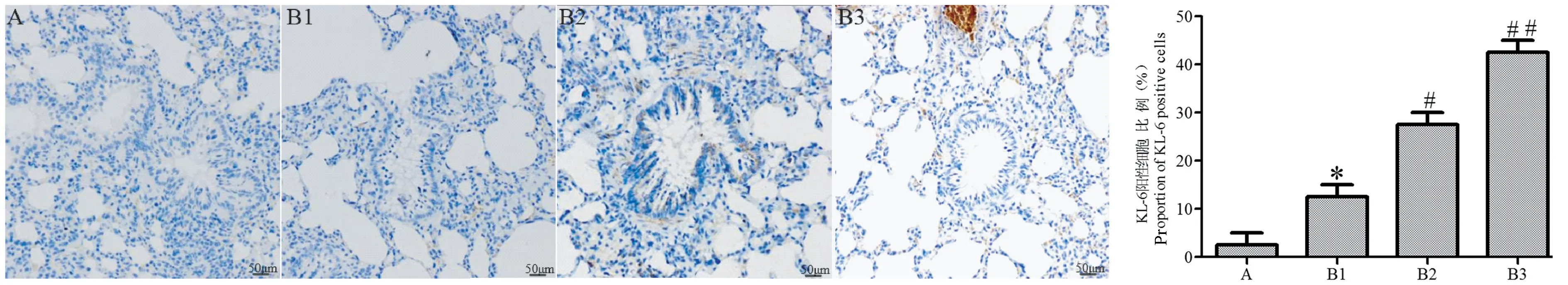
图9 免疫组化检测各组大鼠肺组织中KL-6 的表达Figure 9 Immunohistochemical detection of the expression of KL-6 in the lung tissues of rats
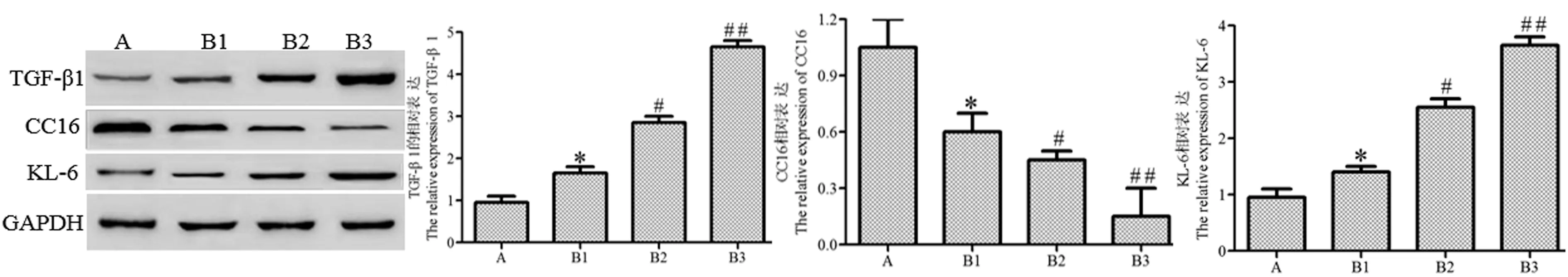
图10 Western blot 结果Figure 10 Results of Western blot
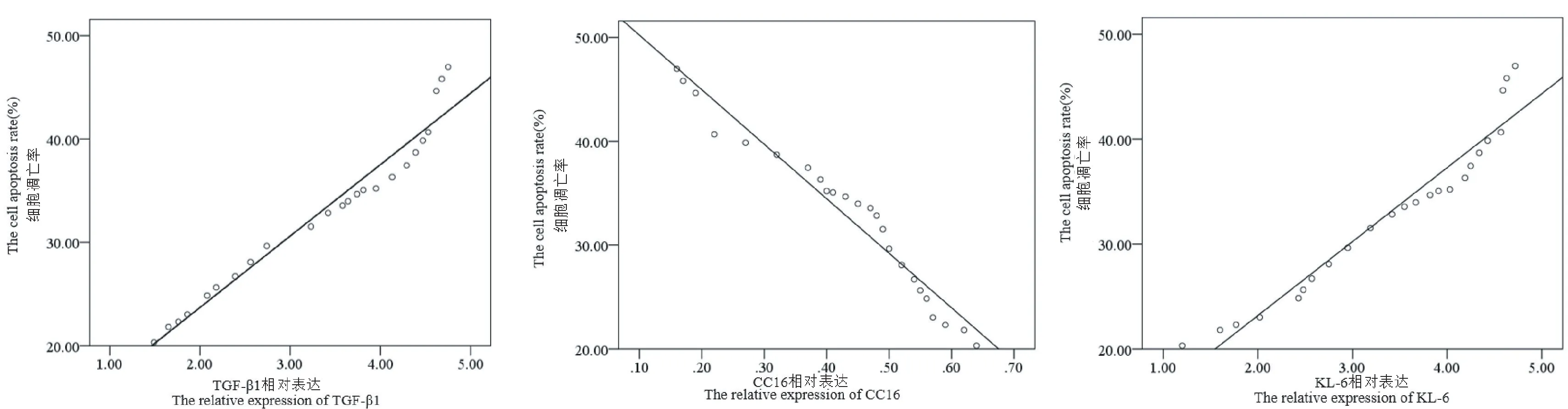
图11 模型组大鼠肺组织中TGF-β1、CC16、KL-6 的表达与肺组织的细胞凋亡率的相关性Figure 11 Correlation between the expression of TGF-β1, CC16, KL-6 in the lung tissue of the model group and the apoptosis rate of the lung tissue
高氧机械持续通气是危重早产儿抢救中的常用措施,但由于早产儿的肺泡和肺微血管的发育尚未完善,长时间的高氧暴露会产生高氧肺损伤,诱发BPD[11]。本研究通过高浓度氧暴露来建立新生大鼠BPD 模型,分别在7 d,14 d,21 d 处死新生鼠进行追踪观察。结果发现对照组健康生长,发育良好,未有死亡鼠出现,存活率100%。模型组新生鼠精神不振,发育迟缓,体重增加量不明显,有新生鼠因高氧而死亡,存活率仅有(60.35±3.42)%。RAC是反映哺乳动物终末呼吸时成熟肺泡的数量,是衡量肺发育成熟与否的重要指标;代表肺泡腔内径大小的MLI 是评价肺间质水肿程度的常用指标[12]。本研究中模型组的HE 病理显示和超微结构观察模型组新生鼠的肺组织损伤、肺部超微结构损伤程度随氧暴露时间的持续而逐渐加重。与正常组相比,模型组大鼠肺组织在7 d,14 d,21 d 的RAC 明显减少(P<0.05),MLI 明显增加(P<0.05),说明随氧暴露的时间的延长,模型组新生鼠的成熟肺泡的数量明显减少,出现肺发育不良的症状。
大量的动物实验研究显示[13]肺泡上皮细胞的异常凋亡是BPD 患儿肺泡数量减少的关键因素。Cai 等[14]研究证实抑制肺组织尤其是肺泡上皮细胞的凋亡,能够明显改善早产儿BPD 肺损伤病理,促进肺组织的发育。但是针对BPD 潜在的细胞凋亡机制尚不明确,国内外众多的研究学者致力于阐明BPD 的分子病理发生机制。TGF-β1 是多种器官包括肺、肝、肾等致纤维化的关键因子。研究显示[15]早产患儿肺组织中存在TGF-β1 过度表达的现象。Jin 等[16]研究显示异常表达的TGF-β1 促进新生大鼠肺组织肺泡上皮细胞的间质转化,增强成纤维细胞的趋化活性,加重新生大鼠肺组织的纤维化损伤。CC16 是细支气管粘膜上皮细胞分泌的具有抗炎、抗纤维化和免疫调节等生物活性的肺相关性蛋白。Lin 等[17]研究报道血清中CC16 的水平是评价哮喘、慢性阻塞性肺病以及肺感染等肺部疾病中肺-血屏障通透性,反映肺泡毛细血管损伤的重要指标。Guzmán-Bárcenas 等[18]报道 CC16 的表达可作为生物标志物,对BPD 的治疗以及远期预后具有潜在的价值。KL-6 是在在Ⅱ型肺泡上皮细胞中定位表达的炎性因子。Dilli 等[19]临床研究证实血浆中KL-6 的水平对于早产儿支气管肺发育不良的预测具有潜在的诊断价值。本研究中研究发现,模型组新生鼠肺组织的细胞凋亡率随氧暴露时间的延长而增加,血清中 TGF-β1、CC16、KL-6 的水平以及肺组织中 TGF-β1、CC16、KL-6 的表达随之升高。相关性分析显示模型组新生鼠肺组织中TGF-β1、KL-6的表达与肺组织的细胞凋亡率呈正相关(r=0.977、0.970,P均=0.000),CC16 的表达与细胞凋亡率呈现负相关(r=-0.982,P=0.000)。
综上所述,TGF-β1、CC16、KL-6 参与 BPD 肺组织的细胞凋亡。这为下一步开展BPD 的基因治疗提供了新的靶向位点,但是如何控制血清中TGF-β1、CC16、KL-6 的水平,以及如何针对 TGF-β1、CC16、KL-6 位点开展对BPD 的个体化治疗还需更深入的研究。
