miR-572 对胃癌细胞增殖和凋亡影响及其作用机制研究
2021-04-19阮庆芬杨德祥杨理伟
阮庆芬杨德祥杨理伟∗
(1.大理大学第一附属医院消化内科, 云南大理 671000; 2.大理州人民医院麻醉科, 云南 大理 671000)
胃癌是临床上常见的恶性肿瘤,其发展速度极快,严重影响人类生活质量[1]。胃癌作为一种消化系统恶性肿瘤,其分子发生机制较为复杂,基因异常表达是胃癌发生的重要原因[2]。miRNA 是在人体组织中广泛表达的非编码RNA,其具有多种生物学功能,在人体正常生命进程中发挥关键作用[3]。研究显示,miRNA 不仅参与正常生理过程,还与疾病的发生关系密切,miRNA 在疾病中异常表达往往与疾病的恶性转化有关[4]。很多研究发现,miRNA在肿瘤中的表达改变与肿瘤患者的临床病理特征有关,miRNA 还参与调控肿瘤细胞的生长和凋亡[5]。miR-572 是近些年来发现的与肿瘤有关的miRNA,miR-572 在卵巢癌等肿瘤中高表达,具有促进癌细胞增殖的作用,miR-572 在肿瘤中可能发挥类似癌基因的作用[6]。以前的研究显示,miR-572在胃癌组织中的表达水平显著升高,miR-572 可能参与胃癌进展[7]。含 WW 域的氧化还原酶(WW Domain-containing Oxidoreductase,WWOX)是一个在胃癌中表达下调的调控基因,上调其表达可以诱导胃癌细胞凋亡[8]。我们前期的预实验发现miR-572与WWOX可能互为靶向关系。本次实验旨在体外探讨miR-572 对胃癌细胞增殖、凋亡的影响和机制。
1 材料和方法
1.1 实验细胞
胃癌细胞 HGC-27、AGS、NCI-N87 购自上海复祥生物科技有限公司。
1.2 主要试剂
Lipofectamin 2000 ( 11668027 ) 购自美国invitrogen; B 细胞淋巴瘤/白血病- 2 (B cell lymphoma/lewkmia-2,Bcl-2)抗体(PAB16882)购自艾美捷科技有限公司;正常胃黏膜细胞GES-1 购自上海艾研生物科技有限公司;细胞周期依赖性蛋白激酶 4 (cyclin-dependent kinase 4, CDK4) 抗体(XY11026-1)、p21 抗体(xy-3316R)购自上海信裕生物工程有限公司;miScript Reverse Transcription Kit ( 218160)、 miScript SYBR Green PCR Kit(218073)购自德国Qiagen;Bcl-2 相关X 蛋白(Bcl-2 Associated X Protein, Bax)抗体(GD-H1122)购自上海古朵生物科技有限公司; miR-572 inhibitor、inhibitor control 由吉满生物科技(上海)有限公司构建合成。
1.3 实验方法
1.3.1 Real-time PCR 方法测定miR-572 在胃癌细胞和正常胃黏膜细胞中的表达水平
收集对数期的胃癌细胞HGC-27、AGS、NCI-N87和正常胃黏膜细胞GES-1,用TRIzol 提取总RNA,RNA 溶解在 DEPC 水中,然后放在-80℃保存。用miScript Reverse Transcription Kit 反转录合成cDNA,反 转 录 体 系 为: 1 μL 的 miScript Reverse Transcription Mix、4 μL 的 5×miScript RT Buffer、5 μL的 Total RNA,加 RNase-free Water 补足至 20 μL。cDNA 保存在-20℃。用 miScript SYBR Green PCR Kit 进行 PCR 反应,反应体系为:2 μL 的 10 ×miScript primer Assay、 2 μL 的 miScript Universal Primer、10 μL 的 2× Quantitect SYBR Green PCR Master mix、2 μL 的 Template cDNA,加 RNase-free Water 补足至 20 μL。PCR 反应条件为:95℃ 孵育15 min,95℃变性15 s,55℃条件下退火30 s,70℃条件下延伸 30 s,一共 40 个循环。用 2-△△Ct方法获得目的基因的相对表达水平。U6 为内参。
1.3.2 细胞转染和分组处理
取生长状态良好的胃癌细胞NCI-N87,接种到6孔板,接种密度为每孔2×105个,观察细胞密度为70%,进行细胞转染,细胞转染步骤完全按照Lipofectamin 2000 说明书进行,培养48 h 以后,用于后续实验。把转染 inhibitor control 和 miR-572 inhibitor 的胃癌细胞 NCI-N87 命名为 Anti-NC 和Anti-miR-572。把没有转染的细胞命名为Control。
1.3.3 MTT 方法测定下调miR-572 对细胞增殖影响
Control、Anti-NC、Anti-miR-572 组细胞以每孔5000 个细胞分别接种到96 孔板内,然后放在37℃的培养箱中培养48 h。取出培养板,在每个孔中分别加入MTT 溶液各20 μL,继续在37℃孵育 4 h。将培养板中的上清液弃掉,然后分别加入DMSO 溶液各150 μL,震荡反应10 min。将酶标仪波长调整为490 nm,检测每个孔的A 值。
1.3.4 PI 单染法测定下调miR-572 对细胞周期分布影响
取生长状态良好的 Control、Anti-NC、Anti-miR-572 组细胞,用0.25%的胰蛋白酶将细胞消化,配制成单细胞悬浮液,以冰预冷后的不含钙镁离子的PBS 溶液将细胞洗涤3 次。最后将细胞重新悬浮于PBS 溶液中。添加-20℃预冷的75%的乙醇溶液,放在4℃过夜反应。1062 r/min 离心10 min,吸弃上清。添加PI 染色液,置于4℃条件下避光反应20 min。以 488 nm 的激发波长、600 nm 的波长滤器用流式细胞仪分析细胞周期变化。
1.3.5 Annexin V-FITC/PI 双染法测定下调miR-572 对细胞凋亡影响
取生长状态良好的 Control、Anti-NC、Anti-miR-572 组细胞,以 PBS 溶液洗涤,然后收集 5×105个细胞,添加 400 μL 的 Binding Buffer 将细胞悬浮,加入5 μL 的 Annexin V-FITC 至细胞悬浮液中,混合均匀,然后放在4℃条件下避光反应15 min。加入PI染色液,继续在4℃条件下反应10 min。用流式细胞仪检测凋亡情况。
1.3.6 Western blot 方法测定下调miR-572 对细胞中 CDK4、p21、Bcl-2、Bax 蛋白表达影响
取生长状态良好的 Control、Anti-NC、Anti-miR-572 组细胞,提取细胞总蛋白,以BCA 蛋白定量测定试剂盒检测蛋白浓度。本次实验选用5%的浓缩胶和8%的分离胶进行电泳。蛋白样品中添加5×Loading Buffer 混合后,放在沸水浴中煮沸5 min。每个孔中添加40 μg 蛋白样品,浓缩胶中用80 V 电压电泳,分离胶中用120 V 电压电泳,用溴酚蓝作为指示剂,指示剂进入到凝胶的底部以后,停止电泳。将PVDF 膜剪成与分离胶大小一致,以甲醇预处理30 s,然后置于转膜缓冲液中浸泡30 min,以100 V电压转膜1 h。然后将PVDF 膜浸泡在5%脱脂奶粉溶液中孵育2 h。取出PVDF 膜,置于一抗、二抗反应液中充分结合,ECL 显色,用Image Quant version分析条带的A 值,以GAPDH 作为内参,分析目的蛋白表达变化。
1.3.7 miR-572 靶基因预测和鉴定
Targetscan 在线靶基因预测软件分析miR-572的靶基因,发现WWOX的 3′UTR 端与 miR-572 有互补结合位点。利用荧光素酶报告系统鉴定靶向关系,构建含有WWOX的3′UTR 结合位点的野生型(MUT)荧光素酶报告载体和不含WWOX的3′UTR结合位点的突变型(WT)荧光素酶报告载体,荧光素酶报告载体由南京科佰生物科技有限公司构建。将 MUT 和 WT 分别与 miR-572 inhibitor 和 inhibitor control 共转染到胃癌细胞NCI-N87 中,培养48 h 以后,用荧光素酶活性测定试剂盒检测荧光素酶活性。
1.3.8WWOXsiRNA 对下调miR-572 的细胞增殖、周期和凋亡逆转作用检测
在胃癌细胞NCI-N87 中分别共转染 miR-572 inhibitor、siRNA control 和 miR-572 inhibitor、WWOXsiRNA,并命名为 Anti-miR-572+si-NC、Anti-miR-572+si-WWOX,按照上述方法分别测定细胞增殖、周期、凋亡和 CDK4、p21、Bcl-2、Bax 蛋白表达。
1.4 统计学方法
实验数据用SPSS 21.0 统计学软件分析,数据按照平均数±标准差(±s)表示,两组数据间比较用t检验,多组差异比较用单因素方差,P<0.05 为差异有统计学意义。
2 结果
2.1 miR-572 在胃癌细胞和胃黏膜细胞中的表达差异
结果见表1, 胃癌细胞HGC-27、AGS、NCI-N87 中miR-572 表达水平高于正常胃黏膜细胞GES-1(P<05)。胃癌细胞 HGC-27、AGS 中 miR-572 表达水平低于胃癌细胞NCI-N87(P<05)。miR-572 在胃癌细胞中高表达,选用胃癌细胞NCI-N87 做后续实验。
2.2 miR-572 inhibitor 下调效果
结果见表2,胃癌细胞NCI-N87 转染miR-572 inhibitor 后,细胞中 miR-572 表达水平下降(P<0.05)。miR-572 inhibitor 下调胃癌细胞 NCI-N87 中miR-572 表达水平。
2.3 下调miR-572 对胃癌细胞增殖、周期和凋亡影响
结果见图1 和表3,胃癌细胞NCI-N87 转染miR-572 inhibitor 后,细胞A 值降低,G1 期细胞比例升高,细胞凋亡率升高,细胞中CDK4、Bcl-2 蛋白表达减少,p21、Bax 蛋白表达增多(P<0.05)。下调 miR-572 抑制胃癌细胞增殖,阻滞细胞周期,诱导细胞凋亡。
表1 胃癌细胞 HGC-27、AGS、NCI-N87 和正常胃黏膜细胞GES-1 中miR-572 表达水平( ±s)Table 1 Expression levels of mir-572 in hgc-27,AGS, NCI-N87 and GES-1 cells
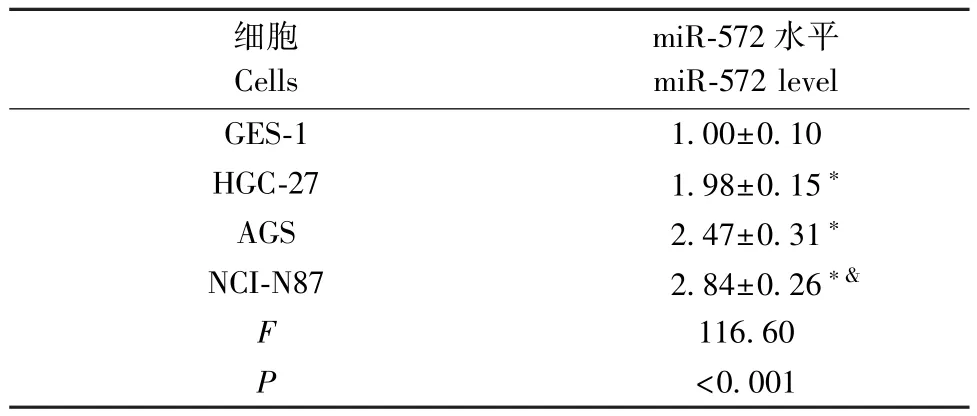
表1 胃癌细胞 HGC-27、AGS、NCI-N87 和正常胃黏膜细胞GES-1 中miR-572 表达水平( ±s)Table 1 Expression levels of mir-572 in hgc-27,AGS, NCI-N87 and GES-1 cells
注: 与 GES-1 细胞相比,∗ P<0.05; 与 HGC-27 和 AGS 细胞相比,&P<0.05。Note.Compared with GES-1 cells, ∗P<0.05.Compared with HGC-27 and AGS cells, &P<0.05.
细胞Cells miR-572 水平miR-572 level GES-1 1.00±0.10 HGC-27 1.98±0.15∗AGS 2.47±0.31∗NCI-N87 2.84±0.26∗&F 116.60 P<0.001
2.4 miR-572 和 WWOX 靶向关系鉴定
结果见图2 和表4,在线靶基因预测软件发现WWOX的3,UTR 端与 miR-572 有互补结合位点,并且 WT 和 miR-572 inhibitor 共转染后的细胞荧光素酶活性升高。miR-572 和WWOX互为靶向关系。
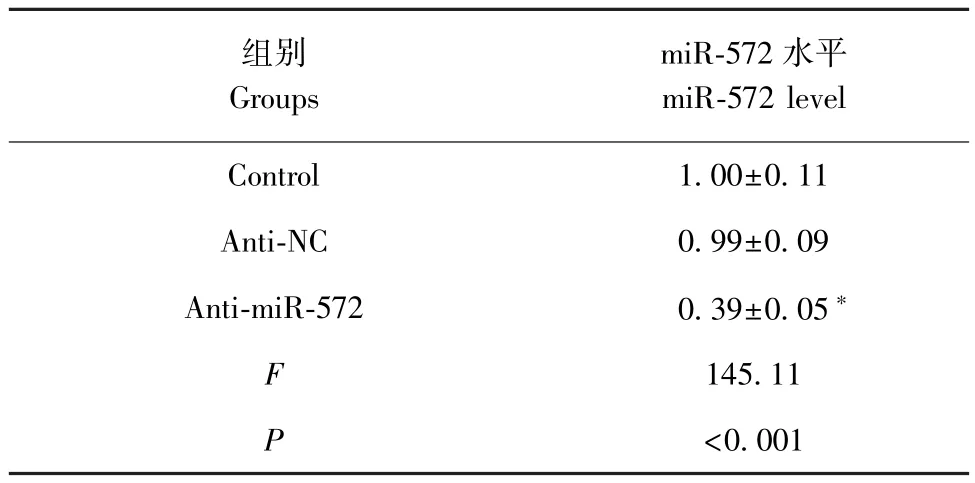
表2 miR-572 inhibitor 转染后胃癌细胞NCI-N87 中miR-572 表达水平( _x ± s)Table 2 Expression levels of mir-572 in NCI-N87 cells transfected with miR-572 inhibitor

注:A:流式细胞术测定细胞凋亡;B:Western blot 方法检测CDK4、p21、Bcl-2、Bax 蛋白表达。图1 下调 miR-572 对胃癌细胞 NCI-N87 凋亡以及 CDK4、p21、Bcl-2、Bax 蛋白表达影响Note.A, Flow cytometry determination of cell apoptosis in each group.B, Western blot determination of CDK4, p21, Bcl-2, Bax, WWOX protein expression in each group of cells.Figure 1 Down regulation of mir-572 induces apoptosis and expression of CDK4, p21, Bcl-2 and Bax proteins in gastric cancer cell line NCI-N87
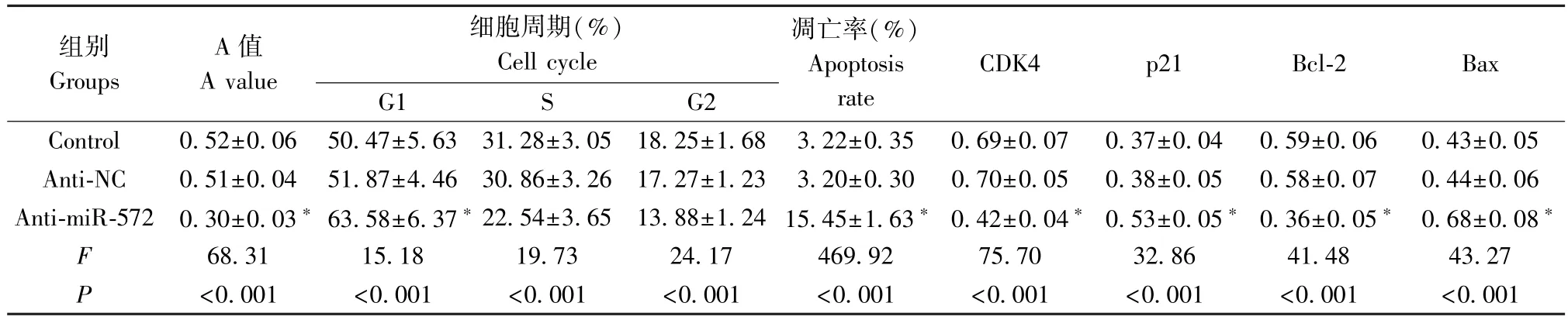
表3 miR-572 inhibitor 转染后胃癌细胞 NCI-N87 的 A 值、周期分布、凋亡率和 CDK4、p21、Bcl-2、Bax 蛋白水平( _x ± s)Table 3 A value, cycle distribution, apoptosis rate and CDK4, p21, Bcl-2, Bax protein levels (meansd) of NCI-N87 cells transfected with miR-572 inhibitor
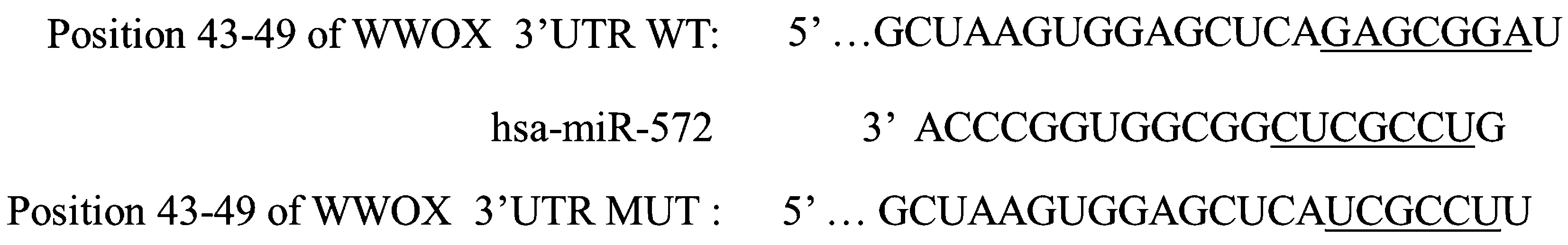
图2 WWOX 的 3′UTR 端与 miR-572 互补位点示意图Figure 2 Schematic diagram of 3′UTR and miR-572 complementary sites of WWOX
2.5 下调miR-572 对胃癌细胞中WWOX 蛋白表达影响
结果见图3 和表5,胃癌细胞 NCI-N87 转染miR-572 inhibitor 后,细胞中WWOX 蛋白表达水平升高(P<0.05)。下调 miR-572 促进胃癌细胞中WWOX 蛋白表达。
2.6 WWOX siRNA 对下调miR-572 影响胃癌细胞增殖、周期和凋亡的作用
结果见图4 和表6,与共转染miR-572 inhibitor、siRNA control 的细胞比较,共转染miR-572 inhibitor、WWOXsiRNA 后的胃癌细胞NCI-N87 的A 值升高,G1 期细胞比例降低,凋亡率也下降,细胞中CDK4、Bcl-2 蛋白表达增多,p21、Bax、WWOX 蛋白表达减少(P<0.05)。WWOXsiRNA 逆转下调 miR-572 对胃癌细胞增殖抑制、周期阻滞和凋亡诱导作用。
3 讨论
本次实验表明,miR-572 在胃癌细胞中的表达水平明显高于正常胃黏膜细胞,并且下调miR-572可以抑制胃癌细胞的增殖。miR-572 是一个在人体内广泛表达的miRNA,其参与老年痴呆、神经发育等过程[9]。miR-572 还与肿瘤有关,miR-572 在卵巢癌中表达上调,下调其表达可以抑制卵巢癌细胞恶性增殖[6]。在胃癌组织中的研究显示,miR-572 在胃癌患者中高表达,并且与胃癌患者的病理分期有关[7]。我们的实验结果与上述研究结果相符合,说明miR-572 在胃癌中高表达,下调miR-572 可以抑制肿瘤细胞的生长,这为研究miR-572 在胃癌进展中的作用奠定了基础。
胃癌细胞恶性增殖与细胞周期进程有关,细胞周期是生命进程中的基本生理过程,其是指上一次细胞分裂结束到下一次细胞分裂结束,包括DNA 的合成以及细胞分裂两个主要部分[10]。细胞周期有序进展受到一系列基因的调控作用,细胞周期调控因子有很多,其中细胞周期蛋白依赖性激酶是最为重要的调控蛋白,CDK4 是细胞周期蛋白依赖性激酶的成员之一,其在G1 期发挥重要作用,能够促进细胞周期进程[11-13]。CKI 基因是细胞周期蛋白依赖性激酶的抑制因子,P21 是一种CKI 基因,可以抑制细胞周期蛋白依赖性激酶复合物的生物学作用,其在细胞周期进展中发挥抑制作用[14-15]。Bax 和Bcl-2 均属于Bcl-2 蛋白家族成员,在细胞凋亡过程中发挥调节作用,Bax 是细胞凋亡的促进因子,Bcl-2是细胞凋亡的抑制因子[16-17]。本次实验表明,下调miR-572 后的胃癌细胞G1 期细胞比例升高,细胞凋亡增加,细胞中 CDK4、Bcl-2 蛋白表达水平下降,p21、Bax 蛋白表达水平升高,提示下调 miR-572 阻滞胃癌细胞周期进展并诱导胃癌细胞凋亡。
表4 WT 和MUT 转染后胃癌细胞NCI-N87荧光素酶活性( ±s)Table 4 luciferase activity of NCI-N87 gastric cancer cells transfected with WT and MUT
表4 WT 和MUT 转染后胃癌细胞NCI-N87荧光素酶活性( ±s)Table 4 luciferase activity of NCI-N87 gastric cancer cells transfected with WT and MUT
注: 与 Anti-NC 相比,∗P<0.05。Note.Compared with Anti-NC, ∗P<0.05.
组别Groups MUT WT Anti-NC 1.00±0.12 1.00±0.10 Anti-miR-572 1.01±0.13 2.75±0.26∗t 0.17 18.85 P 0.87 <0.001
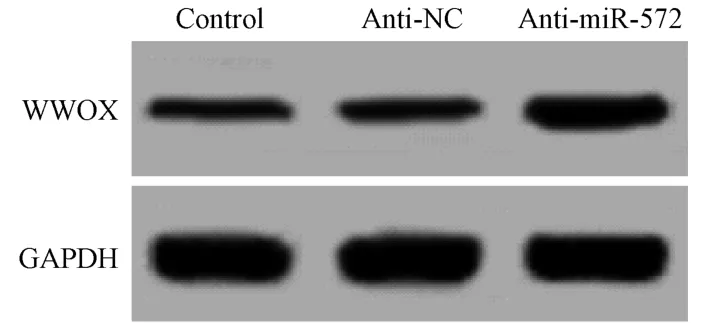
图3 Western blot 方法测定下调miR-572 对胃癌细胞NCI-N87 中WWOX 蛋白表达影响Figure 3 Expression of WWOX protein in gastric cancer cell line NCI-N87 was determined by Western blot
表5 miR-572 inhibitor 转染后胃癌细胞NCI-N87 中WWOX蛋白水平( ±s)Table 5 WWOX protein levels in gastric cancer cells NCI-N87 after miR-572 inhibitor transfection

表5 miR-572 inhibitor 转染后胃癌细胞NCI-N87 中WWOX蛋白水平( ±s)Table 5 WWOX protein levels in gastric cancer cells NCI-N87 after miR-572 inhibitor transfection
注: 与 Anti-NC 相比,∗P<0.05。Note.Compared with Anti-NC, ∗P<0.05.
组别Groups WWOX Control 0.39±0.07 Anti-NC 0.40±0.05 Anti-miR-572 0.65±0.06∗F 53.26 P<0.001
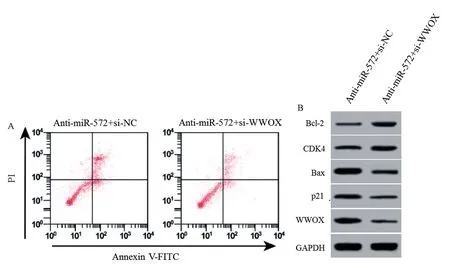
注:A:流式细胞术测定各组细胞凋亡情况;B:Western blot 测定各组细胞中CDK4、p21、Bcl-2、Bax、WWOX 蛋白表达。图4 WWOX siRNA 对下调 miR-572 的胃癌细胞凋亡和 CDK4、p21、Bcl-2、Bax、WWOX 蛋白表达影响Note.A, Flow cytometry determination of cell apoptosis in each group.B, Western blot determination of CDK4, p21, Bcl-2, Bax, WWOX protein expression in each group of cells.Figure 4 Effect of WWOX siRNA on down-regulation of miR-572 gastric cancer cell apoptosis and the expression of CDK4, p21, Bcl-2, Bax and WWOX protein
表6 WWOX siRNA 和miR-572 inhibitor 转染后胃癌细胞NCI-N87 的A 值、周期分布、凋亡率和 CDK4、p21、Bcl-2、Bax、WWOX 蛋白水平( _x ± s)Table 6 A value, cycle distribution, apoptosis rate and CDK4, p21, Bcl-2, Bax, WWOX protein levels of gastric cancer cells NCI-N87 after transfection with WWOX siRNA and miR-572 inhibitor
我们的实验还进一步发现下调miR-572 可以靶向负调控胃癌细胞中的WWOX基因。WWOX是在染色体普通脆性位点克隆得到的一个新基因,其编码的蛋白质由414 个氨基酸组成,WWOX 蛋白有两个WW 结构域和一个短链脱氢还原酶,参与肺间质纤维化等过程[18-20]。WWOX在肿瘤进展中发挥抑制作用,其是目前发现的抑癌基因[21-22]。WWOX在胃癌组织中表达下调,过表达WWOX可以抑制胃癌细胞增殖并诱导细胞凋亡发生[23]。本次实验证实,下调WWOX可以逆转下调miR-572 对胃癌细胞增殖、凋亡和细胞周期的作用,提示miR-572 作用机制与WWOX有关。
总而言之,miR-572 在胃癌细胞中高表达,下调miR-572 可以抑制胃癌细胞增殖,阻滞细胞周期,诱导细胞凋亡,其作用机制与靶向调控WWOX有关。以后会在多株胃癌细胞以及体内验证miR-572 的作用机制。本实验结果为研究miR-572 在胃癌进展中的作用提供了参考,为靶向治疗胃癌提供了新方向。
