中国胰瘘消化内镜诊治专家共识(2020,北京)
2021-04-19中华医学会消化内镜学分会中国医师协会内镜医师分会北京医学会消化内镜学分会
中华医学会消化内镜学分会,中国医师协会内镜医师分会, 北京医学会消化内镜学分会
1 引言
胰瘘是指各种原因引起的富含胰酶的液体在胰管上皮和其他上皮组织之间的异常交通所引起的一系列临床综合征[1-2]。胰瘘主要分为内瘘和外瘘。引起胰瘘的原因较多,主要包括胰腺外伤、胰腺及胰周外科手术、急慢性胰腺炎等。胰腺外伤时,胰瘘发生率为5%~30%[3]。胰腺外科手术常见的有胰十二指肠切除术、胰腺局部剜除术和远端胰腺切除术,前者胰瘘发生率为20%~25%,而后者发生率超过30%[3-4]。另外,非胰腺部位手术可能因病变侵犯胰腺或手术过程中误伤胰腺而导致胰瘘并发症。胰瘘往往引起病情迁延,住院时间延长;其临床表现多样,轻者可完全无症状,但约40%的胰瘘可进展为难治性胰瘘,并发腹腔脓肿、脓毒血症、大量出血等,严重者可危及生命[5]。
随着消化内镜操作技术的发展,内镜下胰瘘治疗不断突破,取得了较为满意的效果。内镜下胰瘘治疗具有创伤小、痊愈和住院时间短、医疗费用低、术后生活质量高等优势,在一定程度上部分替代了原来需要外科介入治疗的手术。消化内镜下胰瘘诊治尽管已历经近30年的发展[6],但目前国内外尚无胰瘘内镜下诊治的指南及专家共识。因此,中华医学会消化内镜学分会及中国医师协会内镜医师分会组织本专业领域权威专家,参考国内外相关研究报道,通过集体讨论与投票等方式,共同制定共识意见。
2 方法
本共识意见的具体制定采用改良Delphi程序。首先成立共识意见起草小组,然后进行系统的文献检索,文献检索中文数据库(中国知网数据库,万方中文期刊数据库)和英文数据库(Pubmed,Embase,Cochrane),关键词为:胰腺、瘘/漏、内镜、pancrea*、fistula/leakage/leak、endoscop*、endoscopic retrograde cholangio-pancreatography、endoscopic ultrasound。仅纳入中文和英文语言的相关研究,剔除会议摘要等不符合纳入条件的文献。随后,共识意见草案由相关专家委员会进行讨论后投票决议,最终达成共识。临床证据质量评估采用GRADE系统(表1),分为高、中、低及极低。投票意见按对共识同意程度分为五级:(1)完全同意;(2)部分同意;(3)视情况而定;(4)部分反对;(5)完全反对。表决意见(1)+(2)超过70%即达成共识意见。本共识从胰瘘的定义与病因、诊断、分型分级、适应证、预防性治疗及内镜下治疗六部分,共提出12条陈述建议(表2)。

表1 证据级别分类

表2 中国胰瘘内镜下诊治专家共识陈述汇总
3 胰瘘定义及病因
陈述1:胰瘘是指各种原因引起的富含胰酶的液体在胰管上皮和其他上皮组织之间的异常交通所引起的一系列临床综合征。 (证据质量:高,共识水平:94.74%)
目前胰瘘定义尚缺乏国际统一规范。胰瘘可分为内瘘和外瘘。内外瘘的区别主要在于胰瘘流出位置,向体内流出者称为内瘘,向体外流出者称为外瘘。胰瘘常与胰腺外科手术有关。2005年国际胰腺外科组织(international study group of pancreatic surgery,ISGPS)发布了术后胰瘘(postoperative pancreatic fistula, POPF)定义和分级系统,并在2016年进一步修订和更新[1,7]。根据其定义,POPF广义上是指富含胰酶的液体在胰管上皮和其他上皮组织之间的异常交通,诊断标准为:术后≥3 d腹腔引流管仍有液体流出,且其淀粉酶浓度高于血清淀粉酶3倍正常值上限。综上所述,胰瘘是指各种原因引起的富含胰酶的液体在胰管上皮和其他上皮组织之间的异常交通所引起的一系列临床综合征,异常交通主要是指胰管损伤后,胰液外漏至腹腔、相邻脏器或体外。
陈述2:胰瘘常见的病因主要为胰腺外伤、胰腺及胰周外科手术、急性坏死性胰腺炎等。(证据质量:中等,共识水平:100%)
胰腺外伤导致胰瘘机制主要有如下几种:首先,外伤可直接导致胰管断裂;其次,胰腺外伤导致胰管及壶腹部水肿,引起胰液引流不畅,更易形成胰瘘;再者清创不彻底及破裂胰管处理不及时可造成胰管破裂导致胰瘘形成。胰瘘是胰腺及胰周外科手术最常见的并发症之一。POPF发生的危险因素主要有:(1)年龄>65 岁;(2)胰管口径小;(3)胰腺质地较软;(4)术中失血过多;(5)术前黄疸;(6)手术时间过长[8-11]。非胰腺手术损伤胰腺也可导致胰瘘,最常见的是脾切除术、胃大部分切除术及胃癌根治术。急性坏死性胰腺炎由于胰腺自我消化坏死,侵蚀至胰管时可引起胰液外渗,导致胰瘘,急性坏死性胰腺炎时胰瘘发生率约20%[8,12-13]。
4 胰瘘的诊断
陈述3:ERCP及窦道造影是胰瘘诊断金标准。(证据质量:高,共识水平:97.37%)
目前胰瘘诊断的方法主要有CT、MRI、磁共振胰胆管造影(MRCP)、EUS、ERCP及窦道造影。ERCP及窦道造影显示胰管断裂,造影剂外漏可确诊胰瘘。ERCP不仅能够显示胰瘘位置、大小及流出道情况,还可进行治疗[14]。值得注意的是,当主胰管(main pancreatic duct,MPD)近端狭窄或有结石时,造影剂无法通过狭窄或阻塞段,ERCP诊断胰瘘的灵敏度可能会降低,此外ERCP作为有创操作,也具有一定的潜在出血、术后胰腺炎等风险。MRCP作为非侵入性检查,能够提供相对清晰的胆胰管图像,避免了诱发胰腺炎的风险,其胆胰管病变诊断价值接近ERCP,可作为高度怀疑的胰瘘的首选检查方式[15]。CT和MRI有助于明确胰腺炎严重程度、胰周积液特点等。瘘管造影可以显示瘘管的大小,位置、形态以及与胰管的关系。
陈述4:外科术后胰瘘的诊断标准为:术后≥3 d 后腹腔引流管仍有液体流出,且其淀粉酶浓度高于血清淀粉酶3倍正常值上限。(证据质量:中等,共识水平:97.37%)
POPF的诊断主要根据手术史、术后引流液的量及性质等。ISGPS发布的POPF诊断标准为:术后≥3 d 后腹腔引流管仍有液体流出,且其淀粉酶浓度高于血清淀粉酶3倍正常值上限[7]。引流液外观可为深棕色、绿色胆汁样,也可为奶白色、清水样等。POPF患者可表现为腹痛、发热、消化道梗阻等。
陈述5:急慢性胰腺炎相关胰瘘诊断标准为:(1)存在急性坏死性胰腺炎发作病史;(2)影像学支持胰瘘诊断。(证据质量:中等,共识水平:97.37%)
急性胰腺炎并发胰瘘的表现形式主要有急性液体积聚(<4周)、胰腺假性囊肿和包裹性坏死(walled-off necrosis,WON)(≥4周),以及胰肠/胆瘘等。胰腺炎相关胰瘘诊断应结合胰腺炎病史和影像学证据。急慢性胰腺炎的诊断参考国内指南[16-17],进而行MRCP、ERCP或囊腔内造影等进一步明确诊断。急慢性胰腺炎并发胰瘘,是导致胰周液体积聚(胰腺假性囊肿和WON)复发的重要危险因素[18]。
5 胰瘘分级分型
陈述6:胰瘘的分型建议根据胰瘘部位、开口方式及既往胰腺切除术式分型。外科术后分级建议采用ISGPS制定的2016版更新术后胰瘘POPF分级。(证据质量:低,共识水平:100%)
Mutignani等[19]根据胰瘘部位、开口方式及既往胰腺切除术式等提出一种基于内镜的分型标准将胰瘘分为3类:Ⅰ型胰瘘发生在胰腺实质损伤和小分支胰管或胰管远端渗漏后;Ⅱ型胰瘘主要发生在MPD;Ⅲ型胰瘘主要发生在胰腺手术后,多为胰管完全断裂。结合临床经验及国内胰瘘诊治现状,本共识对该分类方法进行了改进和完善(表3)。

表3 胰瘘内镜分型
2005年之前POPF定义相对混乱,不同研究之间缺乏规范。POPF分级由国际组织ISGPS制定,并于2016年进行修订,目前在国际上通用度高,临床使用范围广,是第一个广泛接受的胰瘘分级,并经过了临床反复验证[1,7,20]。根据胰瘘临床严重程度,ISGPS将POPF分为3级。生化瘘:不产生任何临床不良后果;B级:影响术后康复进程,需要临床治疗或介入干预,如合并感染、需要经皮或内镜下引流、需要输血或介入栓塞的出血等;C级:合并单/多器官功能衰竭,严重危及生命,多需要外科手术。其中,定义的A级胰瘘,是胰瘘前状态,2016 版更新不再将原2005版A级生化瘘诊断为胰瘘;而B级和C级,因为影响了临床治疗及进程,被称为临床相关胰瘘。POPF死亡率1%,而C级胰瘘死亡率高达25%[21]。2016年修订版胰瘘分级如下(表4)。
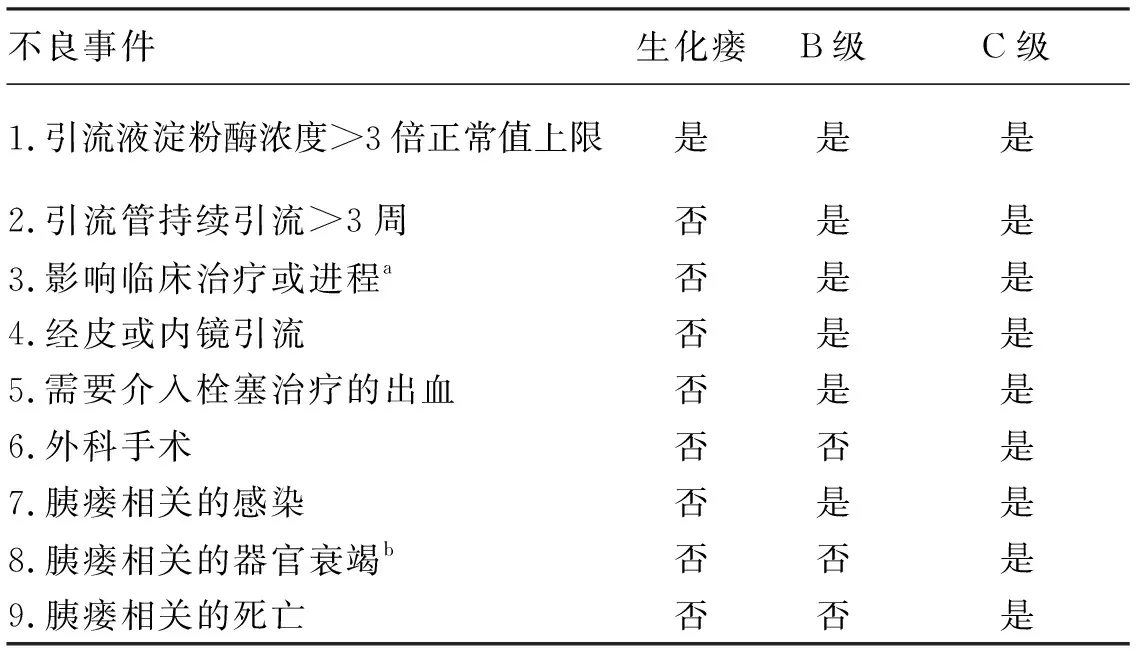
表4 POPF分级(2016年修订版)
另外,还有其他的分级标准。根据胰液的漏出量将胰外瘘分为高流量瘘(>200 ml/d)以及低流量瘘(<200 ml/d)[22]。国内也有分为大型瘘(>1000 ml/d),中型瘘(100~1000 ml/d)及小型瘘三型的分级方法(<100 ml/d)[23]。
6 内镜下治疗适应证
陈述7:内镜下胰瘘治疗主要用于有明显症状且保守治疗无效的患者。(证据质量:中等,共识水平:97.37%)
胰瘘治疗的目标是尽早实现胰瘘封闭,减少感染的风险,缩短住院时间,降低死亡率,减少住院费用。保守治疗除禁食、营养支持(鼻-肠管肠内营养或肠道外营养)、补液等一般治疗外,还可使用生长抑素及其类似物,来抑制胰液的分泌。约80%的外瘘和40%的内瘘保守治疗后,瘘口可自行闭合[24]。一般保守治疗2~4周未愈合的胰瘘应考虑内镜治疗。内镜治疗主要包括ERCP引导下胰管括约肌切开、支架置入及EUS引导下引流术等。外科治疗主要包括胰周坏死组织清创术、胰-肠/胃吻合术以及部分胰腺切除术等[25]。内镜治疗主要针对B级和C级胰瘘。
急性坏死性胰腺炎引起胰瘘时,原发病以及胰腺炎引起的并发症的治疗较胰瘘本身的治疗更为重要。急性坏死性胰腺炎可引起局部并发症和全身并发症。局部并发症包括胰腺假性囊肿和WON。全身并发症可导致低血压、休克、感染、心力衰竭、心肌损害、肺功能衰竭、肾功能衰竭、胰性脑病、电解质紊乱等。急性坏死性胰腺炎并发症发生率高,死亡率高;最首要的治疗为危及生命并发症的处理。
7 内镜下胰瘘预防性治疗
陈述8:不推荐常规内镜下处理来预防外科术后胰瘘的发生。(证据质量:低,共识水平:97.37%)
内镜下预防性治疗主要集中在ERCP胰管支架置入及封堵剂预防性封堵两方面。术后预防性使用生长抑素类似物[26]、富含精氨酸和不饱和脂肪酸-3的肠内营养、高渗盐水中度限制性液体疗法等内科保守疗法对POPF有一定预防作用[20]。
关于预防性ERCP胰管支架置入术预防术后胰瘘的研究,目前尚缺乏统一结论。几项小样本的研究认为术后胰管支架置入术可能是降低POPF形成风险的有效预防措施[27-30]。Rieder等[31]前瞻性非随机对照研究表明,胰管扩约肌切开+支架置入可减少外科胰腺远端切除术后胰瘘发生率(发生率:实验组0/25,对照组5/23)。一篇纳入4项研究共416例患者的Meta分析,显示胰腺外支架可降低术后胰瘘发病率[32]。然而,Moriya等[33]纳入553例胰十二指肠切除患者(支架组:n=449;无支架组:n=104),结果显示两组间胰瘘发生率并无差异,内支架放置并不能降低POPF发生率。Frozanpor等[34]通过一项纳入58例患者的RCT研究显示,外科切除术后支架组(n=29)和无支架组(n=29)胰瘘发病率并无差异,住院天数无差异。鉴于目前研究结果尚存争议,以及ERCP诱发胰腺炎的潜在风险,目前尚不推荐预防性ERCP胰管支架常规置入预防术后胰瘘。
目前胰瘘预防性封堵的封堵剂主要包括纤维蛋白胶和丙烯酸酯。Suzuki等[35]对52例外科胰腺切除术后患者进行RCT研究,分为纤维蛋白胶组(n=26)和无纤维蛋白胶组(n=26),发现术后预防性使用纤维蛋白胶有助于降低胰瘘发生率。然而后续前瞻性队列研究、RCT研究及Meta分析均对预防性封堵提出质疑[20,36-38]。一项Meta分析纳入7项关于纤维蛋白胶对胰腺部分切除术后胰瘘预防效果的RCT研究,共897例患者,显示虽然纤维蛋白胶封闭可减少术后出血的,但对POPF并无预防作用(OR=0.83, 95%CI:0.6~1.14)[38]。鉴于有限的研究证据,同样不推荐外科术后常规预防性使用封堵剂进行胰管封堵预防POPF。
8 内镜下胰瘘手术治疗
胰瘘治疗的关键是早期识别,以及预防威胁生命的并发症,例如出血和败血症等。内科治疗方式主要包括密切监视、营养支持、维持水电解质平衡、生长抑素类似物应用等。即使进行内镜及外科介入治疗,也不能忽略保守治疗的重要性。内镜介入治疗在胰瘘介入治疗中的作用越来越重要,一定程度上取代了部分外科手术[39]。内镜下手术主要分为ERCP相关手术和EUS相关手术。ERCP介入手术不适合于MPD完全断裂,胰十二指肠切除术后以及胰空肠吻合口术或者胃造瘘术后狭窄病例[40]。
8.1 ERCP引导下内镜手术
陈述9:对于与近端胰管相通的胰瘘,内镜下鼻胰管引流术、内镜下胰管支架置入术是内镜下常规治疗方式。(证据质量:中等,共识水平:94.74%)
内镜下鼻胰管引流术可以通过引流降低胰管压力,将胰液通过鼻胰管引流至体外,促进瘘管愈合。具备能自引流管注入造影剂以了解胰瘘愈合情况,又避免乳头切开而保留Oddi括约肌功能从而降低并发症的优势。但目前鼻胰管引流术相关研究样本量较小,多为个案报道及小样本研究[41-43]。Costamagna等[14]纳入16例保守治疗无效的胰瘘患者,行鼻胰管引流术,除4例ERCP下未能成功显示胰瘘病例外,12例均置管成功,除去1例术后24 h因严重脓毒血症并大面积肺栓塞死亡患者外,11例瘘管成功治愈。引流有效的指标为:(1)腹部瘘管引流液迅速减少或消失;(2)鼻胰引流管液体逐渐增多;(3)经鼻胰管造影显示由胰瘘外溢的造影剂显著减少或消失。拔管指征:(1)瘘管引流液每天<5 ml,引流液及淀粉酶含量连续3次均正常;(2)鼻胰引流管造影显示胰瘘完全消失;(3)先拔鼻胰管,至少观察1周后无胰瘘复发,再逐渐拔出腹部瘘口引流管[42]。如果导管出现堵塞,可以采取体外冲洗导管的方式解决。内镜下鼻胰管引流术可通过引流管注射造影剂进行检查,监测愈合情况,但患者舒适度较差,影响美观,且引流管易脱落。
内镜下胰管支架置入术通过十二指肠乳头放置胰管支架,将胰液引流入至十二指肠,减少胰液对瘘口刺激,促进瘘口愈合。其相对于内镜下鼻胰管引流术,避免了胰液流失。胰管支架置入术不仅可以治疗外瘘[14,44-45],同时也可用于内瘘的治疗[46],目前研究报道相对较多,临床应用较广泛。胰管支架置入术适合MPD损伤及狭窄患者,但对MPD完全断裂导致胰腺近端部分孤立者以及消化道改道不能行ERCP者并不适用。除去个案研究外[44,46-49],一些较大病例量的研究也证明了内镜下胰管支架置入术治疗胰瘘的有效性。Halttunen等[50]纳入33例胰腺炎胰瘘及17例POPF患者,行ERCP下介入治疗,其中43例行胰腺括约肌切开联合胰管支架植入患者中36例胰瘘愈合,手术有效率84%。刘博伟等[51]纳入42例急慢性胰腺炎、外伤、外科术后引起胰瘘患者,行支架置入总治愈率90.5%(38/42),同时发现不同病因、不同部位的胰瘘胰管支架置入治愈率无差别。除2例支架相关并发症及1例轻度胰腺炎外无其他并发症。一项对26例胰瘘患者进行鼻胰管引流、十二指肠括约肌切开及胰管支架植入的研究[52]显示,术后瘘管愈合率76%(20/26),且无严重并发症出现,但存在1例支架无法拔除病例。胰管支架置放时,应该越过胰管狭窄部位[53]。支架放置周期也可能与治疗成功与否相关[54]。一般而言支架放置时间为4~6周[40],时间过短可能导致引流不充分,瘘管未完全闭合[54];时间过长可能导致疼痛、感染、假性囊肿及与支架相关的胰管解剖结构改变[55-56]。
胰管括约肌切开术多与内镜下鼻胰管引流术、内镜下胰管支架置入术联合使用,也有单纯胰管括约肌切开术治疗POPF的报道[50,52,57]一篇纳入7例POPF行单纯括约肌切开治疗的研究显示,胰瘘治愈率71% (5/7)[50]。Cicek等[52]纳入26例胰瘘患者,其中3例仅行胰管括约肌切开术治疗瘘口均成功愈合。2009年,Goasguen等[57]纳入10例外科术后胰瘘患者行内镜下胰管括约肌切开术,其中5例放胰管支架,除去1例因支架移位复发,其余9例均痊愈。目前对于胰管括约肌切开术研究尚存在一些问题:括约肌切开本身可能带来出血、感染等额外风险。然而,部分病例中必须进行括约肌切开才能成功进入主胰管,若不进行括约肌切开,很难通过乳头放置8.5Fr以上支架。当无法放置支架时,通过胰管括约肌切开降低流出道压力一定程度上也可以起到放置支架的作用[40]。考虑到括约肌切开风险,Dumonceau等[58]认为最佳的内镜治疗方式为小支架置入,避免括约肌切开。然而小支架可能存在堵塞及引流不完全情况。
陈述10:内镜下常规治疗失败的胰瘘,可尝试行内镜下封堵剂封堵治疗。(证据质量:低,共识水平:92.11%)
目前关于内镜下封堵剂的研究多为个案研究及小样本研究。1990年,Bruckner等[59]首次提出ERCP下胰瘘生物蛋白胶封堵胰瘘,随后Engler等[60]报道1例急性胰腺炎胰瘘保守治疗无效患者进行反复3次纤维蛋白胶注射后瘘管痊愈。Fischer等[61]报道了8例外科术后胰瘘经皮引流14 d后,使用纤维蛋白胶封闭瘘管治疗。所有病例瘘管均愈合,未出现脓肿、瘘管复发或纤维蛋白胶相关并发症。2004年,Seewald等[62]报道了一种新型封堵剂-氰基丙烯酸酯,在胰腺引流的基础上采取丙烯酸酯进行封堵,12例患者中8例瘘口愈合,8例中仅1例需要2次注射。后续研究也进一步肯定了丙烯酸酯在胰瘘支架置入、鼻胰管引流、括约肌切开失败后的封堵效果[63-66]。丙烯酸酯相比于生物蛋白胶价格更便宜,并且可以与油性造影剂混合注射显影;再者丙烯酸酯一般注射1次即可,而生物蛋白胶相比而言需要注射次数较多[62]。封堵剂封堵主要适合于经常规ERCP治疗后瘘口仍未愈合的患者。封堵的前提是瘘管梗阻及狭窄已经解除,胰管的形态已基本建立。
8.2 EUS引导下胰周液体积聚(pancreatic fluid collections,PFCs)引流清创术
陈述11:EUS引导下支架引流术可作为胰瘘所致胰周积液积聚的一线治疗方式,必要时可行内镜直视下坏死组织清创术。(证据质量:中等,共识水平:97.37%)
虽然ERCP引导下手术对胰瘘治疗效果显著,但5%~10%患者由于外科术后结构改变、无法触及乳头或插管困难等原因使得ERCP实施困难[67]。ERCP引导下手术对胰管完全断裂效果欠佳。而EUS下手术克服了这些困难,成为胰瘘内镜下治疗的另一途径。EUS引导下手术方式可以分为经十二指肠乳头通路和不经乳头通路两种。经乳头通路会师需要联合ERCP进行,不经乳头通路可不联合ERCP,即经胃壁/十二指肠壁穿刺引流术,主要适用于胰瘘引起的胰腺假性囊肿、WON等PFCs。一项关于外科术后胰瘘EUS引导下引流、外科及经皮引流的回顾性多中心对比研究显示,无论POPF是否伴胰周液体积聚,EUS引导下引流瘘口愈合速度较外科及经皮引流更快[68]。由于EUS引导下胰瘘治疗相关研究较少,假性囊肿及WON一旦合并胰瘘,均应考虑内镜干预[69-70],本文主要论述胰瘘相关并发症假性囊肿和WON的EUS引流治疗。
假性囊肿及WON多发生在胰腺炎发作4周以后;而急性PFC多发生在4周内。PFC的内镜干预不应操之过急,应等待囊壁包裹完全形成之后进行,一般需至少4周[69,71]。研究[72]显示,与延迟干预相比,WON的早期干预与死亡率增加相关。一篇Meta分析纳入EUS引导下引流治疗PFC 2115例,平均手术成功率97%,临床有效率90%、复发率8%。并发症发生率17%,主要为出血、感染及支架移位[73]。由于假性囊肿和WON治疗预后差别较大,处理难度不同,此处分开论述。
急性胰腺炎患者中假性囊肿发生率为5%~15%,慢性胰腺炎中为20%~40%[74]。大部分假性囊肿保守治疗可吸收,根据美国胃肠内镜学会(American society for gastrointestinal endoscopy,ASGE)指南建议,EUS引流术治疗假性囊肿的适应证包括:(1)病变引起周围空腔脏器阻塞(胃、十二指肠和胆道阻塞);(2)假性囊肿伴发感染、出血及破裂;(3)囊肿进行性增长;(4)腹痛症状明显,出现病变压迫相关症状[74-75]。既往研究认为,假性囊肿病变直径>6 cm,且持续4~6周以上也是引流指证[76-77],胰瘘引起的假性囊肿是EUS引流的指证[70]。Varadarajulu等[78]进行了一项常规内镜引流和EUS引导下引流的RCT研究,显示EUS引导下引流手术成功率更高,应作为胰腺假性囊肿治疗的一线疗法。另一项内镜和EUS对比的RCT研究也得出了相同结论[79]。常规内镜引导下穿刺主要凭经验操作,EUS相较于常规内镜下引流,具备可准确定位囊腔,确定最佳穿刺点,避开重要脏器和大血管,直视下完成穿刺及支架置入过程的优势,可减少穿孔、出血等并发症,安全性更高。一项外科囊肿胃吻合术与EUS引流治疗胰腺假性囊肿对比的RCT研究显示,内镜引流和外科治疗疗效相当,然而内镜引流具有住院时间短及住院费用低的优势[80]。一项纳入22篇研究830个病变的Meta分析显示,EUS引导下假性囊肿引流技术成功率为94.0%(95%CI:0.920~0.956),治疗成功率为86.2%(95%CI:0.824~0.893),并发症发生率为15.7%(95%CI:0.121~0.201),复发率为8.5%(95%CI:0.062~0.116)[81]。关于内镜下引流时机选择,持续6周以上病变引流效果较好[82-84]。当患者由于囊肿感染等出现无法控制的症状,例如腹痛或高烧时,则需要紧急行囊肿引流[85]。EUS引导下引流要求假性囊肿与胃壁或十二指肠壁之间的距离≤1 cm。
WON与假性囊肿的主要区别是WON囊腔内以大量固体坏死物及部分液体为主,假性囊肿则以囊内液体为主。WON由于坏死物质较多,实性成分较假性囊肿多,处理较假性囊肿棘手。一项多中心研究[86]纳入11例WON患者,经EUS引导下支架引流后10例病变缩小超过50%。沈永华等[70]纳入103例PFC患者,其中假性囊肿67例,WON 36例;101例(98.1%)穿刺成功,仅14例(13.6%)出现支架移位和术后感染并发症。Walter等[87]前瞻性多中心纳入61例患者(46例WON,15例假性囊肿),支架置入成功率 98%(60/61),WON临床缓解率81%,所有患者中并发症发生率仅9%。Bekkali等[88]回顾性分析72例WON经内镜下支架引流者,手术成率93.5%。Meta分析显示,WON支架置入成功率84%~92%[89]。WON合并胰瘘引流治疗复发率高,应适当延长支架放置时间[90]。对于WON的治疗,若坏死组织较多,单纯引流效果欠佳,可考虑内镜直视下坏死组织清创术,临床缓解率75%~90%[91]。亚洲WON处理专家共识认为内镜下WON治疗相比于外科手术具备更高的安全性,EUS引导下管腔引流手术成功率高,坏死组织清创术后无需额外的鼻-囊肿引流[18]。
陈述12:EUS引导下引流术的支架选择(塑料/金属)目前尚存争议,但对于合并坏死的胰周液体积聚,更倾向于新型两端膨大式金属支架。(证据质量:中等,共识水平:100%)
EUS引导下引流术主要方式为支架置入,目前常用的支架主要有2种:塑料支架(plastic stent,PS)及自膨式金属覆膜支架。常用的双猪尾塑料支架具有移位率低、易拔出及价格低廉的优势,但由于管径较小,支架堵塞、感染等不良反应发生率较高。相比与塑料支架,金属支架管径较大,引流通畅,支架不易堵塞。既往常用的金属支架为直线型自膨式金属支架(self-expanding metal stents, SEMS),SEMS由于移位率高,且RCT研究及Meta分析结果并不支持SEMS对PFC效果优于PS[92-93]。近年来更倾向于使用两端膨大式自膨式金属支架,例如双蘑菇头金属支架(lumen-apposing metal stents,LAMS)。LAMS对SEMS两端进行双蘑菇头改进,降低了支架移位概率。由于LAMS内径较粗(≥10 mm),可进入病变内部行内镜下直视观察,减少了造影的必要性,且必要时可行内镜直视下坏死组织清创术。
EUS引导下PS置入治疗假性囊肿有效率90%以上,LAMS置入有效率接近100%,两种支架均可达到明显疗效[7]。Bang等[94]纳入60例WON患者随机分配行LAMS或PS治疗,结果显示虽然LAMS操作时间较短,但其并发症发生率及花费均较PS高,且手术成功率及临床缓解率相当,并未显示明显优势。一篇纳入9篇(737例)WON行LAMS研究及6篇(527例)WON行PS研究的Meta分析显示,LAMS临床成功率88.5% (95%CI: 82.5~92.6) ,与PS( 88.1%,95%CI: 80.5~93.0)并无统计学差异。LAMS并发症发生率 11.2%,与PS并发症发生率(15.9%)相似[95]。然而该Meta分析并非均为RCT研究,对比方法存在一定局限性。另一篇Meta分析却得出了不同的结论[96]。该Meta分析纳入11项研究,共688例PFC患者,LAMS手术成功率98%,临床缓解率93%,假性囊肿与WON临床缓解率并无统计学差异,然而WON并发症发生率较假性囊肿高10%。该Meta分析纳入6篇对比LAMS和PS研究,显示LAMS临床成功率明显较PS高,且并发症较PS少,在PFC处理上具有优势。
虽然目前关于支架对比研究文章结论存在争议,但一般而言,支架类型及数目选择多根据囊肿及囊液性质等确定。若囊液较稀薄可选择PS,若囊液较稠厚可选用置入多根塑料支架或一根金属支架,若坏死物较多,应选用金属支架。假性囊肿治疗上PS和LAMS均可获得明显效果,两者临床缓解率差异不大。WON内坏死物较多,由于PS直径较细,易堵塞支架,导致引流不畅、感染等。金属支架内镜较粗,不仅可以起到引流作用,还可为内镜直视下清创术提供通道,因此当坏死物较多时可考虑金属支架[71,97-98],最新美国AGA指南也认为对于金属支架胰腺坏死的处理上优于塑料支架[69]。关于支架拔除时间,欧洲胃肠内镜学会强烈建议LAMS放置时间不应超过4周[99]。
9 结语
内镜下胰瘘治疗发展迅速,已经逐步取代外科成为胰瘘治疗的首选方法,国内外研究均已证明其有效性及安全性。然而国内相关研究仍相对有限,可能由于胰瘘内镜下处理对操作者水平技术要求较高以及内外科联系欠缺,一部分POPF患者并未转入内科治疗有关。国外研究虽然较多,然而样本量一般不大,且不同研究之间结论一致性有限,如胰腺术后是否需要预防性支架置入预防胰瘘。由于内镜下治疗选择方式较多,不同内镜下治疗方式最佳适应证尚不明确,不同内镜手术方式之间的对比研究仍欠缺。随着内镜下治疗器械的发展和内镜下诊治技术的推广,在胰瘘治疗中的作用将愈加重要。
执笔:柴宁莉 杜晨 翟亚奇 李惠凯 汤小伟
审校:令狐恩强
单位:解放军总医院第一医学中心消化内科
专家组成员名单(按姓氏拼音排序):
包郁(四川省肿瘤医院)、柴宁莉(解放军总医院第一医学中心)、范志宁(南京医科大学第一附属医院〔江苏省人民医院〕)、冯志杰(河北医科大学第二医院)、戈之铮(上海交通大学医学院附属仁济医院)、郭学刚(空军军医大学西京医院)、何朝晖(遵义医科大学第五附属〔珠海〕医院)、贺德志(郑州大学一附院)、胡冰(东方肝胆外科医院)、胡兵(四川大学华西医院)、黄永辉(北京大学第三医院)、霍继荣(中南大学湘雅二医院)、冀明(首都医科大学附属北京友谊医院)、姜慧卿(河北医科大学第二医院)、金震东(上海长海医院)、李文(天津市人民医院)、李修岭(河南省人民医院)、李汛(兰州大学第一医院)、李延青(山东大学齐鲁医院)、李兆申(上海长海医院)、令狐恩强(解放军总医院第一医学中心)、刘德良(中南大学湘雅二医院)、刘海峰(解放军总医院第三医学中心)、刘俊(华中科技大学同济医学院附属协和医院)、刘小伟(中南大学湘雅医院)、吕富靖(首都医科大学附属北京友谊医院)、马颖才(青海省人民医院)、梅俏(安徽医科大学第一附属医院)、聂占国(新疆军区总医院)、潘阳林(空军军医大学西京消化病医院)、彭贵勇(陆军军医大学第一附属医院)、沙卫红(广东省人民医院)、盛剑秋(解放军总医院第七医学中心)、孙明军(中国医科大学附属第一医院)、孙思予(中国医科大学附属盛京医院)、覃山羽(广西医科大学第一附属医院)、唐秀芬(黑龙江省医院)、王邦茂(天津医科大学总医院)、王韶峰(山西省长治市人民医院)、王晓艳(湘雅三医院)、韦红(海南省人民医院)、徐红(吉林大学第一医院)、许国强(浙江大学医学院附属第一医院)、许树长(上海市同济医院〔同济大学附属同济医院〕)、杨爱明(北京协和医院)、杨少奇(宁夏医科大学总医院)、姚方(中国医学科学院肿瘤医院)、于红刚(武汉大学人民医院)、赵贵君(内蒙古自治区人民医院)、周平红(复旦大学附属中山医院)、邹晓平(南京大学医学院附属鼓楼医院)、智发朝(南方医科大学南方医院)、钟良(复旦大学附属华山医院)

参考文献见二维码
引证本文:Chinese Society of Endoscopy, Chinese Medical Association; Endoscopic Physician Branch of Chinese Medical Doctor Association; Beijing Society of Digestive Endoscopy, Beijing Medical Association. Chinese expert consensus on the endoscopic diagnosis and treatment of pancreatic fistula (2020, Beijing)[J]. J Clin Hepatol, 2021, 37(4): 803-808. (in Chinese)
中华医学会消化内镜学分会, 中国医师协会内镜医师分会,北京医学会消化内镜学分会. 中国胰瘘消化内镜诊治专家共识(2020,北京)[J]. 临床肝胆病杂志, 2021, 37(4): 803-808.
