肝包虫病影像学诊断专家共识
2021-04-19中华医学会放射学分会传染病学组中国医师协会放射医师分会感染影像专业委员会
中华医学会放射学分会传染病学组, 中国医师协会放射医师分会感染影像专业委员会
包虫病是呈全球性分布的人畜共患性疾病,目前全球约有400万人感染肝包虫,另外有6000万人处于感染风险中,严重危害全世界公共卫生安全和经济发展。我国西北部是全球范围内的高发地区之一,人群患病率为0.5%~5.0%。在过去的20年里,我国新增包虫病5000余例[1-3],给患者及其家庭带来极大的痛苦和沉重的经济负担,是导致我国西部农牧区群众因病致贫、因病返贫的主要原因之一。包虫病可发生于全身各个脏器,以肝脏居多,其次为肺脏,发生于其他脏器相对少见,手术是根治包虫病的主要方法[4]。包虫病起病隐匿,因病灶大小和所在部位不同出现相应的临床症状,症状无特异性。流行区生活史只能作为诊断线索之一,血清学检查结果有一定帮助,但存在假阴性和假阳性,所以影像学检查是诊断包虫病的重要方法[5]。近年来,随着影像技术的快速发展,为诊断肝包虫病提供了多种新的指标,在肝包虫病的早期诊断、术前评价及疗效监测方面发挥着至关重要的作用,使肝包虫病影像学诊断达到了一个崭新的水平。在此背景下,为了推动我国肝包虫病诊断与治疗工作规范、有效、安全的开展和推广应用,结合循证医学对指南及标准的方法学要求,由首都医科大学附属北京佑安医院和新疆医科大学第一附属医院联合多家医院的感染与炎症放射学专业委员会专家共同参与书写及制定肝包虫病的影像学诊断共识。
本共识基于当前最新研究证据,综合考虑临床实际及专科医师经验,形成最终的影像学诊断推荐意见,以期为临床医师提供明确的诊断依据及更丰富、准确的诊断信息,形成最佳决策方案,有效提升早期诊断水平,指导肝包虫病的临床合理用药和综合治疗。
1 适用范围
本共识包括肝包虫病的影像学诊断意见、临床诊断流程、鉴别诊断和相关推荐影像检查技术,给出了影像学诊断标准的影像特征支持依据和图像采集要求。本共识适用于全国各级医疗机构和疾病预防控制机构对肝包虫病的诊断。
2 术语及定义
包虫病又称为棘球蚴病(echinococcosis),是由棘球绦虫的幼虫寄生于哺乳动物体内所致的一种人畜共患疾病[5]。目前感染人体的包虫病主要分为囊型包虫病(cystic echinococcosis,CE)和泡型包虫病(alveolar echinococcosis,AE)两种类型,分别由带绦虫科棘球绦虫属的两种绦虫即细粒棘球绦虫(echinococcus granulosus)和多房棘球绦虫(echinococcus multilocularis)所致[6]。包虫病主要发生于肝脏,其中,65%~80%的CE灶发生在肝脏,而AE灶则高达98%发生在肝脏[7-8]。
3 诊断依据
3.1 流行病学史 有流行区的居住、工作、旅游或狩猎史;有犬、牛、羊等家养动物或有狐、狼等野生动物及其皮毛接触史;有从事来自流行地区的家畜运输、宰杀、畜产品和皮毛产品加工等接触史[7-8]。
3.2 临床表现 早期病灶较小时多无临床症状,当病灶较大(>10 cm)时可对周围脏器和脉管系统产生相应的压迫症状,如腹胀和隐痛;包虫病灶压迫、侵蚀或破入胆道引起梗阻性黄疸;CE囊肿破裂入腹腔时,可出现类似消化道穿孔的表现,如剧烈腹痛,可伴有发热、荨麻疹以及过敏性休克等;合并感染后可出现酷似肝脓肿的症状和体征[7],严重时可因肝功能衰竭、胆系感染以及肺、脑等器官转移而致死[7,9-10]。
3.3 实验室检查 常规的免疫学实验方法都可以用于人体包虫病的免疫学检测,但目前血清学检测已经不再作为地区性大规模筛查的首选诊断方法,更多的是对影像结果的确认[7]。
现有的包虫病免疫学实验方法在灵敏度和特异度上存在很大的差异。实验结果受许多因素的影响:抗原的性质和质量;检测用的实验系统;棘球蚴的大小、数量、部位和活力;不同地域的虫株差异;个体免疫应答反应的差异等。国内外普遍应用的主要方法为[11-14]:(1)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测;(2) 间接红细胞凝集实验检测;(3)点免疫胶体金渗滤法检测;(4)免疫印迹技术检测;(5)包虫病DNA检测。其中,ELISA已广泛用于AE的临床诊断[15],其灵敏度和特异度超过90%。而由4种抗原组合制成的胶体金快速诊断试剂盒具有便携、实时鉴别两型包虫病的优势,目前广泛用于协助流行病学筛查、诊断及鉴别诊断。
4 推荐影像学检查方法
参照2011年牛津大学循证医学中心证据分级系统的推荐、评估、发展和评价分级(the grading of recommendations assessment development and evaluate,GRADE)工作组推荐意见形成的方法学[16-17],制定本共识依托的证据级别和推荐强度分级标准及定义,参见表1。
4.1 推荐超声作为肝包虫病的首选筛查方法(证据级别:Ⅲ,推荐强度:强) 超声检查既可作为肝包虫病的首选筛选方法,也是术后随访或药物治疗后判定疗效的主要检查方法[18](证据级别:Ⅳ,推荐强度:强)。但超声结果易受操作者技术水平的影响,不同医院和地区之间的诊断水平仍存在差距,且超声图像不如CT、MRI直观。因此,不典型的病例建议其他影像学方法进一步检查。
超声造影的价值在于明确部分病灶周围的血供情况,从而间接提示病灶的浸润特性或虫体活性[19],但其临床价值尚未得到广泛认可和应用,故不推荐作为常规的影像检查手段。
4.2 推荐CT 作为肝包虫病的常规检查方法(证据级别:Ⅳ,推荐强度:强) 常规肝区CT平扫和增强扫描,推荐肝区螺旋CT 多期(动脉期、门静脉期和静脉期)增强扫描。CT成像的优势在于全面显示包虫病灶的特点,尤其对钙化显示敏感(证据级别:Ⅳ,推荐强度:强);CT血管成像能够准确显示肝动脉、门静脉、肝静脉主干及下腔静脉与病灶的毗邻关系[20](证据级别:Ⅳ,推荐强度:弱)。
4.3 推荐MRI作为肝包虫病的必要补充检查方法(证据级别:Ⅳ,推荐强度:强) 鉴于高场强MR 设备扫描时间短、成像速度快、图像质量高、覆盖范围广、图像更清晰、诊断更准确等诸多优点,推荐检查设备场强为1.5或3.0 T(证据级别:Ⅳ,推荐强度:强)。推荐检查序列包括:(1)T1WI:轴面快速自旋回波(FSE/TSE)等序列(证据级别:Ⅳ,推荐强度:强);(2)T2WI:轴面FSE/TSE等序列(证据级别:Ⅳ,推荐强度:强);(3)T2WI脂肪抑制序列:轴面及冠状面FSE/TSE等序列(证据级别:Ⅳ,推荐强度:强);(4)DWI:b 值500~1000 s/mm2(证据级别:Ⅳ,推荐强度:弱);(5)MR胰胆管成像(MR cholangiopancreatography,MRCP):2D及3D序列(证据级别:Ⅳ,推荐强度:强)。增强扫描序列作为选择性项目,目前尚无证据推荐MRI增强扫描作为检查常规序列。
MRI具有多方位、多参数、高软组织分辨率等优点,是对包虫相关影像学检查方法的重要补充。研究[21]显示单纯性肝囊肿与单囊型肝包虫ADC值存在显著差异,能够进行鉴别诊断,此外,AE病灶实质在DWI序列上一般无扩散受限,可作为与恶性肿瘤的鉴别要点之一[22],但DWI图像不足以显示包虫病灶形态结构特征,无法单独作出定性诊断,故不作为强推荐成像方法。MRCP对特征性的小囊泡显示最佳,同时也是显示胆管并发症的最佳成像方法[23]。
4.4 建议PET/CT作为评价肝包虫病药物治疗效果的首选监测方法(证据级别:Ⅳ,推荐强度:弱) 使用18F-氟代脱氧葡萄糖(18F-FDG)作为示踪剂,采用标准18F-FDG采集(注射示踪剂后1 h)和延迟采集(注射示踪剂后3 h)(证据级别:Ⅳ,推荐强度:弱)。
不推荐PET/CT作为诊断肝包虫病的常规检查手段,其主要价值在于根据放射性药物摄取的程度来判断泡型包虫的生物学活性及药物治疗效果的评价[24]。
5 影像学表现
5.1 肝包虫病分型
5.1.1 临床分型 CE目前临床上主要使用的标准化分型为WHO包虫病专家工作组(WHO Informal Working Group on Echinococcosis,WHO/IWGE)在Gharbi超声分型基础上制定并达成共识的分型方案[25],此分型将CE分为6型:囊型病灶(CE)、单囊型(CE1)、多子囊型(CE2)、内囊塌陷型(CE3)、实变型(CE4)、钙化型(CE5)。并针对包虫的大小分为3类:直径<5 cm,称为小包虫,记为S;直径为5~10 cm,称为中等包虫,记为M;直径>10 cm称为大包虫,记为L。生物学特征:有活性(1 组:CE1 和CE2型)、过渡型(2组:CE3a和CE3b型)和无活性(3组:CE4和CE5型)。
AE 采用的WHO/IWGE 共识的标准化分型为Kern等[26]提出的PNM分型[P=病灶在肝内的位置(parasitic mass in the liver),N=邻近器官的受累(involvement of neighbouring organs),M= 转移(metastasis)],与CE的分型基于影像学不同,该分型主要针对临床治疗。2002年温浩等[27]根据临床需求提出PJVM 分型[P=病灶在肝内的位置(parasitic mass in the liver),J=黄疸(jaudice),V=血管受累(vessels),M=转移(metastasis)]。该分型将肝AE病灶范围、直接浸润和远处转移程度综合表述,对外科医师拟定治疗方案有重要意义。
5.1.2 影像学分型 CE的影像分型与临床分型基本保持一致,而AE分型目前尚未达成共识,目前比较认同的是Kodama等[28]提出的基于肝脏AE以小囊泡为特征的MRI分型方法。此分型根据AE灶内实性和囊性成分的构成和小囊泡的分布模式将影像学特征分为以下5种类型:多个小囊泡无实性成分(1型)、具有实性成分及多个小囊泡(2型)、围绕有多个小囊泡的中心合并大和/或不规则囊肿的实性肿块(3型)、实性肿块无囊泡成分(4型)、大囊肿无实性成分(5型)。此分型在一定程度上反映了AE的生物学演变进程。
5.2 超声表现[18,20,24-25]
5.2.1 CE 依据临床分型,CE1型为圆形、回声均匀的囊性病灶,内、外囊壁间有潜在的间隙,呈现“双壁征”;囊肿后壁呈明显回声增强;用探头震动囊肿时,可见浮动的小光点,称为“落雪征”。CE2型表现为母囊暗区内呈现多个小的球形暗影及光环,形成“囊中囊/子囊”的影像征象。CE3型系肝包虫内破裂,囊液进入内、外囊壁间,出现“套囊征”“天幕征”“飘带征”。CE4型表现为高回声肿块,不易与肿瘤鉴别,此时包虫囊液吸收,囊壁折叠收缩,超声检查示回声强弱相间呈“脑回征”。CE5型表现为囊壁肥厚钙化,呈宽大声影及侧壁声影。
(1)基本病变:肝脏囊性占位,表现为圆形、回声均匀的无回声囊性病灶并囊肿后方回声增强。
(2)特殊征象:①内、外囊壁显示呈现“双壁征”;②含子囊型包虫表现为母囊暗区内的多个球形暗影及光环,形成“囊中囊/子囊征”;③内囊塌陷、破裂漂浮于囊液中,表现为“水中百合花征”“天幕征”“飘带征”;④囊肿实变,囊液吸收,囊壁折叠收缩形成“脑回征”;⑤囊壁部分或完全钙化,表现为强回声伴后方宽大声影。
(3)次要征象:包虫囊肿的囊砂(头节)增多显示为沉积于囊肿底部的密集点状强回声,随着体位改变而漂浮于囊液中,用探头震动囊肿时可见浮动的小光点,表现为“落雪征”。
5.2.2 AE 超声显示肝实质性肿块,可探及高、低混合回声光团,周围边界模糊,后方声束衰减,同时显示肝脏增大。多房棘球蚴病灶在侵蚀肝组织的过程中会发生钙盐沉积,早期即出现点状钙化颗粒,随着病程延长,钙化颗粒融合成絮状或不规则的大片钙化灶,在病灶内可探及散在钙化点或不规整的大片钙化强回声光团伴声影。较大的AE灶中心部因缺血坏死、液化,可形成形态不规整的坏死液化空腔。超声显示在不均质强回声光团内出现形态不规则、无回声的大块液性暗区,后方回声增强,呈“虫蚀状”或“熔洞状”。超声造影检查动脉早期至门静脉晚期病灶周边出现“边框样”强化,内部无强化,呈“黑洞征”。
(1)基本病变:肝脏实质性不均匀的强回声肿块。
(2)特殊征象:①内部回声不均伴点状、砂砾状及小圈状强回声钙化,后方伴声影;②病灶中央液化坏死,后方回声增强,呈“虫蚀状”或“熔岩状”。
(3)次要征象:超声造影检查动脉早期至门静脉晚期部分病灶周边出现“边框样”强化,内部无强化,呈“黑洞征”。
5.3 CT表现[19-20,23]
5.3.1 CE CE1型表现为类圆形囊性病灶,内呈水样密度,囊壁较厚时能够显示,增强扫描病变不强化(图1a);CE2型呈现子囊征象,依据母囊囊液的含量及子囊的排列呈现“囊内囊”“轮辐征”“蜂房征”(图1b),母囊囊液密度高于子囊;CE3型囊壁分层呈现“双壁征”,内囊壁塌陷,漂浮在囊液中表现为“飘带征”(图1c),如合并胆瘘或感染,囊内出现气体,呈现“水上浮莲征”;CE4型表现为实性软组织密度占位,多能见到较厚的囊壁,囊内密度不均匀,增强扫描病灶边界清楚,不强化;CE5型囊壁呈现厚壳状钙化,囊内容物密度增高,部分或全部钙化(图1d)。
(1)基本病变:肝脏圆形或类圆形边缘光滑锐利的囊性占位,增强后无异常强化。
(2)特殊征象:①囊壁显示,表现为线状稍高密度带;囊壁可呈弧线状、蛋壳样钙化。②含子囊型包虫依据子囊的数目和排列不同呈现“囊内囊”“轮辐征”“蜂房征”等多房状外观。③内囊膜从外囊剥离,呈现“双壁征”“新月征”,完全塌陷/漂浮在囊液中,表现为“飘带征”“水蛇征”“水上浮莲征”。
5.3.2 AE CT成像表现为不均质的实质性肿块,增强扫描后病灶本身不强化,但因为周围肝实质的强化其境界显示清楚;病灶实质内往往出现数量不等的钙化,小囊泡和小圈状钙化最具特征,病灶中心出现液化坏死,构成“地图征”样外观(图1e);病灶邻近的肝实质边缘收缩凹陷,健侧肝叶或段呈代偿增大。
(1)基本病变:肝内混杂密度呈实性或囊实性肿块,增强后不强化。
(2)特殊征象:①病灶内部及边缘区“小囊泡”征象;②病灶内部及边缘的“小圈状”“颗粒状”钙化;③病灶中央液化坏死,呈现“地图征”。
(3)次要征象:①邻近肝实质萎缩、凹陷;②健侧肝脏代偿性增大。
5.4 MRI表现[19,22-23]
5.4.1 CE CE1 型为圆形边缘光滑锐利的囊性病灶,呈长T1、长T2信号,信号均匀;囊壁在T2WI上呈低信号,厚薄均匀一致(图1f)。CE2型呈现“囊中囊”影像,母囊内含有多个子囊时表现为“玫瑰花瓣征”(图1g)或“轮辐征”;子囊信号在T1WI上低于母囊,在T2WI上高于母囊。CE3型,塌陷的内囊悬浮于囊液中形成“飘带征”(图1h)。CE4型内部信号混杂,MRI对塌陷皱缩的内囊显示优于CT,表现为脑回状稍短T2信号(图1i),囊壁在T2WI上始终为低信号。CE5型囊壁钙化在T1WI和T2WI上均为低信号(图1j)。
(1)基本病变:肝脏圆形或类圆形边缘光滑锐利的病灶,囊液在T1WI表现为低信号,T2WI表现为高信号,信号均匀,增强后无异常强化。
(2)特殊征象:①囊壁在T2WI上呈低信号,厚度均匀一致。②含子囊型包虫T2WI上可见高信号的病灶中出现条形低信号的分隔而表现为“囊中囊”“玫瑰花瓣征”“轮辐征”,子囊信号在T2WI上高于母囊。③囊膜剥离呈现双边低信号的“双壁征”“新月征”;内囊塌陷悬浮于囊液中形成“飘带征”“水蛇征”。④囊肿萎缩实变,塌陷皱缩呈脑回状T2WI低信号。
5.4.2 AE 肝AE为不规则实性病灶,浸润性生长,边缘欠清晰,病灶在T1WI、T2WI 上均以低信号为主,尤其是在T2WI上的低信号为其特征性表现,小囊泡在T2WI上呈偏高信号;病灶内可发生液化坏死,表现为“熔洞征”或“地图征”(图1k);增强后病灶内不发生强化。MRCP检查对小囊泡的显示最佳(图1l)。
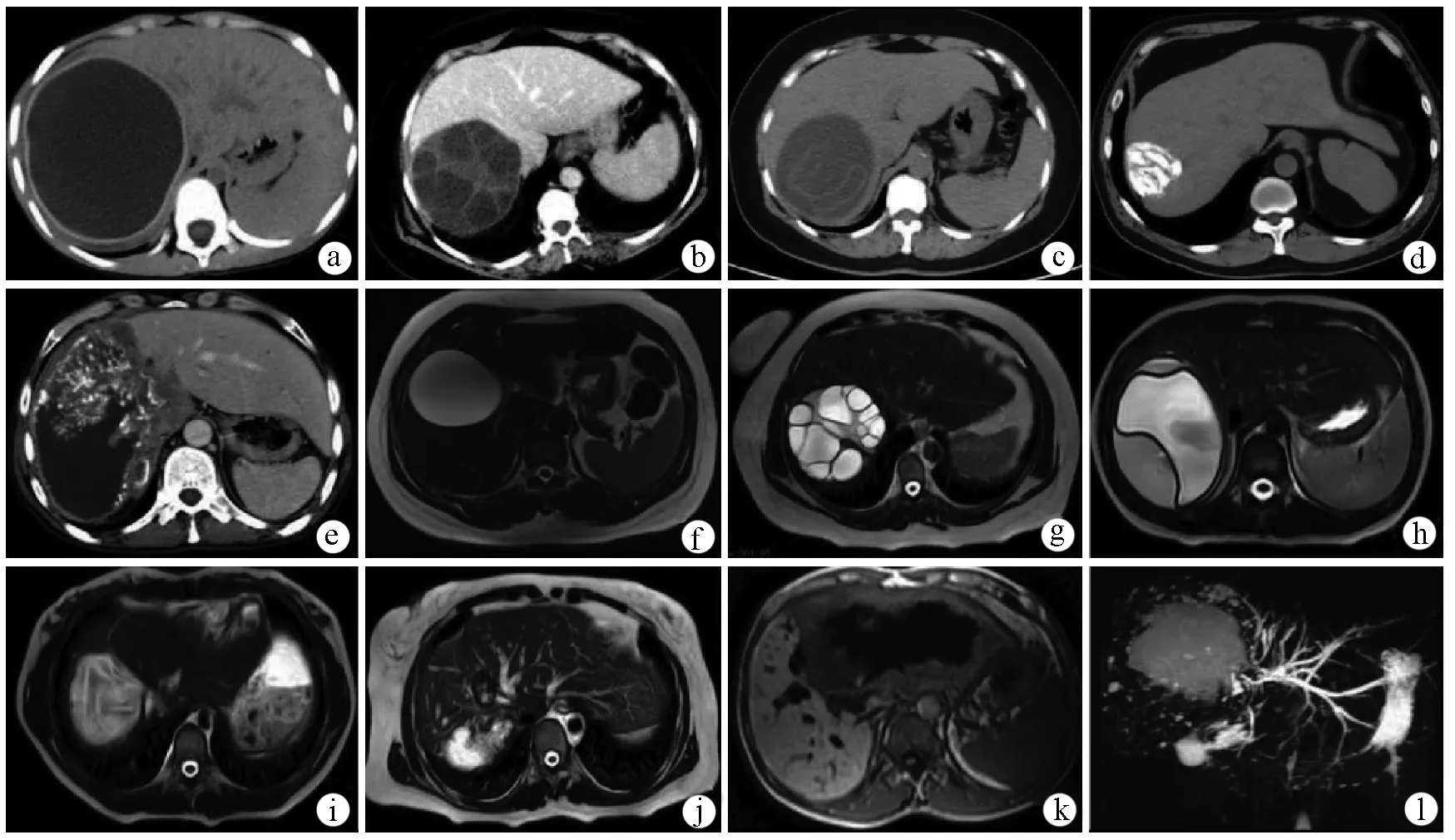
注:a为CE1型,CT平扫显示肝右叶类圆形水样密度病灶,囊壁较厚伴钙化;b为CE2型,CT增强静脉期显示多子囊型包虫囊肿呈“囊内囊”“轮辐征”;c为CE3型,CT平扫显示包虫囊肿内囊壁塌陷并漂浮在囊液中呈“飘带征”;d为CE5型,CT平扫显示囊壁及囊内容物全部钙化;e为AE,CT增强静脉期显示肝右叶不均质的实性肿块,病灶内可见小囊泡和钙化,中心可见液化坏死区,共同构成“地图征”样外观;f为CE1型,T2WI显示肝右叶边缘光滑的囊性病灶,信号均匀;囊壁呈厚薄均匀一致的低信号;g为CE2型,T2WI显示多子囊型包虫囊肿呈“囊内囊”“玫瑰花瓣征”;h为CE3型,T2WI显示塌陷的内囊悬浮于囊液中形成“飘带征”;i为CE4型,T2WI显示包虫囊肿内部信号不均匀,塌陷皱缩的内囊显示为脑回状稍低T2信号;j为CE5型,T2WI显示肝右前叶上段类圆形病灶,囊壁或囊内容物的钙化部分显示为低信号;k为AE,T1WI显示肝左叶病灶以低信号为主,病灶内的液化坏死区表现为“熔洞征”或“地图征”;l为AE,MRCP显示病灶实质内特征性的高信号“小囊泡”结构。图1 肝包虫病影像学表现
(1)基本病变:肝内不规则无包膜的实性或囊实性占位,在T1WI/T2WI上多呈低信号为主的混杂信号,增强后无异常强化。
(2)特殊征象:①病灶内部及边缘显示在T2WI上及MRCP上呈高信号的“小囊泡/囊泡巢”;②病灶中心可出现T2WI上高信号的液化坏死腔,使病灶外观呈“熔洞征”。
(3)次要征象:①DWI显示病灶外周稍高信号的“浸润带”或“晕带征”;②MRCP显示病灶侵蚀破坏胆管引起胆管梗阻。
5.518F-FDG PET/CT表现[24]PET显示肝AE灶边缘不均匀性弧形、环形或中心结节样的放射性浓聚影标准摄取值最大值(standardized uptake value,SUVmax)高于肝实质,或病灶中心呈放射性分布稀疏减低或缺损(SUVmax等于或低于肝实质)。
6 诊断标准
6.1 疑似病例 发现肝脏占位,有疫区生活史或接触史。
6.2 影像诊断病例 符合上述影像学表现(超声表现、CT表现、MRI表现)中基本病变+特殊征象中的任意1项以上者,或1项特殊征象+1项次要征象。
次要征象作为治疗前分期及特殊征象不典型时辅助诊断。
6.3 确诊病例 手术/病理证实。
7 诊断流程
首先,针对来自包虫病流行区旅居的临床疑似病例进行病史询问及体格检查,对出现腹痛、腹胀、黄疸、消瘦等症状且体检怀疑肝脏占位的患者进行超声检查,根据检查结果筛选出肝脏占位病变和正常肝脏,同时将肝脏占位病变区分为肝包虫病、不典型肝脏占位及其他肝脏占位病变,对不典型肝脏占位病变补充CT或MRI检查,结合2种以上影像学检查并根据肝包虫影像学表现(超声、CT、MRI)中基本病变+特殊征象中的任意1项以上者,或1项特殊征象+次要征象鉴别出肝包虫病影像确诊病例,并明确肝包虫病的临床分型;依据术前影像学肝脏脉管结构和功能评价(CTA、MRCP)尽早对肝包虫病进行根治性手术切除,对不可切除病例实行药物治疗,定期行影像学检查(超声、CT、MRI、PET/CT)随访监测评估。
8 鉴别诊断
8.1 单纯性肝囊肿 需要与单囊型CE进行鉴别,单纯性肝囊肿患者多数无流行病学史,无囊壁显示,无钙化,囊液均匀,无“囊沙征”“双层壁”及囊壁“弧形钙化”等典型影像学特征,免疫学检查多呈阴性反应。
8.2 细菌性肝脓肿 需要与CE合并感染相鉴别,细菌性肝脓肿表现为厚壁的囊性病灶,有时囊内可见气-液平面,CT增强扫描显示脓肿壁强化,外周伴有低密度水肿带;全身中毒症状较重,白细胞计数明显升高,包虫病血清学检查多为阴性。
8.3 肝囊腺瘤 具有多房样结构,需与多子囊型CE鉴别。肝囊腺瘤常有向腔内生长的实性壁结节,增强扫描有轻度强化;囊壁多无环形或弧形钙化,囊内分隔可见强化。
8.4 肝内胆管细胞癌 肝AE与肝内胆管细胞癌都可以出现病灶邻近肝缘的收缩凹陷和病灶边缘胆管扩张,因此需要进行鉴别。肝内胆管细胞癌表现为肝内实性肿块,增强后其边缘显示花边样强化或者内部延迟强化,而肝AE灶本身不强化,如果发现特征性的小囊泡和钙化更是区别于肿瘤的重要影像依据。
执笔者:刘文亚(新疆医科大学第一附属医院影像中心)、蒋奕(四川大学华西第二医院影像诊断科)、王健(新疆医科大学第一附属医院影像中心)
专家共识协作组成员(按照姓氏拼音顺序排序):边杰(大连医科大学附属第二医院放射科)、陈昊(南京中医药大学针灸推拿学院养生康复学院针灸临床教研室)、崔光彬(空军军医大学唐都医院放射诊断科)、蒋奕(四川大学华西第二医院影像诊断科)、李宏军(首都医科大学附属北京佑安医院放射科)、李莉(首都医科大学附属北京佑安医院放射科)、刘晶哲(清华大学第一附属医院放射影像科)、刘强(山东省医学影像学研究所MR 诊断研究室)、刘文亚(新疆医科大学第一附属医院影像中心)、任美吉(首都医科大学附属北京佑安医院放射科)、施裕新(复旦大学附属上海公共卫生临床中心放射科)、王红(新疆医科大学第二附属医院放射影像科)、王红梅(内蒙古自治区人民医院影像医学科)、王俭(新疆医科大学第一附属医院影像中心)、王健(新疆医科大学第一附属医院影像中心)、熊鑫鑫(新疆医科大学第一附属医院影像中心)、许建荣(上海交通大学附属仁济医院放射影像科)、杨州(山西医科大学第一医院CT诊断科)、殷小平(河北大学附属医院CT/MRI诊断科)、张凯(内蒙古自治区人民医院影像医学科)、张铁亮(新疆医科大学第一附属医院影像中心)、张晓琴(内蒙古自治区人民医院影像医学科)
利益冲突声明:所有作者均声明不存在利益冲突。
